| |
| Med Sci (Paris). 2014 March; 30(3): 242–244. Published online 2014 March 31. doi: 10.1051/medsci/20143003007.L’aspartate Un acide aminé essentiel à la physiologie et à la virulence du bacille de la tuberculose Alexandre Gouzy,1,2 Yannick Poquet,1,2 and Olivier Neyrolles1,2* 1Centre national de la recherche scientifique (CNRS), UMR 5089, Institut de pharmacologie et de biologie structurale (IPBS), IPBS, 205, route de Narbonne, 31077Toulouse Cedex 04, France 2Université de Toulouse, Université Paul Sabatier, IPBS, Toulouse, 31077, France MeSH keywords: Systèmes de transport d'acides aminés, physiologie, Animaux, Acide aspartique, pharmacologie, Humains, Macrophages, métabolisme, Mycobacterium tuberculosis, pathogénicité, Azote, Tuberculose, microbiologie, Virulence, effets des médicaments et des substances chimiques |
Mieux comprendre les mécanismes d’acquisition et d’assimilation des nutriments par les pathogènes bactériens au sein de leur hôte pourrait permettre d’identifier des voies métaboliques pouvant être inhibées à l’aide de nouveaux antibiotiques.
Mycobacterium tuberculosis, l’agent de la tuberculose, est un pathogène intracellulaire facultatif qui se multiplie à l’intérieur des macrophages dans lesquels il réside, dans un compartiment (le phagosome) où les sources de nutriments sont peu disponibles. Plusieurs études ont permis de mettre en évidence la capacité de M. tuberculosis d’exploiter de nombreuses sources de carbone, telles que les triglycérides et le cholestérol, pour proliférer au sein de son hôte [
1,
2]. L’azote, comme le carbone, entre dans la composition de biomolécules majeures telles que les acides aminés ou les nucléotides, et constitue un élément essentiel à la vie. Cependant, contrairement aux besoins en carbone, peu de choses sont connues en ce qui concerne les besoins en azote des pathogènes intracellulaires, et de M. tuberculosis en particulier, au cours de l’infection. Nous avons pu récemment mettre en évidence qu’un acide aminé, l’aspartate, constituait une source majeure d’azote utilisée par la bactérie pour infecter son hôte [
3]. |
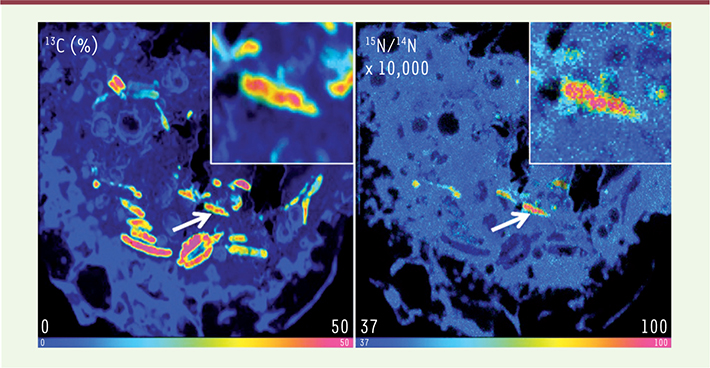
L’aspartate est accessible à M. tuberculosis au sein des macrophages Il est intéressant de se demander comment les nutriments, comme l’aspartate, ont accès au phagosome de M. tuberculosis. En utilisant une technique dite de NanoSIMS (secondary ion mass spectrometry), associant l’imagerie à la spectrométrie de masse, nous avons pu montrer que cet acide aminé s’accumule au sein des phagosomes renfermant le bacille (Figure 1). L’aspartate entre dans des cellules de mammifères grâce à des transporteurs de la superfamille des solute carriers (SLC), en particulier ceux appartenant à la famille des transporteurs de haute affinité du glutamate et des acides aminés neutres (SLC1) et des transporteurs d’acides aminés cationiques (SLC7). Parmi ces transporteurs, nous avions montré que le transporteur d’aspartate SLC1A2 est exprimé fortement par des macrophages humains en réponse à une infection par M. tuberculosis [
4]. L’augmentation de l’expression de ce transporteur pourrait ainsi favoriser la multiplication du bacille tuberculeux à l’intérieur des cellules, ce qui reste à déterminer.
 | Figure 1.
L’aspartate est accessible à M. tuberculosis dans les macrophages. Analyse par NanoSIMS de la colocalisation (flèche montrant une bactérie grossie dans l’insert) de M. tuberculosis marqué au 13C (gauche) dans un macrophage infecté, incubé en présence d’aspartate marqué au 15N (droite). L’échelle de couleur représente l’enrichissement en 13C (gauche) ou 15N (droite) (© Ting-Di Wu et Jean-Luc Guerquin-Kern, Institut Curie, laboratoire de microscopie ionique, Inserm U759, Orsay, France). |
|
Mycobacterium tuberculosis utilise le transporteur AnsP1 pour capturer l’aspartate Grâce à une approche de mutagenèse dirigée, nous avons pu montrer que l’import de l’aspartate chez M. tuberculosis est assuré par un transporteur unique, appelé AnsP1, et que ce transporteur est requis pour la multiplication du bacille chez l’animal. Il est surprenant de constater que AnsP1 appartient à la classe des transporteurs d’acides aminés originalement prédits pour transporter l’asparagine, et ne possède pas d’homologie avec les transporteurs d’acides aminés dicarboxyliques classiquement impliqués dans le transport de l’aspartate. Un homologue de AnsP1, appelé AnsP2, avec lequel AnsP1 partage un niveau élevé de similitude (83 %), existe chez M. tuberculosis, mais ne compense pas la fonction de AnsP1 pour l’import d’aspartate. La spécificité unique d’AnsP1 pour l’aspartate suggère une évolution sélective de ce transporteur qui a pu conférer un avantage au pathogène pour sa multiplication à l’intérieur des cellules humaines. De façon intéressante, le transporteur AnsP1 est dupliqué chez le pathogène intracellulaire obligatoire Mycobacterium leprae, l’agent étiologique de la lèpre, et constitue même l’unique transporteur d’acide aminé fonctionnel chez ce pathogène. Ceci suggère un rôle important de l’utilisation de l’aspartate dans la pathogénicité du bacille de la lèpre. |
L’aspartate, une source d’azote chez M. tuberculosis
Comment l’azote et le carbone contenus dans l’aspartate sont-ils transférés vers d’autres molécules chez M. tuberculosis ? Grâce à des approches de métabolomique, nous avons pu suivre au niveau atomique le devenir de l’azote et du carbone contenus dans l’aspartate, et démontrer que cet acide aminé sert essentiellement de source d’azote, et non de carbone, pour le métabolisme mycobactérien. L’assimilation de l’azote de l’aspartate fait intervenir des réactions de transamination permettant la formation de glutamate et de glutamine, deux métabolites centraux agissant comme donneurs majeurs d’azote pour la synthèse de la majorité des constituants azotés présents chez la bactérie. Chez M. tuberculosis, deux aspartate transaminases, appelées AspB et AspC, sont prédites pour permettre le transfert de l’azote de l’aspartate vers le glutamate [
5]. De façon intéressante, le gène aspC serait essentiel chez la bactérie, indiquant que AspC serait majoritairement impliquée dans la synthèse d’aspartate à partir de glutamate [
6]. L’inactivation de ce gène rendrait ainsi la bactérie incapable de se multiplier en l’absence d’aspartate. À l’inverse, aspB n’est pas essentiel à la croissance de la bactérie in vitro ; or, ce gène est plus fortement exprimé par la bactérie dans des conditions mimant l’environnement intracellulaire [
7]. AspB pourrait ainsi être impliqué dans l’assimilation de l’azote de l’aspartate au cours de l’infection, et pourrait être requis pour la virulence de M. tuberculosis. AspB et AspC possèdent des protéines homologues, appelées Rv0858c et Rv1178, dont on pense qu’elles possédent également une activité aspartate aminotransférase ; celles-ci pourraient ainsi constituer une voie alternative pour l’assimilation de l’azote de l’aspartate chez le bacille tuberculeux. |
Vers des applications thérapeutiques ? Le rôle de l’aspartate dans la virulence de M. tuberculosis soulève certaines questions concernant le potentiel thérapeutique d’inhibiteurs d’enzymes utilisant l’aspartate comme substrat. Outre son rôle de donneur d’azote, l’aspartate possède un rôle non redondant et essentiel dans le métabolisme bactérien. De ce fait, certains enzymes impliqués dans le métabolisme de l’aspartate, nommément l’aspartate décarboxylase PanD, l’aspartokinase ASK et la β-semialdéhyde déhydrogénase ASD, sont considérés comme des cibles thérapeutiques prometteuses pour l’élaboration de nouveaux anti-tuberculeux [
8–
10]. Chez M. tuberculosis, PanD est l’unique enzyme assurant la décarboxylation de l’aspartate qui permet la formation de vitamine B5, un précurseur du coenzyme A (CoA). Le CoA est essentiel au fonctionnement du métabolisme des acides gras et à la viabilité de M. tuberculosis [10]. Les enzymes ASK et ASD sont, quant à eux, impliqués dans la synthèse des acides aminés appartenant à la famille de l’aspartate : la méthionine, la thréonine et l’isoleucine. Ces enzymes sont également impliqués dans la synthèse de l’acide diaminopimélique, un constituant de la paroi bactérienne synthétisé à partir d’aspartate et essentiel à la viabilité de la bactérie. Les enzymes ASK et ASD apparaissent donc comme des cibles thérapeutiques potentielles car elles ne possèdent pas d’homologues chez l’homme, et leur inhibition induirait de façon simultanée l’auxotrophie du pathogène (besoin absolu en aspartate) ainsi que la destruction de sa paroi [8,
9]. L’avenir et la recherche diront si l’inhibition des mécanismes liant la physiologie de l’azote, l’utilisation de l’aspartate en particulier, et la virulence chez M. tuberculosis, peut être envisagée à des fins thérapeutiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Daniel
J
,
Maamar
H
,
Deb
C
, et al.
Mycobacterium tuberculosis uses host triacylglycerol to accumulate lipid droplets, acquires a dormancy-like phenotype in lipid-loaded macrophages . PLoS Pathog.
2011; ; 7 : :e1002093.. 2.
Pandey
AK
,
Sassetti
CM
. Mycobacterial persistence requires the utilization of host cholesterol . Proc Natl Acad Sci USA.
2008; ; 105 : :4376.–4380. 3.
Gouzy
A
,
Larrouy-Maumus
G
,
Wu
TD
, et al.
Mycobacterium tuberculosis nitrogen assimilation and host colonization require aspartate . Nat Chem Biol.
2013; ; 9 : :674.–676. 4.
Tailleux
L
,
Waddell
SJ
,
Pelizzola
M
, et al.
Probing host pathogen cross-talk by transcriptional profiling of both Mycobacterium tuberculosis, infected human dendritic cells, macrophages . PLoS One.
2008; ; 3 : :e1403.. 5.
Cole
ST
,
Brosch
R
,
Parkhill
J
, et al.
Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence . Nature.
1998; ; 393 : :537.–544. 6.
Sassetti
CM
,
Boyd
DH
,
Rubin
EJ
. Genes required for mycobacterial growth defined by high density mutagenesis . Mol Microbiol.
2003; ; 48 : :77.–84. 7.
Fisher
MA
,
Plikaytis
BB
,
Shinnick
TM
. Microarray analysis of the Mycobacterium tuberculosis transcriptional response to the acidic conditions found in phagosomes . J Bacteriol.
2002; ; 184 : :4025.–4032. 8.
Chaitanya
M
,
Babajan
B
,
Anuradha
CM
, et al.
Exploring the molecular basis for selective binding of Mycobacterium tuberculosis Asp kinase toward its natural substrates and feedback inhibitors: a docking and molecular dynamics study . J Mol Model.
2010; ; 16 : :1357.–1367. 9.
Shafiani
S
,
Sharma
P
,
Vohra
RM
,
Tewari
R
. Cloning and characterization of aspartate-beta-semialdehyde dehydrogenase from Mycobacterium tuberculosis H37Rv . J Appl Microbiol.
2005; ; 98 : :832.–838. 10.
Sharma
R
,
Kothapalli
R
,
Van Dongen
AM
,
Swaminathan
K.
, Chemoinformatic identification of novel inhibitors against Mycobacterium tuberculosis L-aspartate alpha-decarboxylase . PLoS One.
2012; ; 7 : :e33521.. |