| |
| Med Sci (Paris). 2014 March; 30(3): 274–279. Published online 2014 March 31. doi: 10.1051/medsci/20143003015.Prokinéticines De nouveaux peptides régulateurs de la reproduction humaine Sophie Brouillet,1,2,3,4** Pascale Hoffmann,1,2,3,4 Nadia Alfaidy,2,3,4a and Jean-Jacques Feige2,3,4*a 1Centre hospitalier universitaire de Grenoble, hôpital couple-enfant, centre d’aide médicale à la procréation, CS 10217, 38043Grenoble Cedex 9, France 2Inserm U1036, biologie du cancer et de l’infection, iRTSV, CEA Grenoble, 17, rue des Martyrs, 38054Grenoble Cedex 9, France 3Commissariat à l’énergie atomique, institut de recherche en technologie et sciences pour le vivant, 38054Grenoble Cedex 9, France 4Université Grenoble-Alpes, 38041Grenoble, France |

La famille des prokinéticines est composée de la prokinéticine 1 (PROK1) et de la prokinéticine 2 (PROK2), deux biopeptides sécrétés qui possèdent de multiples fonctions dans l’organisme. Leurs actions sont relayées par deux récepteurs membranaires couplés aux protéines G, PROKR1 et PROKR2. Depuis sa découverte en 2001, un faisceau grandissant d’observations expérimentales placent le système de signalisation PROK/PROKR au cœur de la fonction reproductive masculine et féminine. Dans cet article, nous présentons les différents rôles des prokinéticines dans les fonctions testiculaire et ovarienne, ainsi que dans l’implantation embryonnaire, la grossesse et l’accouchement. |
Les prokinéticines : du venin de serpent aux glandes endocrines À la suite de la purification de deux peptides biologiques homologues à partir du venin du serpent mamba noir Dendroaspis polylepis et des sécrétions cutanées de la grenouille Bombina variegata, deux orthologues de ces peptides ont été identifiés chez l’homme en 2001. Ils ont été dénommés prokinéticine 1 (PROK1) et prokinéticine 2 (PROK2) en raison de leur capacité à stimuler la motilité intestinale [
1]. Le gène PROK1 comporte trois exons (Tableau I). À ce jour, aucun épissage alternatif n’a été rapporté. Le gène PROK2 comporte quatre exons. Ce gène code pour deux protéines matures : PROK2 (exons 1, 2 et 4) et une forme plus longue, PROK2L (exons 1, 2, 3 et 4). Les promoteurs du gène PROK2 et de son orthologue murin sont très conservés, ce qui suggère une régulation transcriptionnelle similaire, alors que ceux de PROK1 et de son orthologue murin ont divergé, ce qui suggère une spécificité dans la régulation transcriptionnelle de ces deux gènes [
2]. PROK1 est constituée de 86 acides aminés et sa masse moléculaire est de 8,6 kDa. PROK2 est composée de 81 acides aminés, et PROK2L de 102 acides aminés. Les séquences protéiques de PROK1 et PROK2 présentent 44 % d’identité [2]. Les prokinéticines humaines ont été initialement décrites comme des facteurs spécifiques des glandes endocrines, avec une expression majoritaire dans les ovaires, les testicules, les glandes surrénales et le placenta [1]. Toutes les protéines de cette famille possèdent une même séquence hexapeptidique, AVITGA, à leur extrémité amino-terminale [2]. Elle est indispensable à leur activité biologique et leur liaison aux récepteurs PROKR1 et PROKR2. Les prokinéticines possèdent également 10 résidus cystéine constituant cinq ponts disulfures particulièrement importants pour leur conformation [
3].
Tableau I.
|
Gènes |
Protéines |
|
Localisation chromosomique |
Structure exonique |
Épissage alternatif |
Nombre d'acides aminés |
|
PROK1
|
1p21 |
3 exons |
Non rapporté |
86 |
|
PROK2
|
3p21.1 |
4 exons |
PROK2 : exons 1, 2 et 4
PROK2L : exons 1, 2, 3 et 4 |
PROK2 : 81PROK2L : 102 |
|
PROKR1
|
2q14 |
2 exons |
Non rapporté |
393 |
|
PROKR2
|
20p13 |
2 exons |
Non rapporté |
384 |
Les prokinéticines et leurs récepteurs.
|
Les prokinéticines exercent leurs fonctions biologiques en se liant avec une affinité comparable à PROKR1 et PROKR2, deux récepteurs membranaires couplés aux protéines G (RCPG)1,. Les séquences protéiques des récepteurs des prokinéticines présentent environ 85 % d’identité, avec des différences majeures dans le domaine amino-terminal extracellulaire [2]. Il a été montré que chaque PROKR se liait spécifiquement à certaines protéines G et activait diverses cascades de signalisation intracellulaire [
4,
5]. Des effets biologiques distincts ont été décrits pour PROKR1 dans la prolifération et la migration cellulaires, et pour PROKR2 sur la perméabilité cellulaire [
6,
7]. PROKR1 et PROKR2 comportent deux exons chacun. Ces gènes codent, respectivement, pour des protéines de 393 et 384 acides aminés [2]. La distribution tissulaire variée de ces récepteurs et la diversité des répertoires de protéines G dans les différents types cellulaires expliquent la multitude de fonctions exercées par les prokinéticines [2]. Les prokinéticines sont notamment impliquées dans la motilité gastro-intestinale, la sensibilité à la douleur, l’angiogenèse, les rythmes circadiens, le développement du système olfactif périphérique, l’hématopoïèse, la différenciation des monocytes, l’activation des macrophages, la neurogenèse et la survie neuronale, le cycle menstruel, la reproduction [2] et la placentation [
8]. |
Les prokinéticines dans la physiopathologie de la reproduction Les gènes codant pour les prokinéticines ont des sites d’expression différents. Les transcrits de PROK1 sont abondants dans les ovaires et le placenta, tandis que ceux de PROK2 sont présents majoritairement dans les testicules et le système nerveux [2]. PROK2/PROKR2 dans le développement du système olfactif et de l’axe hormonal de la reproduction La GnRH ( gonadotropin releasing hormone), sécrétée par certains neurones de l’hypothalamus, est l’hormone centrale qui contrôle le développement des follicules ovariens chez la femme et la spermatogenèse chez l’homme. Les cellules neuroendocrines qui sécrètent la GnRH sont absentes de l’hypothalamus des individus atteints du syndrome de Kallmann ( →). Ce syndrome est caractérisé par une absence de développement pubertaire et une infertilité, associées à un déficit de l’odorat (anosmie ou hyposmie) qui s’accompagne, le plus souvent, d’une agénésie des bulbes olfactifs. Le phénotype des souris invalidées pour Prokr2 ou Prok2 ressemble à celui des patients atteints du syndrome de Kallmann [
9,
10]. Des mutations délétères de PROK2 ou de PROKR2 ont été identifiées, à l’état homozygote ou, plus souvent, hétérozygote, chez environ 7 % des patients atteints de ce syndrome [
11]. La signalisation PROK2/PROKR2 joue donc un rôle essentiel dans le développement embryonnaire du système olfactif et dans celui, qui lui est étroitement lié, des cellules neuroendocrines produisant la GnRH [
12].
(→) Voir la Nouvelle de F. Guimiot et al., m/s n° 2, février 2011, page 135
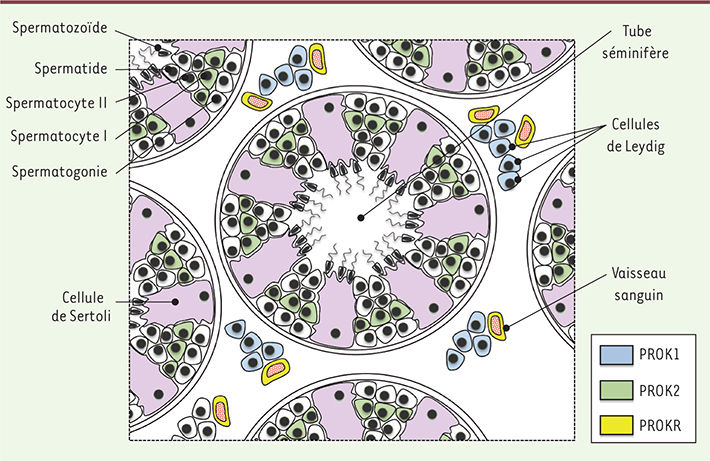
Les prokinéticines dans la reproduction PROK2/PROKR chez l’homme Les gènes codant pour les prokinéticines sont fortement exprimés dans les testicules de mammifères (Figure 1). Les transcrits de PROK1 sont présents essentiellement dans les cellules de Leydig [
13,
14], alors que ceux de PROK2 sont présents au sein des tubes séminifères, dans les spermatocytes primaires [ 13]. La synthèse de la protéine PROK1 par les cellules de Leydig a également été montrée [ 14]. PROK2 joue un rôle majeur dans l’angiogenèse testiculaire. Elle est impliquée non seulement dans l’angiogenèse testiculaire physiologique, au cours de laquelle elle induit la prolifération, la survie et la migration des cellules endothéliales [ 13], mais également dans l’angiogenèse tumorale [ 14]. La présence des transcrits de PROK2 dans les spermatocytes primaires, associée au rôle angiogénique de la protéine PROK2 dans le testicule, suggère que cette prokinéticine joue un rôle important dans la spermatogenèse. Des données récentes montrent une augmentation de l’ARNm de PROK2 dans le varicocèle testiculaire, et suggèrent un rôle potentiel de cette prokinéticine dans le risque d’infertilité associé à cette anomalie [
15]. Les transcrits codant pour les récepteurs des prokinéticines sont présents dans les cellules endothéliales du tissu interstitiel, ce qui suggère une participation de la signalisation PROK/PROKR dans la prolifération et la fenestration du réseau vasculaire testiculaire [ 13, 14]. Dans la prostate, PROK1 est synthétisée majoritairement par les cellules de l’épithélium glandulaire, et, dans le cancer de la prostate, son augmentation semble être associée au degré de malignité [
16]. Les transcrits des gènes codant pour PROK2 et ses récepteurs sont présents dans les cellules épithéliales prostatiques malignes en culture primaire. L’ensemble des résultats suggèrent une implication possible de la signalisation PROK/PROKR dans le cancer prostatique [ 16].
 | Figure 1.
Localisation des transcrits des prokinéticines et de leurs récepteurs dans le testicule. La présence des ARNm de PROK1, PROK2, ainsi que des PROKR est représentée respectivement en bleu, vert et jaune. |
PROK1/PROKR chez la femme PROK2 est pratiquement indétectable dans les organes reproducteurs féminins [
17,
18] et dans le placenta [ 8,
19], ce qui confère à PROK1 la place de prokinéticine majeure dans ces organes. • Expression dans l’ovaire : implications physiologiques et pathologiques Les transcrits du gène PROK1 sont abondants dans le stroma ovarien, en particulier dans les cellules de la région du hile qui produisent des stéroïdes [ 17] (Figure 2). L’expression de PROK1 fluctuerait selon le cycle ovarien, avec une présence importante des transcrits dans les cellules de la granulosa des follicules primordiaux, primaire et secondaire, suivie d’une baisse dans le follicule tertiaire [ 18]. Après l’ovulation, les ARNm de PROK1 sont de nouveau abondants dans le corps jaune et les follicules atrétiques [ 18,
20]. La présence des transcrits de PROK1 est intense dans les cellules lutéales de la thèque dès 8 jours après l’ovulation et jusqu’à la fin de la phase lutéale. La quantité des transcrits de PROK1 est augmentée in vitro par la gonadotrophine chorionique humaine (hCG), mais pas par la progestérone, ce qui suggère un rôle de PROK1 dans la formation du corps jaune [ 18]. La sécrétion de PROK1 est détectée dans le liquide folliculaire [
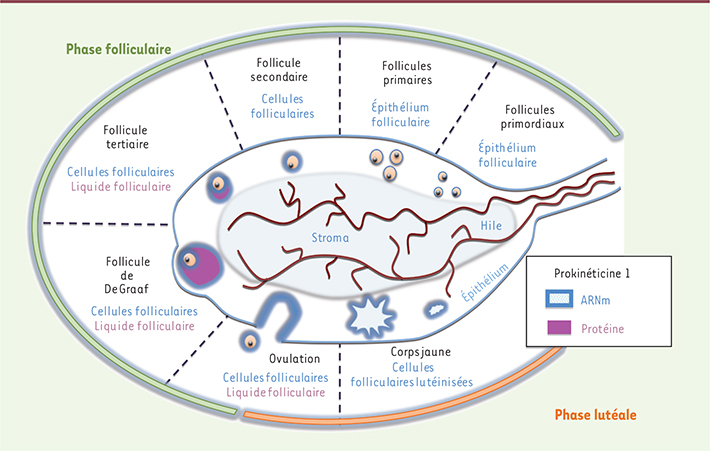
21]. Les gènes PROKR1 et PROKR2 sont fortement exprimés dans les cellules endothéliales lutéales, dont la prolifération est augmentée par PROK1. L’injection de PROK1 dans l’ovaire a un effet angiogène intense chez le rat [ 1]. Une expression anormale du gène PROK1 est associée à plusieurs maladies ovariennes, comme le syndrome des ovaires polykystiques [ 20] et le syndrome d’hyperstimulation ovarienne [ 21]. Le syndrome des ovaires polykystiques, caractérisé par une accumulation de follicules qui n’arrivent pas à maturité, est associé à une augmentation des transcrits de PROK1 [ 20]. De plus, il a été montré que l’injection dans l’ovaire d’adénovirus codant pour les prokinéticines augmentait la formation de kystes [ 1].
 | Figure 2.
Localisation de la prokinéticine 1 dans l’ovaire. La localisation des transcrits de PROK1 est indiquée en bleu, celle de la protéine en rose. |
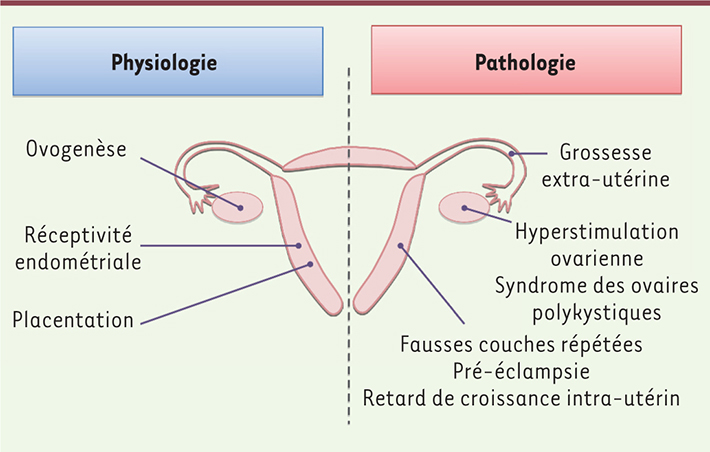
Le syndrome d’hyperstimulation ovarienne est une complication rare, mais potentiellement grave, de la stimulation ovarienne réalisée dans le cadre de la procréation médicalement assistée. Les concentrations sérique et folliculaire de PROK1 sont diminuées dans ce syndrome [21]. • Expression dans l’endomètre et le placenta : implications physiologiques et pathologiques lors de la grossesse Les taux circulants de PROK1 augmentent significativement pendant la grossesse [
22] : de 50 pg/ml environ chez la femme, ils atteignent en moyenne 250 pg/ml au premier trimestre de la grossesse, avant de baisser à 70 pg/ml en moyenne aux deuxième et troisième trimestres. Un nombre croissant de publications ont identifié le système PROK1/PROKR comme un acteur essentiel de l’implantation embryonnaire (Figure 3). Les prokinéticines sont présentes dans l’endomètre humain, mais seul le taux des transcrits de PROK1 semble varier au cours du cycle ovarien, augmentant pendant la fenêtre implantatoire. Les transcrits de PROK1 ne sont plus détectables dans l’endomètre après la ménopause, ce qui est conforme à la régulation de l’expression de ce gène par les œstrogènes et la progestérone. Un effet de PROK1 sur l’expression de gènes pro-implantatoires par l’endomètre a été rapporté [
23]. Concernant l’implantation embryonnaire, plusieurs publications ont conclu à une augmentation des prokinéticines dans les grossesses ectopiques [
24], ainsi que dans les fausses couches répétées [
25,
26]. Récemment, certaines variations de la séquence nucléotidique des gènes PROK1, PROKR1, et PROKR2 ont été associées aux fausses couches répétées [ 25], alors que d’autres variants semblent, au contraire, avoir un rôle protecteur aux stades précoces de la grossesse [
27].
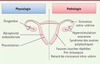 | Figure 3.
Rôles de la prokinéticine 1 dans l’implantation embryonnaire et le déroulement de la grossesse.
|
Le système PROK1/PROKR a été décrit comme un acteur important du développement placentaire [8]. Le pic d’expression de PROK1 et PROKR1 au cours du premier trimestre de la grossesse [19] est en cohérence avec un contrôle de l’expression de ces deux gènes par l’hypoxie locale de la chambre intervilleuse avant 12 semaines d’aménorrhée. Au cours du premier trimestre de la grossesse, PROK1 inhibe la migration cellulaire et la formation de réseaux pseudo-vasculaires par les cellules trophoblastiques extravilleuses via PROKR2, ce qui suggère un rôle inhibiteur du remodelage des artères spiralées maternelles in vivo [22]. La synthèse de PROK1 dans les cellules syncytiotrophoblastiques, alors que le VEGF, lui, est produit dans les cellules cytotrophoblastiques et les cellules trophoblastiques extravilleuses, suggère la complémentarité d’action de ces deux facteurs dans le développement et l’angiogenèse placentaires [7, 19,
28]. Un rôle direct de PROK1 sur les cellules endothéliales de la microvascularisation placentaire a également été décrit, avec une augmentation de la prolifération, de la survie, et de la migration de ces cellules via PROKR1, ainsi que de la perméabilité transcellulaire via PROKR2 [7]. Tous ces rôles participent à l’augmentation significative de l’angiogenèse placentaire par PROK1. Au cours de grossesses pathologiques, des dérèglements majeurs du système PROK1/PROKR ont été rapportés. En particulier, PROK1 est augmentée dans la pré-éclampsie (toxémie gravidique) [22], une maladie grave qui concerne 5-8 % des grossesses, et qui est caractérisée par une hypertension artérielle et une protéinurie apparaissant dans la deuxième moitié de la grossesse [
31]. Cette maladie peut conduire au décès de la mère et/ou de l’enfant à naître. La seule façon de sauver la mère est d’extraire le placenta quelle que soit la viabilité fœtale, ce qui explique la prématurité ou la mortalité néonatale liée à cette pathologie selon le terme de la grossesse. La synthèse de PROK1 et de ses récepteurs est également augmentée dans le retard de croissance intra-utérin [
29], qui concerne 10 % des grossesses. Cette anomalie peut menacer la survie de l’enfant à naître, et est associée à un risque accru de maladies métaboliques à l’âge adulte. Des études complémentaires sont nécessaires pour déterminer si l’augmentation de PROK1 est la cause ou la conséquence de ces maladies placentaires. Les prokinéticines sont des acteurs potentiels de l’accouchement prématuré et de l’accouchement à terme [
30]. L’augmentation des transcrits des deux prokinéticines dans le myomètre pendant le travail, et la présence des prokinéticines et de leurs récepteurs au sein de l’unité utéro-placentaire à terme, suggèrent une action globale des prokinéticines dans le déclenchement du travail [30]. Les prokinéticines induisent des cascades pro-inflammatoires et augmentent la contractilité des cellules musculaires lisses du myomètre, deux processus qui participent au déclenchement du travail prématuré et à terme [30]. À ce jour, l’implication directe des prokinéticines dans le déclenchement de l’accouchement n’est toujours pas établie. Néanmoins, l’induction par les prokinéticines des voies de signalisation intervenant dans le déclenchement du travail laisse entrevoir la possibilité d’une utilisation d’antagonistes de la signalisation PROK/PROKR dans la menace d’accouchement prématuré. |
Les rôles du système de signalisation PROK/PROKR dans la fonction reproductive masculine et féminine sont probablement multiples, et encore insuffisamment compris. La poursuite des recherches sur les dérèglements de ce système de signalisation dans la physiopathologie ovocytaire, testiculaire et implantatoire devrait déboucher sur de nouvelles perspectives thérapeutiques. |
Jean-Jacques Feige déclare participer à des rapports d’expertise pour Roche Pharma.
Sophie Brouillet, Pascale Hoffmann et Nadia Alfaidy déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
LeCouter
J
,
Kowalski
J
,
Foster
J
, et al.
Identification of an angiogenic mitogen selective for endocrine gland endothelium . Nature.
2001; ; 412 : :877.–884. 2.
Maldonado-Perez
D
,
Evans
J
,
Denison
F
, et al.
Potential roles of the prokineticins in reproduction . Trends Endocrinol Metab.
2007; ; 18 : :66.–72. 3.
Bullock
CM
,
Li
JD
,
Zhou
QY
. Structural determinants required for the bioactivities of prokineticins and identification of prokineticin receptor antagonists . Mol Pharmacol.
2004; ; 65 : :582.–588. 4.
Lin
R
,
LeCouter
J
,
Kowalski
J
,
Ferrara
N
. Characterization of endocrine gland-derived vascular endothelial growth factor signaling in adrenal cortex capillary endothelial cells . J Biol Chem.
2002; ; 277 : :8724.–8729. 5.
Soga
T
,
Matsumoto
S
,
Oda
T
, et al.
Molecular cloning and characterization of prokineticin receptors . Biochim Biophys Acta.
2002; ; 1579 : :173.–179. 6.
Nebigil
CG
. Prokineticin receptors in cardiovascular function: foe or friend? . Trends Cardiovasc Med.
2009; ; 19 : :55.–60. 7.
Brouillet
S
,
Hoffmann
P
,
Benharouga
M
, et al.
Molecular characterization of EG-VEGF-mediated angiogenesis: differential effects on microvascular and macrovascular endothelial cells . Mol Biol Cell.
2010; ; 21 : :2832.–2843. 8.
Brouillet
S
,
Hoffmann
P
,
Feige
JJ
,
Alfaidy
N
. EG-VEGF: a key endocrine factor in placental development . Trends Endocrinol Metab.
2012; ; 23 : :501.–508. 9.
Matsumoto
S
,
Yamazaki
C
,
Masumoto
KH
, et al.
Abnormal development of the olfactory bulb and reproductive system in mice lacking prokineticin receptor PKR2 . Proc Natl Acad Sci USA.
2006; ; 103 : :4140.–4145. 10.
Pitteloud
N
,
Zhang
C
,
Pignatelli
D
, et al.
Loss-of-function mutation in the prokineticin 2 gene causes Kallmann syndrome and normosmic idiopathic hypogonadotropic hypogonadism . Proc Natl Acad Sci USA.
2007; ; 104 : :17447.–17452. 11.
Dode
C
,
Teixeira
L
,
Levilliers
J
, et al.
Kallmann syndrome: mutations in the genes encoding prokineticin-2, prokineticin receptor-2 . PLoS Genet.
2006; ; 2 : :e175.. 12.
Guimiot
F
,
Teixeira
L
,
Dode
C
, et al.
Syndrome de Kallmann : une séquence fœtopathologique . Med Sci (Paris).
2011; ; 27 : :135.–137. 13.
LeCouter
J
,
Lin
R
,
Tejada
M
, et al.
The endocrine-gland-derived VEGF homologue Bv8 promotes angiogenesis in the testis: Localization of Bv8 receptors to endothelial cells . Proc Natl Acad Sci USA.
2003; ; 100 : :2685.–2690. 14.
Samson
M
,
Peale
FV, Jr
,
Frantz
G
, et al.
Human endocrine gland-derived vascular endothelial growth factor: expression early in development and in Leydig cell tumors suggests roles in normal and pathological testis angiogenesis . J Clin Endocrinol Metab.
2004; ; 89 : :4078.–4088. 15.
Tu
LH
,
Yu
LL
,
Xiong
CL
,
Zhang
HP
. Potential role of prokineticin 2 in experimental varicocele-induced rat testes . Urology.
2012; ; 80 : :952.
e15–9.
16.
Pasquali
D
,
Rossi
V
,
Staibano
S
, et al.
The endocrine-gland-derived vascular endothelial growth factor (EG-VEGF)/prokineticin 1 and 2 and receptor expression in human prostate: Up-regulation of EG-VEGF/prokineticin 1 with malignancy . Endocrinology.
2006; ; 147 : :4245.–4251. 17.
Ferrara
N
,
LeCouter
J
,
Lin
R
,
Peale
F
. EG-VEGF and Bv8: a novel family of tissue-restricted angiogenic factors . Biochim Biophys Acta.
2004; ; 1654 : :69.–78. 18.
Fraser
HM
,
Bell
J
,
Wilson
H
, et al.
Localization and quantification of cyclic changes in the expression of endocrine gland vascular endothelial growth factor in the human corpus luteum . J Clin Endocrinol Metab.
2005; ; 90 : :427.–434. 19.
Hoffmann
P
,
Feige
JJ
,
Alfaidy
N
. Expression and oxygen regulation of endocrine gland-derived vascular endothelial growth factor/prokineticin-1 and its receptors in human placenta during early pregnancy . Endocrinology.
2006; ; 147 : :1675.–1684. 20.
Ferrara
N
,
Frantz
G
,
LeCouter
J
, et al.
Differential expression of the angiogenic factor genes vascular endothelial growth factor (VEGF) and endocrine gland-derived VEGF in normal and polycystic human ovaries . Am J Pathol.
2003; ; 162 : :1881.–1893. 21.
Gao
MZ
,
Zhao
XM
,
Sun
ZG
, et al.
Endocrine gland-derived vascular endothelial growth factor concentrations in follicular fluid and serum may predict ovarian hyperstimulation syndrome in women undergoing controlled ovarian hyperstimulation . Fertil Steril.
2011; ; 95 : :673.–678. 22.
Hoffmann
P
,
Saoudi
Y
,
Benharouga
M
, et al.
Role of EG-VEGF in human placentation: Physiological and pathological implications . J Cell Mol Med.
2009; ; 13 : :2224.–2235. 23.
Haouzi
D
,
Mahmoud
K
,
Fourar
M
, et al.
Identification of new biomarkers of human endometrial receptivity in the natural cycle . Hum Reprod.
2009; ; 24 : :198.–205. 24.
Shaw
JL
,
Denison
FC
,
Evans
J
, et al.
Evidence of prokineticin dysregulation in fallopian tube from women with ectopic pregnancy . Fertil Steril.
2010; ; 94 : :1601.–1608 e1. 25.
Su
MT
,
Lin
SH
,
Lee
IW
, et al.
Polymorphisms of endocrine gland-derived vascular endothelial growth factor gene and its receptor genes are associated with recurrent pregnancy loss . Hum Reprod.
2010; ; 25 : :2923.–2930. 26.
Salker
M
,
Teklenburg
G
,
Molokhia
M
, et al.
Natural selection of human embryos: impaired decidualization of endometrium disables embryo-maternal interactions, causes recurrent pregnancy loss . PLoS One.
2010; ; 5 : :e10287.. 27.
Su
MT
,
Lin
SH
,
Chen
YC
, et al.
Prokineticin receptor variants (PKR1–I379V and PKR2–V331M) are protective genotypes in human early pregnancy . Reproduction.
2013; ; 146 : :63.–73. 28.
Brouillet
S
,
Hoffmann
P
,
Chauvet
S
, et al.
Revisiting the role of hCG: new regulation of the angiogenic factor EG-VEGF and its receptors . Cell Mol Life Sci.
2012; ; 69 : :1537.–1550. 29.
Brouillet
S
,
Murthi
P
,
Hoffmann
P
, et al.
EG-VEGF controls placental growth and survival in normal and pathological pregnancies: case of fetal growth restriction (FGR) . Cell Mol Life Sci.
2013; ; 70 : :511.–525. 30.
Catalano
RD
,
Lannagan
TR
,
Gorowiec
M
, et al.
Prokineticins: novel mediators of inflammatory and contractile pathways at parturition ? . Mol Hum Reprod.
2010; ; 16 : :311.–319. 31.
Rigourd
V
,
Chelbi
ST
,
Vaiman
D
. La pré-éclampsie . Med Sci (Paris).
2008; ; 24 : :1017.–1019. |