 |
| |||
Med Sci (Paris). 2014 April; 30(4): 359–365. Published online 2014 May 5. doi: 10.1051/medsci/20143004007.Le microenvironnement tumoral Matrice nourricière, champ de bataille et cible thérapeutique des cancers 1Centre de recherche des Cordeliers, Inserm UMRS 872, 15, rue de l’École de Médecine, 75006Paris, France 2Université Paris-Descartes, Paris, France Corresponding author. | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
Le cancer représente une des menaces majeures pour la santé de l’homme. Avec plus de dix millions de nouveaux cas et plus de cinq millions de morts par an, il est la première cause de mortalité dans de nombreux pays. Résultant de la dérégulation des mécanismes de prolifération, de survie et de différenciation cellulaires, le développement de cellules potentiellement cancéreuses est inhérent à l‘existence même de la vie. Il est donc vraisemblable que l’éradication complète des cancers est illusoire. Cependant, la comparaison des caryotypes de cellules cancéreuses à leur équivalent normal révèle de multiples anomalies, et c’est l’un des reflets des modifications génétiques de tous ordres qui caractérisent les cellules cancéreuses. Ces anomalies s’accumulent au cours d’un long processus qui permet successivement la transition d’une cellule normale à une cellule « potentiellement » cancéreuse ou précancéreuse, la formation d’une tumeur primitive localisée, l’invasion tissulaire et enfin le détachement de cellules cancéreuses de la tumeur primitive et leur intravasation, ce qui permet leur migration puis la formation de métastases à distance. La connaissance des processus qui aboutissent à la transformation maligne, au passage d’une tumeur précancéreuse à un cancer invasif et au développement de métastases permet de mettre en place de nouvelles approches de prévention et de thérapie visant à diminuer l’incidence, la morbidité et la mortalité des cancers. L’élément initial de la transformation d’une cellule normale, souvent épithéliale, en cellule potentiellement cancéreuse est l’acquisition d’une autonomie vis-à-vis des contrôles de la prolifération cellulaire, qui aboutit à la multiplication anarchique de cette cellule. L’acquisition de défauts dans les mécanismes naturels d’apoptose, qui permettent de contrôler le nombre de cellules d’un tissu et d’en éliminer des cellules anormales, est aussi impliquée. Ces modifications résultent souvent de mutations somatiques dans les gènes contrôlant la prolifération et la survie cellulaires (oncogènes et gènes suppresseurs de tumeurs). De multiples autres remaniements génétiques, - mutations, amplifications, fusions ou délétions de gènes - et épigénétiques, - méthylations, épissages différents d’ARN, surproduction de protéines, modifications de glycosylation et de lipides, permettront une invasion tumorale locale, la transition épithélio-mésenchymateuse et le détachement des cellules de la tumeur primitive pour former des métastases à distance [ 13] (→) par les voies sanguines, lymphatiques, sympathiques et parasympathiques. Durant toutes ces étapes, les cellules tumorales interagissent avec les éléments structuraux (matrice extracellulaire), cellulaires, dont les fibroblastes [ 14, 15] (→→), et moléculaires du tissu qui les enserre. Les éléments forment le microenvironnement tumoral, qui est très hétérogène et différent selon l’organe où naît et se développent la tumeur primitive et ses métastases. Cet environnement évolue conjointement à l’évolution du cancer et à l’invasion, qui sont elles-mêmes dépendantes du microenvironnement tumoral. Il est désormais clairement établi que le cancer ne résulte pas seulement d’une série d’événements oncogénétiques, mais que le microenvironnement est un partenaire à part entière et exerce un impact important sur l’évolution de la maladie. Ainsi, la progression et l’impact clinique d’une tumeur dépendent de la dynamique d’interactions entre les cellules malignes et leur microenvironnement. Comme le montrent les articles de ce numéro thématique de médecine/sciences, la majorité des éléments du microenvironnement favorisent le développement des tumeurs, et quelques uns le contraignent. Malgré la diversité des tissus et des cellules qui composent ce microenvironnement, un certain nombre de règles sont aujourd’hui établies, et leur application fournit des outils de compréhension, mais aussi de prévention, de pronostic et de traitement des cancers. Le présent numéro de médecine/sciences aborde les aspects essentiels des interactions entre les cellules tumorales et les diverses composantes de leur microenvironnement. Il met en place le rôle potentiel de ces différentes composantes aux différentes étapes du développement des cancers. (→) Voir la Synthèse de S. Hubert et J.P. Abastado, page 378 de ce numéro (→→) Voir les Synthèses de E. Buache et al., et de J. Albrengues et al., pages 385 et 391 de ce numéro | ||||||||||||||||||||||||||||||||||||||||||||||||
De nombreuses études épidémiologiques ont établi que l’exposition à certains agents chimiques ou physiques, ou à des agents infectieux, favorisait l’émergence de cancers. Parmi ces facteurs environnementaux, certains agissent directement sur la transformation maligne en modifiant l’ADN des cellules cibles par cassure (irradiation, UV), par adduits (tabac) ou en introduisant des oncogènes (certains papilloma virus [HPV16 ou HPV18] ou virus herpes [EBV, Epstein Barr virus]). Cependant, les facteurs environnementaux ont aussi une action sur le microenvironnement tumoral. L’exemple le plus démonstratif est celui de la bactérie Helicobacter pylori, qui induit un cancer de l’estomac non pas par transformation maligne, mais par l’induction d’une inflammation chronique accompagnée d’une forte production gastroduodénale de cytokines pro-inflammatoires (IL [interleukine]1, IL6, TNFα [tumor necrosis factor α]), qui sont aussi des facteurs de croissance pour les cellules épithéliales. Parallèlement, les macrophages recrutés au site inflammatoire produisent des agents augmentant la néovascularisation et la perméabilité vasculaire, apportant nutriments et oxygène à une tumeur naissante. Des études épidémiologiques ont montré qu’une antibiothérapie appropriée peut être un moyen de prévention du développement d’un cancer de l’estomac. De nombreux agents biologiques, physiques ou chimiques, présentés dans le Tableau I , favorisent l’émergence d’un cancer par un mécanisme similaire. L’inflammation chronique « formant le lit du cancer », d’autres états pathologiques capables de provoquer ce type d‘inflammation sont aussi des facteurs favorisants. Au premier rang se trouve l’obésité qui, par la modification du métabolisme, mais aussi par la création d’une inflammation adipeuse, est un facteur de risque majeur. Ainsi, du tissu adipeux est fréquemment observé à proximité des cancers invasifs, en particulier dans le cancer du sein [ 16] (→) (→) Voir la Synthèse de V. Laurent et al., page 398 de ce numéro
Les adipocytes sécrètent des molécules pro-inflammatoires, des molécules qui favorisent le remodelage de la matrice extracellulaire et libèrent des acides gras qui facilitent la croissance tumorale. Ces interactions constituent l’une des bases de l’augmentation de l’incidence et de l’agressivité des cancers chez les obèses. Les maladies inflammatoires du côlon (maladie de Crohn, rectocolite hémorragique, etc.), du poumon (bronchite chronique, silicose, etc.), de la plèvre (asbestose), du foie (cirrhoses alcooliques ou virales) sont elles aussi associées à une incidence accrue de cancers dans leurs organes respectifs et considérées comme des états précancéreux. La prise d’aspirine ou d’autres anti-inflammatoires a d’ailleurs montré une certaine efficacité dans la prévention des cancers du côlon. | ||||||||||||||||||||||||||||||||||||||||||||||||
Sur un terrain d’inflammation chronique et de forte vascularisation, des cellules ayant subi des premières modifications précancéreuses se multiplient et peuvent évoluer d’un état de dysplasie vers une tumeur bien encapsulée, souvent appelée carcinome in situ. L’ablation de la tumeur à ce stade est souvent curative mais, si elle n’est pas faite, la tumeur peut évoluer vers un cancer localement invasif. Les cellules immunitaires pénètrent dans les tumeurs solides par extravasation. Le réseau vasculaire apporte également les nutriments et l’oxygène nécessaires à la multiplication des cellules tumorales. Les cellules vasculaires prolifèrent au contact de ces dernières et s’agencent en vaisseaux tumoraux de manière anarchique [ 17, 18] (→) (→) Voir les Synthèses de S. Azzi et J. Gavard, et de S. Garrido-Urbani et al., pages 408 et 415 de ce numéro Durant cette période, qui peut durer des années, un combat s’engage entre la tumeur et une réaction immunitaire locale. Un bon exemple de l’évolution de la réponse immunitaire locale est celui des dysplasies de haut grade et des carcinomes in situ du col de l’utérus. Ces tumeurs sont la conséquence d’une infection par des formes particulières de papillomavirus (HPV16 et HPV18) [ 19]. Elles expriment des antigènes associés à la tumeur, codés par des gènes viraux, qui induisent une réaction immunitaire locale. Aussi longtemps que cette dernière est de type Th1 avec une forte production d’IFNγ (interféron) et de cellules T CD8+ cytotoxiques, la tumeur est contenue. Cependant, sous l’influence de molécules produites par les cellules transformées, la réaction peut être déviée vers une réaction immunitaire de type Th2 et suppressive, accompagnée d’un renforcement de la réaction inflammatoire chronique, en particulier sous l’influence de l’IL6 [ 20] (→) (→) Voir la Synthèse de M. Bruchard et F. Ghiringhelli, page 429 de ce numéro La tumeur devient alors un cancer invasif [ 1]. Ces états précancéreux sont des cibles idéales pour des approches vaccinales conçues pour prévenir l’évolution vers le cancer [ 2, 19]. | ||||||||||||||||||||||||||||||||||||||||||||||||
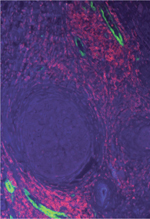
Lorsqu’un cancer devient cliniquement détectable, il est déjà le produit d’interactions longues avec son microenvironnement qui vont marquer toute l’histoire du patient et de sa maladie. Une forte réaction immunitaire Th1/CD8 cytotoxique mémoire contrôle la tumeur primitive, freine sa progression et son invasivité loco-régionale et l’essaimage métastatique. L’identification des caractéristiques de cette réaction bénéfique aux patients, particulièrement étudiée dans le cancer colorectal et qui est aussi la règle dans de nombreux cancers, a des impacts cliniques majeurs. Elle a permis d’établir un « immunoscore » qui représente le plus fort facteur pronostique prédisant la survie des patients [ 21] (→), et elle représente l’objectif à atteindre pour les traitements immunomodulateurs. (→) Voir la Synthèse de J. Galon et al., page 439 de ce numéro L’analyse de nombreuses tumeurs a aussi permis d’identifier des structures lymphoïdes proches des massifs tumoraux et qui pourraient être un lieu de génération des réponses immunes antitumorales [ 3]. En effet, ces structures lymphoïdes sont composées d’une zone T et d’une zone B. La zone T contient des cellules dendritiques matures au contact de lymphocytes T CD4+ et CD8+. C’est le seul endroit de la tumeur où résident des lymphocytes T naïfs qui arrivent par des high endothelial venules (veinules à endothélium épais) et seront potentiellement activés et éduqués par les cellules dendritiques matures au sein des tumeurs. Les lymphocytes B prolifèrent et produisent des anticorps. Il s’agit donc de véritables structures lymphoïdes tertiaires, induites par la tumeur (on ne les trouve pas à distance dans le tissu sain) par le biais de chimiokines et de cytokines produites par des cellules tumorales et du microenvironnement [ 4– 6]. Elles ressemblent aux structures lymphoïdes secondaires des ganglions réactionnels et aux structures lymphoïdes tertiaires trouvées aux sites inflammatoires des maladies auto-immunes [ 22], des sites infectés ou en cours d’un rejet de greffe [ 7]. La densité de ces structures lymphoïdes tertiaires tumorales est associée à un pronostic favorable dans la majorité des cancers, et est un marqueur d’une immunothérapie efficace. Nous avons formulé l’hypothèse selon laquelle elles représentaient le lieu de génération d’une réponse immunitaire antitumorale qui permettrait de contrôler localement une tumeur primitive, et qui engendrerait des lymphocytes T mémoire centrale pouvant contenir des cellules métastatiques qui essaiment de la tumeur primitive ( Figure 1 , architecture immunitaire d’une tumeur).
Au cours de la progression tumorale, le paysage immunitaire se modifie : les cellules CD8+ diminuent et les macrophages et les cellules myéloïdes suppressives augmentent [20] (→). (→) Voir la Synthèse de M. Bruchard et F. Ghiringhelli, page 429 de ce numéro Cette dynamique, qui résulte de facteurs tumoraux et du patient, est un facteur majeur de contrôle ou d’échappement des cancers dont l’impact sur l’espérance de vie des patients est primordial [ 8]. Cette dynamique peut être modifiée favorablement par les immunothérapies ciblant le microenvironnement tumoral. | ||||||||||||||||||||||||||||||||||||||||||||||||
Dans sa célèbre revue de 2001, R.D. Schreiber propose la théorie des 3E (élimination, équilibre, échappement) [ 9] comme version revisitée de la théorie de la surveillance immunitaire postulée un demi-siècle plus tôt indépendamment par L. Thomas [ 10] et F. Mc Farlane Burnett [ 11]. La théorie des 3E pose le principe de trois phases dans les relations entre les cellules tumorales et leur microenvironnement immunitaire. Lors de la première phase d’élimination, les produits des modifications oncogéniques d’une tumeur naissante sont reconnus comme néoantigènes et induisent une réaction immunitaire suffisamment efficace pour éradiquer la tumeur. C’est la théorie classique de la surveillance immunitaire. Les cellules transformées non détruites à ce stade prolifèrent et forment une tumeur primitive pendant l’évolution de laquelle s’établit un équilibre avec la réaction immunitaire locale. La tumeur peut alors être contrôlée et maintenue à son site d’origine pendant des années. Cependant, du fait de la plasticité de leur génome, les cellules tumorales peuvent échapper au contrôle immunitaire, croître et disséminer. Dans cette hypothèse, les sites métastatiques d’un cancer devraient présenter un microenvironnement radicalement différent de celui du site primitif sans véritable contrainte sur leur croissance. Des travaux très récents ont remis cette hypothèse en question. L’analyse comparée des microenvironnements des cancers colorectaux et rénaux primitifs et de leurs métastases pulmonaires respectives a révélé que les organisations vasculaires, inflammatoires et immunitaires des sites métastatiques étaient du même type que ceux de la tumeur d’origine. Ainsi, les métastases pulmonaires des cancers colorectaux sont peu vascularisées, relativement peu inflammatoires et riches en structures lymphoïdes tertiaires, comme la tumeur primitive. De plus, lorsque la densité de lymphocytes T, en particulier CD8+, est forte dans la tumeur primitive, il en est de même dans les sites métastatiques même s’ils sont détectés des années plus tard. Enfin, l’impact pronostique favorable d’un immunoscore élevé au site primitif s’applique aussi au niveau des métastases. À l’opposé, les métastases pulmonaires de cancer rénal sont fortement vascularisées, très inflammatoires et pauvres en structures lymphoïdes tertiaires, comme les tumeurs rénales primitives. Là encore, on retrouve une conservation entre le microenvironnement d’une tumeur chez un patient et celui des différents sites où elle essaime. Une donnée supplémentaire a révélé que même chez les patients présentant une forte infiltration de lymphocytes T CD8+ dans leur tumeur primitive et ses métastases, celle-ci est associée à un pronostic défavorable en raison du contexte vasculaire et inflammatoire de ces tumeurs. L’ensemble de ces données, confirmées par l’analyse d’autres sites métastatiques comme le foie pour les cancers colorectaux, permettent d’établir plusieurs points essentiels. (1) À la phase métastatique, la tumeur n’échappe pas au contrôle favorable ou défavorable de son microenvironnement. (2) Le dialogue établi par les cellules tumorales et leur microenvironnement immunitaire, inflammatoire, vasculaire pendant la longue période de génération et d’établissement d’un cancer, produit une empreinte qui est reproduite aux différents sites de développement de la maladie. Cette empreinte est la marque de l’histoire d’un cancer chez un patient. Les cellules immunitaires mémoires engendrées dans les structures lymphoïdes tertiaires jouent probablement un rôle majeur dans la répétition de ce dialogue aux différents sites. (3) Par les chimiokines, cytokines, facteurs de vascularisation qu’elles produisent, les cellules tumorales modulent leur microenvironnement plus fortement que ne le fait l’organe où elles se développent puisque cet environnement est similaire dans un côlon, un foie ou un poumon pour un cancer colorectal, ou encore un rein et un poumon pour un cancer rénal et ceci représente une règle générale. (4) Enfin, un ciblage thérapeutique efficace du microenvironnement tumoral est possible, et souhaitable, à tous les stades de développement d’un cancer Figure 2.
| ||||||||||||||||||||||||||||||||||||||||||||||||
La thérapie des cancers a longtemps eu comme unique objectif l’élimination directe des cellules tumorales. Chirurgie, radiothérapie, chimiothérapies classiques veulent extirper, bloquer la prolifération ou détruire les cellules malignes. Depuis quelques années, le microenvironnement tumoral est aussi pris en considération dans le traitement des cancers [ 23] (→). (→) Voir la Synthèse de L. Borriello et Y.A. DeClerk, page 445 de ce numéro Selon les cancers et la structure de leur microenvironnement, différents agents ont été développés et utilisés avec un succès grandissant pour moduler les interactions entre les cellules tumorales et leur hôte. Ainsi, les agents bloquant la vascularisation (anticorps anti-VEGF [vascular endothelial growth factor] ou inhibiteurs du récepteur du VEGF) diminuent la vascularisation tumorale. Mais, ils sont aussi des immunostimulants [ 12], efficaces dans le cancer du rein, en particulier. Les anticorps anti-CTLA4 (cytotoxic T-lymphocyte antigen 4) et anti PD1 (programmed cell death protein 1), qui « déverrouillent » les réactions immunitaires et permettent un influx de lymphocytes T cytotoxiques aux sites tumoraux, sont efficaces dans le mélanome [ 24], le cancer du rein, le cancer du poumon, même au stade métastatique. Des molécules qui diminuent l’activité des cellules suppressives, myéloïdes ou lymphocytaires sont testées. Les vaccinations contre des antigènes tumoraux entraînent aussi, lorsqu’elles sont efficaces comme dans certains cancers de la prostate, un afflux de lymphocytes T CD8+ aux sites tumoraux. Même des médicaments qui ciblent les cellules malignes comme les anticorps monoclonaux anti-CD20 (ciblant les lymphocytes B) ou anti-HER2 neu (human epidermal growth factor receptor 2), efficaces dans le traitement de lymphomes et de cancers du sein respectivement, induisent une réaction immunitaire antitumorale T mémoire associé au pronostic à long terme du patient (→) [ 25]. Un influx de lymphocytes T CD8+ intratumoraux a été rapporté après traitement avec des anticorps bispécifiques dont un bras cible la tumeur et l’autre les lymphocytes T. Les thérapies cellulaires utilisant des lymphocytes T antitumoraux poursuivent le même objectif. Enfin, même les chimiothérapies classiques ou ciblées peuvent induire une mort immunogénique des cellules tumorales, qui stimule la réaction immunitaire locale et entraîne un contrôle à long terme du cancer. Ces différentes approches sont résumées dans le Tableau II . (→) Voir la Synthèse de C. Deligne et J.L. Teillaud, m/s n° 1, janvier 2013, page 57
| ||||||||||||||||||||||||||||||||||||||||||||||||
Longtemps considéré comme une maladie génétique et cellulaire, le cancer est aujourd’hui envisagé comme une maladie de système dont l’issue dépend en grande partie des interactions de la tumeur avec l’hôte, en particulier au sein du microenvironnement tumoral. Celui-ci peut favoriser la croissance tumorale ou la contraindre. Il se modifie au cours de l’évolution de la maladie et la compréhension de cette dynamique permet d’identifier de nouveaux facteurs pronostiques et de nouvelles cibles thérapeutiques aux différents stades de la maladie cancéreuse. | ||||||||||||||||||||||||||||||||||||||||||||||||
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. | ||||||||||||||||||||||||||||||||||||||||||||||||
1.
Tartour
E
,
Gey
A
,
Sastre-Garau
X
, et al.
Analysis of interleukin 6 gene expression in cervical neoplasia using a quantitative polymerase chain reaction assay: evidence for enhanced interleukin 6 gene expression in invasive carcinoma . Cancer Res.
1994; ; 54 : :6243.–6248. 2.
Van Poelgeest
MI
,
Welters
MJ
,
van Esch
EM
, et al.
HPV16 synthetic long peptide (HPV16-SLP) vaccination therapy of patients with advanced or recurrent HPV16-induced gynecological carcinoma, a phase II trial . J Transl Med.
2013; ; 11 : :88.. 3.
Dieu-Nosjean
MC
,
Antoine
M
,
Danel
C
, et al.
Long-term survival for patients with non-small-cell lung cancer with intratumoral lymphoid structures . J Clin Oncol.
2008; ; 26 : :4410.–4417. 4.
De Chaisemartin
L
,
Goc
J
,
Damotte
D
, et al.
Characterization of chemokines and adhesion molecules associated with T cell presence in tertiary lymphoid structures in human lung cancer . Cancer Res.
2011; ; 71 : :6391.–6399. 5.
Goc
J
,
Germain
C
,
Vo-Bourgais
T
, et al.
Tertiary lymphoid structure dendritic cells signal a Th1 and cytotoxic immune contexture, and are required for good prognostic value of CD8+ T cells in lung cancer patients . Cancer Res.
2014; ; 74 : :705.–715. 6.
Fridman
WH
,
Pagès
F
,
Sautès-Fridman
C
,
Galon
J
. The immune contexture in human tumours: impact on clinical outcome . Nat Rev Cancer.
2012; ; 12 : :298.–306. 7.
Aloisi
F
,
Pujol-Borrell
R
. Lymphoid neogenesis in chronic inflammatory diseases . Nat Rev Immunol.
2006; ; 6 : :205.–217. 8.
Bindea
G
,
Mlecnik
B
,
Tosolini
M
, et al.
Spatiotemporal dynamics of intratumoral immune cells reveal the immune landscape in human cancer . Immunity.
2013; ; 39 : :782.–795. 9.
Dunn
GP
,
Old
LJ
,
Schreiber
RD
. The three Es of cancer immunoediting . Annu Rev Immunol.
2004; ; 22 : :329.–360. 10.
Thomas
L
. Discussion . In :
Lawrence
HS
, ed.
Cellular and humoral aspects of the hypersensitive states . New York: : Hoeber-Harper; , 1959 : :529.–532. 12.
Tartour
E
,
Pere
H
,
Maillere
B
, et al.
Angiogenesis and immunity: a bidirectional link potentially relevant for the monitoring of antiangiogenic therapy and the development of novel therapeutic combination with immunotherapy . Cancer Metastasis Rev.
2011; ; 30 : :83.–95. 13.
Hubert
S
,
Abastado
JP
. Les étapes précoces du processus métastatique . Med Sci (Paris).
2014; ; 30 : :378.–384. 14.
Buache
E
,
Rio
MC
. Le stroma tumoral, un terreau fertile pour la cellule cancéreuse . Med Sci (Paris).
2014; ; 30 : :385.–390. 15.
Albrengues
J
,
Meneguzzi
G
,
Gaggioli
C
. L’invasion des cellules tumorales : quand les fibroblastes s’en mêlent . Med Sci (Paris).
2014; ; 30 : :391.–397. 16.
Laurent
V
,
Nieto
L
,
Valet
P
,
Muller
C
. Tissu adipeux et cancer : une association à haut risque . Med Sci (Paris).
2014; ; 30 : :398.–404. 17.
Azzi
S
,
Gavard
J
. Vaisseaux sanguins et tumeurs ou l’art du dialogue . Med Sci (Paris).
2014; ; 30 : :408.–414. 18.
Garrido-Urbani
S
,
Jaquet
V
,
Imhof
BA
. ERO, NADPH oxydases et vascularisation des tumeurs . Med Sci (Paris).
2014; ; 30 : :415.–421. 19.
Heard
I
,
Floret
D
. Vaccins contre les papillomavirus humains (HPV). Dernières recommandations du Haut conseil de la santé publique, et premiers résultats cliniques et virologiques . Med Sci (Paris).
2013; ; 29 : :1161.–1166. 20.
Bruchard
M
,
Ghiringhelli
F
. Microenvironnement tumoral : cellules régulatrices et cytokines immunosuppressives . Med Sci (Paris).
2014; ; 30 : :429.–435. 21.
Galon
J
,
Bindea
G
,
Mlecnik
B
, et al.
Microenvironnement immunitaire et cancer : intérêt de l’Immunoscore pour prédire l’évolution clinique . Med Sci (Paris).
2014; ; 30 : :439.–444. 22.
Perros
F
,
Humbert
M
,
Cohen-Kaminsky
S
. Hypertension artérielle pulmonaire . Med Sci (Paris).
2013; ; 29 : :607.–616. 23.
Borriello
L
,
DeClerck
YA
. Le microenvironnement tumoral et la résistance thérapeutique . Med Sci (Paris).
2014; ; 30 : :445.–451. | ||||||||||||||||||||||||||||||||||||||||||||||||