| |
| Med Sci (Paris). 2014 April; 30(4): 378–384. Published online 2014 May 5. doi: 10.1051/medsci/20143004010.Les étapes précoces du processus métastatique Sandra Hubert1 and Jean-Pierre Abastado1,2* 1Singapore Immunology Network (SIgN), Agency for Science, Technology and Research, 8A biomedical grove, #04-06 Immunos, 138648Singapour 2Adresse actuelle : Institut de Recherches Internationales Servier, 53, rue Carnot, 92284Suresnes, France |
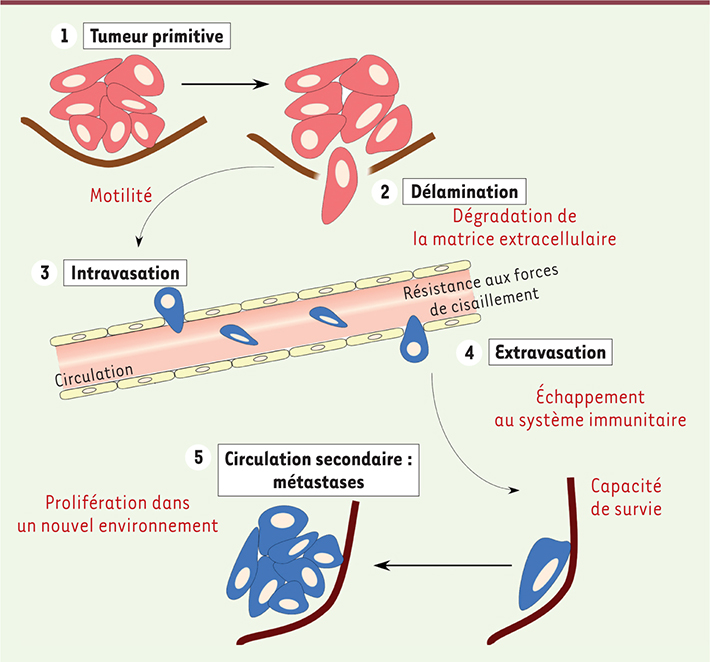
Alors que la plupart des cancers détectés à un stade précoce peuvent être guéris, un patient qui développe des métastases est souvent incurable. L’essentiel de la mortalité liée au cancer est due au développement de métastases. Cependant, notre compréhension du processus métastatique reste encore incomplète. Le développement de métastases à distance de la tumeur primitive nécessite la réalisation d’une longue série d’événements (Figure 1). Des cellules cancéreuses originaires de la tumeur primitive doivent en effet coloniser par voie sanguine ou lymphatique de nouveaux organes [
1]. Pour ce faire, elles doivent, tout d’abord, se détacher de la tumeur primitive (délamination), puis entrer dans la circulation (intravasation), et voyager à travers le corps en suivant les vaisseaux sanguins et lymphatiques. Il leur faut, ensuite, sortir de ces vaisseaux (extravasation) et coloniser un nouvel organe où elles se multiplient et, à terme, se développent en tumeurs secondaires (métastases). Chacune de ces étapes nécessite l’acquisition de caractéristiques particulières : capacité à dégrader la matrice extracellulaire, motilité, résistance aux forces de cisaillement rencontrées dans la circulation sanguine, échappement au système immunitaire, capacité de survivre et, surtout, acquisition de la capacité à proliférer dans un nouvel environnement [
43,
44] (→).
(→) Voir les Synthèses de W.H. Fridman et C. Sautès-Fridman, et de V. Provot, pages 359 et 366 de ce numéro
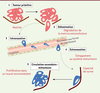 | Figure 1.
Les étapes du processus métastatique. Le processus métastatique associe une succession d’étapes que seuls un petit nombre de clones de la tumeur primitive peuvent franchir. Dans un premier temps, la cellule métastatique se détache de la tumeur primitive (délamination) et envahit la matrice extracellulaire. Elle passe ensuite dans la circulation sanguine ou lymphatique (intravasation). Enfin, la cellule métastatique quitte la circulation (extravasation) et acquiert la capacité à survivre et à proliférer dans son nouvel environnement. |
L’acquisition d’un nombre si important de caractères est mal comprise. Dans cette revue, nous discuterons une série de résultats obtenus récemment qui décrivent la cinétique d’acquisition du phénotype métastatique, les mécanismes permettant cette acquisition et les conditions permettant leur sélection. |
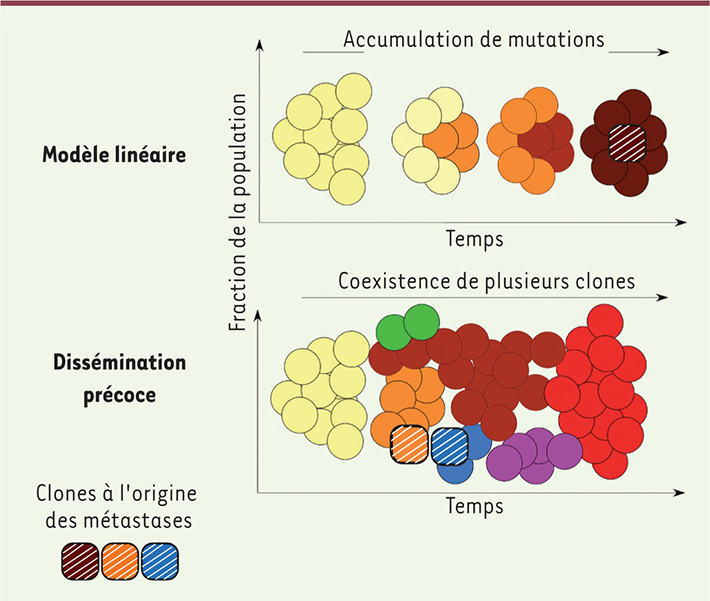
Le modèle de la sélection clonale Le paradigme traditionnel, appelé modèle linéaire de la sélection clonale (Figure 2A), considère que toutes les caractéristiques nécessaires à l’acquisition du phénotype métastatique dépendent de l’accumulation de mutations indépendantes dans la cellule cancéreuse [
2]. On sait que la probabilité d’apparition d’une mutation dans une population (de cellules) donnée dépend du taux de mutation à chaque génération, de la taille de la population et de la durée. Les cellules cancéreuses sont, de fait, caractérisées par une instabilité génétique, compatible avec un taux de mutation élevé. La taille de la tumeur primitive contribue également à l’émergence de métastases. Une tumeur d’un cm de diamètre compte environ 109 cellules. Il y a une corrélation directe entre les dimensions de la tumeur primitive et le risque de maladie métastatique [
3]. Enfin, l’apparition de métastases macroscopiques est souvent un long processus, nécessitant parfois des années, voire des décennies après la colonisation de l’organe cible. Le modèle de la sélection clonale est donc en adéquation avec ce que l’on sait de la biologie des tumeurs : compte tenu du nombre élevé de caractères que doit acquérir la cellule cancéreuse pour être capable de métastaser, les métastases ne peuvent apparaître que tardivement, lors de la phase terminale et, en général, mortelle de la maladie. Ce modèle explique également que l’exérèse précoce de la tumeur primitive suffise souvent à guérir le patient. En éliminant la tumeur primitive avant que les cellules cancéreuses n’aient eu le temps de se disséminer, le chirurgien prévient à la fois les récurrences et le développement ultérieur de métastases.
 | Figure 2.
Représentation schématique du modèle linéaire de sélection clonale et du modèle de dissémination précoce. A. Modèle linéaire de sélection clonale : toutes les métastases dérivent d’un même clone qui apparaît tardivement au sein de la tumeur primitive (carré marron hachuré). Toutes les mutations présentes dans la tumeur primitive (changement de couleur) sont retrouvées dans les métastases. B. Modèle de dissémination précoce : certaines cellules de la tumeur primitive acquièrent précocement un phénotype motile. Les métastases dérivent de ces clones (carrés orange et bleu hachurés) présents dès le début du développement de la tumeur primitive. La tumeur primitive continue d’accumuler des mutations (changement de couleur), mais ces nouvelles mutations sont absentes des métastases. |
|
Dans certains cancers, la dissémination des cellules cancéreuses est un événement précoce Un certain nombre d’observations récentes montrent que le modèle traditionnel ne saurait s’appliquer à tous les types de cancer. Par exemple, dans la majorité des cancers du sein, la dissémination des cellules tumorales semble avoir lieu beaucoup plus tôt que ne le prévoit le modèle linéaire (Figure 2B). Il est maintenant établi que des cellules cancéreuses circulent dans le sang ou sont présentes dans la moelle osseuse d’environ un tiers des patientes atteintes d’un cancer du sein à un stade précoce [
4,
5–
7]. Dans de nombreux cas, des cellules cancéreuses métastatiques seraient même présentes avant que la tumeur primitive ne soit détectée cliniquement. Dans le mélanome cutané, l’analyse du profil des rechutes métastatiques après exérèse de la lésion primitive est également en faveur d’un modèle de dissémination précoce [
8]. Dans le mélanome uvéal, la cinétique de croissance des métastases hépatiques semble indiquer que les cellules à l’origine de ces métastases ont colonisé le foie en moyenne quatre ans avant la détection de la tumeur primitive [
9]. Dans les sarcomes d’Ewing, avant le développement de thérapies adjuvantes, la majorité des patients développaient une maladie métastatique létale, et ce même lorsque la chirurgie était effectuée précocement, suggérant donc l’existence de micrométastases au moment du diagnostic [
10]. Plus récemment, la présence de cellules tumorales disséminées a pu être démontrée chez ces patients. En fait, une étude récente montre que l’événement oncogénique initial (la translocation EWS-FLI-1) induit une perte d’adhérence des cellules qui favoriserait leur dissémination précoce [10]. Dans le cancer du col de l’utérus, certaines patientes rechutent plusieurs années après que leur lésion primitive a été réséquée à un stade apparemment pré-invasif. Cela indique que, chez ces patientes, des cellules précancéreuses ont colonisé les sites distants avant la résection [
11]. Dans ce cas, l’analyse du site d’intégration du virus HPV (human papillomavirus) nécessaire à la transformation maligne permet de confirmer l’origine monoclonale des récidives. La dissémination précoce de cellules à l’origine des métastases a également été observée dans les cancers de l’œsophage [
12]. La dissémination précoce des cellules tumorales a pu être analysée plus en détail dans plusieurs modèles murins de cancers spontanés (cancer du sein [
6], mélanome uvéal [
13], pancréas [
14]), où l’on peut suivre le développement de la maladie avant même l’apparition des premiers symptômes cliniques. Dans ces modèles, on détecte des cellules cancéreuses disséminées dans pratiquement tous les tissus dès que la lésion primitive se développe, parfois même à un stade précancéreux (dysplasique). Bien qu’à ce stade de nos connaissances, il faille se garder d’extrapoler à tous les types de cancer, un nombre croissant d’observations montrent que la dissémination des cellules tumorales débute parfois plusieurs années avant le diagnostic clinique de la tumeur primitive. Malgré l’exérèse de celle-ci, des cellules cancéreuses demeurent alors disséminées dans l’organisme. La question de l’origine des métastases qui déterminent la survie des patients – dérivent-elles de cellules se disséminant précocement ou tardivement ? – reste ouverte. |
Progression parallèle de la tumeur primitive et des métastases L’analyse comparée des génomes des tumeurs primitives, des lésions métastatiques et des cellules cancéreuses circulantes conforte cette idée d’une dissémination précoce suivie d’une accumulation de nouvelles mutations en parallèle [7]. Dans le modèle linéaire de la sélection clonale, les métastases dérivent d’un clone qui apparaît tardivement au sein de la tumeur primitive (Figure 2A). Les cellules métastatiques devraient donc théoriquement porter l’immense majorité des mutations identifiées dans la tumeur primitive. Cependant, l’analyse de la séquence des génomes montre que, dans de nombreux cas de cancer du sein ou du pancréas, des mutations présentes dans la tumeur primitive sont absentes des métastases. Le sous-clone à l’origine des métastases est donc vraisemblablement minoritaire au sein de la tumeur primitive, soit parce que les cellules qui le composent quittent la tumeur dès qu’elles deviennent motiles, soit parce que les altérations génétiques conférant le potentiel métastatique ne procurent aucun avantage sélectif dans l’environnement de la tumeur primitive. Leur dissémination pourrait être induite à l’occasion d’un événement secondaire ou par une modification du microenvironnement. Mais, par ailleurs, il est possible d’identifier des signatures géniques dérivées de la tumeur primitive et prédictives du risque de développement de métastases [
15]. Cela signifie que la propension d’une tumeur à essaimer des métastases est une caractéristique intrinsèque de cette tumeur dans son ensemble, et non celle d’un clone minoritaire ayant acquis fortuitement et à un stade tardif le phénotype métastatique [
16]. À nouveau, ces observations, paradoxales dans le cadre du modèle linéaire, sont plus faciles à expliquer si l’on accepte que la capacité à essaimer est acquise rapidement et que la dissémination des cellules tumorales à l’origine des métastases constitue un événement précoce (Figure 2B). |
La transition épithélio-mésenchymateuse Mais alors, comment les cellules tumorales acquièrent-elles si tôt cette capacité à disséminer ? Une explication possible est que le phénotype motile ne serait pas acquis de novo, mais résulterait de la réactivation d’un programme génétique utilisé lors de l’embryogenèse, la transition épithélio-mésenchymateuse (TEM). Au cours de la gastrulation, des cellules d’origine ectodermique migrent vers la ligne primitive, puis perdent leur caractère épithélial conduisant à l’acquisition de cellules mésenchymateuses qui donnent naissance au mésoderme et à l’endoderme [
17]. Ce processus est sous le contrôle d’un petit nombre de facteurs de transcription (notamment Twist1, Twist2 [
45] (→), ZEB1 [zinc finger E-box-binding homeobox 1], ZEB2, Snail1, Snail2/Slug) qui répriment l’expression de molécules nécessaires à l’adhérence intercellulaire (telle que la E-cadhérine), provoquent la sécrétion de protéases capables de dégrader la matrice extracellulaire (métalloprotéases matricielles) et induisent un phénotype motile. Il suffirait donc, théoriquement, à une cellule cancéreuse d’activer ce(s) facteur(s) de transcription pour acquérir un phénotype mésenchymateux compatible avec un processus de dissémination. Dans un modèle de carcinome mammaire, l’équipe de Klein a montré que la réactivation de Twist1 suffisait à promouvoir la dissémination précoce des cellules tumorales [6]. Chez les patients atteints de cancer du sein, du côlon, de l’œsophage ou de tumeurs de la tête et du cou, l’expression de gènes impliqués dans la TEM est associée au développement précoce d’une maladie métastatique [
18–
20]. Il n’est pas établi, et il est en fait peu probable, que la dissémination des cellules cancéreuses soit uniquement dépendante de l’activation du processus de TEM [
21]. De plus, certaines chimiothérapies ou traitements anti-angiogéniques, qui induisent des régressions tumorales mais favorisent ensuite l’émergence de variants métastatiques, sont capables d’induire la TEM [
22,
23,
46] (→→).
(→) Voir la Nouvelle de A. Puisieux et S. Ansieau, m/s n° 1, janvier 2009, page 28
(→→) Voir la Synthèse de M. Hasmim et al., page 422 de ce numéro
Cela suggère que, de façon générale, le phénotype métastatique, et plus particulièrement la capacité migratoire, pourraient être acquis en réponse à la réactivation d’un petit nombre de gènes, plutôt que par l’accumulation d’un nombre important de mutations. |
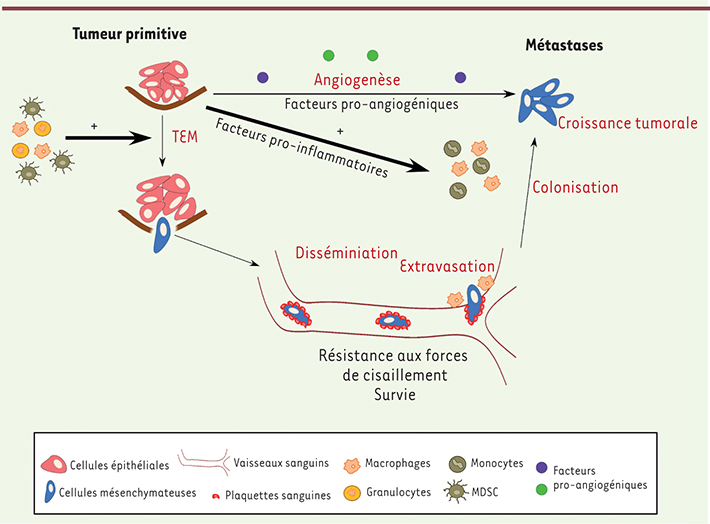
Le rôle du microenvironnement Il est également de plus en plus clair que les propriétés métastatiques et plus particulièrement la capacité migratoire, ne sont pas seulement des caractéristiques intrinsèques de la cellule tumorale, mais qu’elles peuvent être aussi induites par le microenvironnement [
24]. Certaines cellules du système immunitaire ont été impliquées dans cette induction (Figure 3). Par exemple, certains types de cellules myéloïdes (les macrophages, les granulocytes, les cellules myéloïdes suppressives d’origine granulocytique ou G-MDSC) sécrètent des facteurs tels que le TGF-β (tumor growth factor β), l’HGF (hepatocyte growth factor) ou l’EGF (epidermal growth factor) capables d’induire la TEM des cellules cancéreuses in vitro [
25, 44,
47] (→).
(→) Voir la Synthèse de M. Bruchard et F. Ghiringhelli, page 429 de ce numéro
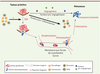 | Figure 3.
Rôle du microenvironnement dans le processus métastatique. Au sein de la tumeur primitive, certaines cellules cancéreuses acquièrent un phénotype métastatique. Le microenvironnement et, en particulier, les cellules du système immunitaire, pourraient jouer un rôle essentiel dans ce processus. Les monocytes, macrophages et MDSC (myeloid-derived suppressor cell) intra- ou péritumoraux permettraient l’acquisition de caractéristiques mésenchymateuses (TEM, transition épithéliomésenchymateuse), rendant la cellule tumorale motile et invasive. Dans la circulation sanguine, les plaquettes favoriseraient la survie des cellules cancéreuses circulantes. Les macrophages périvasculaires participeraient à l’extravasation des cellules cancéreuses. La tumeur primitive sécrète des facteurs pro-inflammatoires susceptibles d’activer les monocytes et les macrophages facilitant la colonisation de l’organe métastatique ; elle sécrèterait également des facteurs pro-angiogéniques favorisant la croissance des micrométastases. |
Dans la circulation sanguine, les plaquettes, en recouvrant les cellules tumorales circulantes, augmentent la résistance aux forces de cisaillement de ces dernières et facilitent leur survie. Les macrophages périvasculaires permettent l’extra- puis l’intravasation des cellules tumorales [
48] (→).
(→) Voir la Synthèse de S. Azzi et J. Gavard, page 408 de ce numéro
Enfin, certains monocytes et macrophages favorisent la survie des cellules tumorales dans l’organe métastatique en créant une niche protectrice dans un environnement par ailleurs hostile [
26]. La tumeur primaire sécrète des facteurs pro-inflammatoires (protéine S100-A8/9, TNFα [tumor necrosis factor α]) qui participent au développement de ces niches métastatiques dans l’organe cible. Ces données expérimentales, obtenues in vitro ou dans des modèles murins, sont renforcées par l’observation, chez l’homme, d’une corrélation entre la présence de macrophages ou de G-MDSC dans la tumeur primitive et le développement de métastases chez l’homme [
27]. L’inflammation de l’organe cible, par exemple du poumon, de la gencive ou des os, peut entraîner l’apparition accélérée de métastases [
28]. |
L’immunosurveillance des cellules cancéreuses disséminées Mais alors, s’il existe des cellules cancéreuses déjà disséminées dans différents tissus dans l’organisme, comment expliquer l’effet thérapeutique et souvent curatif de la chirurgie, lorsqu’elle est pratiquée suffisamment tôt ? Par exemple, la majorité des patientes atteintes de cancer du sein et traitées à un stade précoce sont guéries : la présence de cellules tumorales dans les ganglions axillaires ou dans la moelle osseuse détectée chez un tiers de ces patientes n’a qu’un effet marginal sur le risque de rechute [5]. Cela indique que, dans la plupart des cas, l’organisme est capable de contrôler la prolifération des cellules cancéreuses disséminées. La tumeur primitive peut sécréter des facteurs qui favorisent la croissance des cellules disséminées, la formation de niches dans les organes cibles, ou l’apparition de vaisseaux sanguins (angiogenèse) nécessaires à l’émergence de métastases macroscopiques (Figure 3) [44, 47]. L’exérèse de la tumeur primitive pourrait alors priver les cellules cancéreuses disséminées de ces ressources [
29,
30]. Le système immunitaire participe également au contrôle des cellules cancéreuses disséminées. Lors de la greffe d’un organe sain provenant d’un donneur ayant eu préalablement un mélanome cutané, il peut arriver que des cellules cancéreuses dormantes présentes dans l’organe transplanté prolifèrent chez le receveur [
31]. En effet, afin de prévenir un rejet de greffe, le receveur est mis sous traitement immunosuppresseur. Les cellules cancéreuses contenues dans l’organe transplanté échappent alors à tout contrôle et prolifèrent. De nos jours, l’histoire clinique de tout donneur potentiel d’organe est préalablement examinée en détail afin d’écarter tout donneur ayant eu un cancer, même ancien. Il a aussi été montré que la tumeur primitive sécrète des facteurs immunosuppresseurs et induit activement la tolérance immunitaire vis-à-vis des antigènes exprimés par la tumeur [
32]. Ainsi donc, ces observations indiquent que l’effet curatif de la chirurgie pourrait être lié à la fois à l’élimination de la source de nouvelles cellules cancéreuses capables de se développer en métastases et au renforcement des défenses immunitaires susceptibles de contrôler la progression métastatique [
33,
34]. |
Lorsqu’on injecte des cellules tumorales par voie intraveineuse à une souris, on court-circuite les étapes d’invasion et de dissémination et l’on peut ainsi étudier directement l’extravasation et la colonisation d’organes ectopiques. Dans la plupart des systèmes expérimentaux, les cellules tumorales circulantes sont arrêtées au niveau des capillaires pulmonaires puis, en quelques heures, la majorité de ces cellules subissent un processus d’extravasation. Mais seule une minorité restent vivantes après 48 h. À terme, environ une cellule sur 104 se développe en une métastase macroscopique [
35]. Pour se développer en métastase, la cellule cancéreuse doit posséder certaines propriétés intrinsèques supplémentaires. Certaines de ces propriétés sont partagées avec les cellules souches. Les cellules capables de se développer en métastases et de reconstituer toute l’hétérogénéité de la tumeur initiale après injection intraveineuse dans une souris sont donc communément qualifiées de cellules souches cancéreuses, même si cette dénomination ne fait pas l’unanimité. Il a également été montré dans un modèle murin de carcinome spinocellulaire que, pour coloniser durablement le parenchyme pulmonaire, les cellules cancéreuses ectopiques devaient réacquérir un phénotype épithélial (transition mésenchymo-épithéliale) [
36]. La faible persistance de cellules cancéreuses disséminées reflète également la nécessité, pour elles, de trouver une niche, c’est-à-dire un microenvironnement compatible avec leur survie au sein de l’organe cible. De nombreux travaux visent à caractériser au niveau moléculaire cette niche métastatique [
37,
38, 44] (→).
(→) Voir la Synthèse de V. Provot, page 366 de ce numéro
Une fois dans leur niche, les cellules cancéreuses peuvent demeurer quiescentes pendant des mois, voire des années, un peu à la façon de cellules souches. Cette phase est appelée dormance métastatique. En théorie, la dormance peut résulter soit de la quiescence des cellules cancéreuses (sortie du cycle cellulaire), soit d’un équilibre dynamique entre prolifération et apoptose. Puis, en réponse à des signaux encore mal identifiés, certaines de ces cellules reprennent leur prolifération et se développent en micro- puis macrométastases. Comme nous l’avons déjà mentionné, le système immunitaire joue un rôle dans le maintien de la dormance [
39, 48,
49] (→).
(→) Voir les Synthèses de M. Hasmim et al., et de J. Galon et al., pages 422 et 439 de ce numéro
Par exemple, dans certains modèles de souris, lorsqu’on élimine les cellules T CD8+, l’apparition de métastases est accélérée [13]. Les cellules qui sont sorties du cycle cellulaire sont relativement résistantes aux traitements conventionnels par chimio- ou radiothérapies, qui éliminent principalement les cellules en prolifération. La longue durée de la dormance métastatique explique que cet état existe chez une fraction importante des patients, avant ou après exérèse de leur tumeur primitive. Il est donc essentiel de mieux comprendre la régulation de la dormance si l’on veut améliorer la survie des patients. |
Sélection de clones métastatiques Dans le modèle traditionnel, dans lequel la croissance des métastases suit immédiatement la dissémination des cellules de la tumeur primitive, l’acquisition du phénotype métastatique procure un avantage sélectif immédiat à la cellule cancéreuse. Mais, dans l’hypothèse d’une dormance prolongée, quels sont les mécanismes mis en jeu favorisant l’émergence de cellules métastatiques ? On peut montrer par modélisation mathématique que, dans des conditions d’accès limité aux nutriments, les cellules mésenchymateuses prolifèrent plus vite que les cellules purement épithéliales [
40]. Ainsi donc, les cellules potentiellement métastatiques seraient sélectionnées, car le caractère mésenchymateux procure un avantage prolifératif au sein de la tumeur primitive. Cette hypothèse permet également d’expliquer pourquoi les stratégies thérapeutiques qui visent à carencer les tumeurs, par exemple en empêchant la croissance des vaisseaux sanguins (thérapies anti-angiogéniques), peuvent induire des régressions tumorales, sans pour autant augmenter la survie des patients. On a pu vérifier que ces stratégies sélectionnent des variants plus agressifs et augmentent le risque métastatique [22, 23]. S. Ansieau et al. ont également montré que l’inactivation de Twist1 ou Twist2 dans des lignées tumorales induisait la sénescence cellulaire. À l’inverse, l’expression ectopique de ces deux facteurs de transcription dans des fibroblastes embryonnaires murins inhibe l’apoptose et la sénescence cellulaire induites par un stress oncogénique [
41]. Dans ce modèle, l’induction de la TEM serait nécessairement associée à la conversion maligne, ce qui expliquerait la sélection précoce de cellules potentiellement métastatiques au sein de la tumeur primitive. |
Perspectives thérapeutiques Au cours des trente dernières années, fort peu de progrès ont été accomplis dans la prévention et le traitement des cancers métastatiques. Il est essentiel d’intégrer cette nouvelle conception du processus métastatique dans le développement clinique. Jusqu’à présent, cela n’a guère été possible [
42], mais les progrès techniques obtenus récemment dans l’analyse du génome des cellules disséminées devraient faciliter le développement des stratégies thérapeutiques visant à les éradiquer [12]. Les thérapies adjuvantes ont une efficacité limitée et ont souvent l’inconvénient de traiter inutilement de nombreux patients. L’utilisation de biomarqueurs pour la stratification et la décision thérapeutique reste encore une exception plutôt qu’une règle. Les protocoles d’immunothérapie, visant à stimuler les défenses immunitaires antitumorales, seraient susceptibles d’améliorer le contrôle des cellules cancéreuses disséminées et de prolonger la dormance des micrométastases. Mais ces essais sont trop souvent conduits chez des patients métastatiques à un stade avancé de leur maladie, chez lesquels, par conséquent, les chances d’obtenir un bénéfice thérapeutique sont très faibles. De fait, la mise au point de nouvelles approches thérapeutiques destinées aux patients ayant une maladie résiduelle minimale et visant à prévenir l’apparition de métastases représente un défi méthodologique qui nécessitera le développement de schémas cliniques originaux. |
Au cours des dix dernières années, le développement de modèles animaux permettant de suivre « en direct » l’apparition de métastases spontanées a considérablement amélioré notre compréhension du processus métastatique. Il est clair aujourd’hui que la dissémination des cellules cancéreuses est un événement précoce dans plusieurs modèles, ainsi que dans de nombreux cancers chez l’homme, et que les cellules disséminées peuvent rester dormantes pendant des périodes de temps prolongées. Plus récemment, la caractérisation moléculaire de la niche où résident ces cellules (la niche métastatique) et l’identification des signaux microenvironnementaux responsables de la quiescence cellulaire ont été entreprises dans des modèles animaux et chez l’homme [44]. Ces études revêtent aujourd’hui une importance stratégique, car il est devenu évident que les cellules disséminées sont susceptibles d’être ciblées par des interventions thérapeutiques pouvant prolonger la survie des patients, voire même transformer certains cancers en maladies chroniques. |
J.P. Abastado déclare avoir des liens permanents avec l’Institut de Recherches Internationales Servier.
S. Hubert déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs tiennent à remercier Françoise Thierry et Jean-Paul Thiery pour leur relecture du manuscrit.
|
1.
Bidard
FC
,
Poupon
MF
. Biologie du processus métastatique . Med Sci (Paris).
2012; ; 28 : :89.–95. 2.
Fidler
IJ
,
Kripke
ML
. Metastasis results from preexisting variant cells within a malignant tumor . Science.
1977; ; 197 : :893.–895. 3.
Engel
J
,
Eckel
R
,
Kerr
J
, et al.
The process of metastasisation for breast cancer . Eur J Cancer.
2003; ; 39 : :1794.–1806. 4.
Schmidt-Kittler
O
,
Ragg
T
,
Daskalakis
A
, et al.
From latent disseminated cells to overt metastasis: genetic analysis of systemic breast cancer progression . Proc Natl Acad Sci USA.
2003; ; 100 : :7737.–7742. 5.
Sola
M
,
Margeli
M
,
Castella
E
, et al.
Prognostic value of hematogenous dissemination and biological profile of the tumor in early breast cancer patients: a prospective observational study . BMC Cancer.
2011; ; 11 : :252.. 6.
Husemann
Y
,
Geigl
JB
,
Schubert
F
, et al.
Systemic spread is an early step in breast cancer . Cancer Cell.
2008; ; 13 : :58.–68. 7.
Klein
CA
. Parallel progression of primary tumours and metastases . Nat Rev Cancer.
2009; ; 9 : :302.–312. 8.
Damsky
WE
,
Theodosakis
N
,
Bosenberg
M
. Melanoma metastasis: new concepts and evolving paradigms . Oncogene.
2013 ; 3 juin (online). doi : 10.1038/onc.2013.194.
9.
Kivela
T
,
Eskelin
S
,
Kujala
E
. Metastatic uveal melanoma . Int Ophthalmol Clin.
2006; ; 46 : :133.–149. 10.
Chaturvedi
A
,
Hoffman
LM
,
Welm
AL
, et al.
The EWS/FLI Oncogene drives changes in cellular morphology, adhesion, and migration in Ewing sarcoma . Genes Cancer.
2012; ; 3 : :102.–116. 11.
Vinokurova
S
,
Wentzensen
N
,
Einenkel
J
, et al.
Clonal history of papillomavirus-induced dysplasia in the female lower genital tract . J Natl Cancer Inst.
2005; ; 97 : :1816.–1821. 12.
Stoecklein
NH
,
Hosch
SB
,
Bezler
M
, et al.
Direct genetic analysis of single disseminated cancer cells for prediction of outcome and therapy selection in esophageal cancer . Cancer Cell.
2008; ; 13 : :441.–453. 13.
Eyles
J
,
Puaux
AL
,
Wang
X
, et al.
Tumor cells disseminate early, but immunosurveillance limits metastatic outgrowth, in a mouse model of melanoma . J Clin Invest.
2010; ; 120 : :2030.–2039. 14.
Rhim
AD
,
Mirek
ET
,
Aiello
NM
, et al.
EMT and dissemination precede pancreatic tumor formation . Cell.
2012; ; 148 : :349.–361. 15.
Minn
AJ
,
Gupta
GP
,
Siegel
PM
, et al.
Genes that mediate breast cancer metastasis to lung . Nature.
2005; ; 436 : :518.–524. 16.
Bernards
R
,
Weinberg
RA
. A progression puzzle . Nature.
2002; ; 418 : :823.. 17.
Thiery
JP
,
Chua
K
,
Sim
WJ
,
Huang
R
. La transition épithéliomésenchymateuse au cours du développement dans la fibrose et dans la progression tumorale . Bull Cancer.
2010; ; 97 : :1285.–1295. 18.
De Craene
B
,
Berx
G
. Regulatory networks defining EMT during cancer initiation and progression . Nat Rev Cancer.
2013; ; 13 : :97.–110. 19.
Sasaki
K
,
Natsugoe
S
,
Ishigami
S
, et al.
Significance of Twist expression and its association with E-cadherin in esophageal squamous cell carcinoma . J Exp Clin Cancer Res.
2009; ; 28 : :158.. 20.
Wushou
A
,
Pan
HY
,
Liu
W
, et al.
Correlation of increased twist with lymph node metastasis in patients with oral squamous cell carcinoma . J Oral Maxillofac Surg.
2012; ; 70 : :1473.–1479. 21.
Bidard
FC
,
Pierga
JY
,
Vincent-Salomon
A
,
Poupon
MF
. A class action against the microenvironment: do cancer cells cooperate in metastasis? . Cancer Metastasis Rev.
2008; ; 27 : :5.–10. 22.
Paez-Ribes
M
,
Allen
E
,
Hudock
J
, et al.
Antiangiogenic therapy elicits malignant progression of tumors to increased local invasion and distant metastasis . Cancer Cell.
2009; ; 15 : :220.–231. 23.
Chouaib
S
,
Messai
Y
,
Couve
S
, et al.
Hypoxia promotes tumor growth in linking angiogenesis to immune escape . Front Immunol.
2012; ; 3 : :21.. 24.
Joyce
JA
,
Pollard
JW
. Microenvironmental regulation of metastasis . Nat Rev Cancer.
2009; ; 9 : :239.–252. 25.
Toh
B
,
Wang
X
,
Keeble
J
, et al.
Mesenchymal transition and dissemination of cancer cells is driven by myeloid-derived suppressor cells infiltrating the primary tumor . PLoS Biol.
2011; ; 9 : :e1001162.. 26.
Tomita
T
,
Sakurai
Y
,
Ishibashi
S
,
Maru
Y
. Imbalance of Clara cell-mediated homeostatic inflammation is involved in lung metastasis . Oncogene.
2011; ; 30 : :3429.–3439. 27.
Zhang
QW
,
Liu
L
,
Gong
CY
, et al.
Prognostic significance of tumor-associated macrophages in solid tumor: a meta-analysis of the literature . PLoS One.
2012; ; 7 : :e50946.. 28.
Hirshberg
A
,
Leibovich
P
,
Horowitz
I
,
Buchner
A
. Metastatic tumors to postextraction sites . J Oral Maxillofac Surg.
1993; ; 51 : :1334.–1337. 29.
Hiratsuka
S
,
Ishibashi
S
,
Tomita
T
, et al.
Primary tumours modulate innate immune signalling to create pre-metastatic vascular hyperpermeability foci . Nat Commun.
2013; ; 4 : :1853.. 30.
Demicheli
R
,
Retsky
MW
,
Hrushesky
WJ
, et al.
The effects of surgery on tumor growth: a century of investigations . Ann Oncol.
2008; ; 19 : :1821.–1828. 31.
Strauss
DC
,
Thomas
JM
. Transmission of donor melanoma by organ transplantation . Lancet Oncol.
2010; ; 11 : :790.–796. 32.
Kiessling
R
,
Wasserman
K
,
Horiguchi
S
, et al.
Tumor-induced immune dysfunction . Cancer Immunol Immunother.
1999; ; 48 : :353.–362. 33.
Tatsumi
T
,
Kierstead
LS
,
Ranieri
E
, et al.
Disease-associated bias in T helper type 1 (Th1)/Th2 CD4+ T cell responses against MAGE-6 in HLA-DRB10401+ patients with renal cell carcinoma or melanoma . J Exp Med.
2002; ; 196 : :619.–628. 34.
Kusmartsev
S
,
Su
Z
,
Heiser
A
, et al.
Reversal of myeloid cell-mediated immunosuppression in patients with metastatic renal cell carcinoma . Clin Cancer Res.
2008; ; 14 : :8270.–8278. 35.
Luzzi
KJ
,
MacDonald
IC
,
Schmidt
EE
, et al.
Multistep nature of metastatic inefficiency: dormancy of solitary cells after successful extravasation and limited survival of early micrometastases . Am J Pathol.
1998; ; 153 : :865.–873. 36.
Tsai
JH
,
Donaher
JL
,
Murphy
DA
, et al.
Spatiotemporal regulation of epithelial-mesenchymal transition is essential for squamous cell carcinoma metastasis . Cancer Cell.
2012; ; 22 : :725.–736. 37.
Malanchi
I
,
Santamaria-Martinez
A
,
Susanto
E
, et al.
Interactions between cancer stem cells and their niche govern metastatic colonization . Nature.
2012; ; 481 : :85.–89. 38.
Oskarsson
T
,
Massague
J
. Extracellular matrix players in metastatic niches . EMBO J.
2012; ; 31 : :254.–256. 39.
Quesnel
B
. « Je te tiens, tu me tiens »… Dormance tumorale : un équilibre instable ?
Med Sci (Paris).
2008; ; 24 : :575.–576. 40.
Narang
V
,
Wong
SY
,
Leong
SR
, et al.
Selection of mesenchymal-like metastatic cells in primary tumors: an in silico investigation . Front Immunol.
2012; ; 3 : :88.. 41.
Ansieau
S
,
Caron de Fromentel
C
,
Bastid
J
, et al.
Rôle de la transition épithéliomésenchymateuse dans la progression tumorale . Bull Cancer.
2010; ; 97 : :7.–15. 42.
Bidard
FC
,
Pierga
JY
,
Soria
JC
,
Thiery
JP
. Translating metastasis-related biomarkers to the clinic-progress and pitfalls . Nat Rev Clin Oncol.
2013; ; 10 : :169.–179. 43.
Fridman
WH
,
Sautès-Fridman
C
. Le microenvironnement tumoral : matrice nourricière, champ de bataille et cible thérapeutique des cancers . Med Sci (Paris).
2014; ; 30 : :359.–365. 44.
Provot
S
. Contrôle de la croissance et de la dissémination tumorales par le microenvironnement : certitudes et hypothèses émergentes . Med Sci (Paris).
2014; ; 30 : :366.–371. 45.
Puisieux
A
,
Ansieau
S
. La dissémination précoce de cellules métastatiques . Med Sci (Paris).
2009; ; 25 : :28.–30. 46.
Hasmim
M
,
Messai
Y
,
Zaeem Noman
M
,
Chouaib
S
. L’hypoxie tumorale : un déterminant clé de la réactivité stromale et de la réponse antitumorale . Med Sci (Paris).
2014; ; 30 : :422.–428. 47.
Bruchard
M
,
Ghiringhelli
F
. Microenvironnement tumoral : cellules régulatrices et cytokines immunosuppressives . Med Sci (Paris).
2014; ; 30 : :429.–435. 48.
Azzi
A
,
Gavard
J
. Vaisseaux sanguins et tumeurs ou l’art du dialogue . Med Sci (Paris).
2014; ; 30 : :408.–414. 49.
Galon
J
,
Bindea
G
,
Mlecnik
B
, et al.
Micro-environnement immunitaire et cancer : intérêt de l’immunoscore pour prédire l’évolution clinique . Med Sci (Paris).
2014; ; 30 : :439.–444. |