| |
| Med Sci (Paris). 2014 April; 30(4): 391–397. Published online 2014 May 5. doi: 10.1051/medsci/20143004012.L’invasion des cellules tumorales Quand les fibroblastes s’en mêlent Jean Albrengues,1 Guerrino Meneguzzi,1 and Cédric Gaggioli1* 1Inserm U1081, CNRS UMR7284, Université Nice Sophia Antipolis, IRCAN, Institut de recherche sur le cancer et le vieillissement, Faculté de médecine, 28, avenue de Valombrose, 06107Nice, France |
Les métastases sont la cause principale du taux élevé de mortalité liée aux cancers. Ainsi, la compréhension des étapes initiales des mécanismes permettant aux cellules tumorales d’envahir le stroma revêt un intérêt indéniable dans la mise en place de stratégies thérapeutiques efficaces ciblant non seulement la tumeur elle-même mais également son micro-environnement [
27,
28] (→). Les cellules tumorales peuvent s’échapper de la tumeur primaire par différents modes de migration et envahir les tissus adjacents. Concernant les tumeurs solides humaines, l’invasion solitaire, qui définit l’invasion par une cellule isolée, ou l’invasion collective, qui se réfère à l’invasion par un amas de cellules cohésives, constituent les deux modes d’invasion les plus couramment observés par les pathologistes. Il est bien établi que le mode d’invasion résulte de la capacité des cellules tumorales à s’adapter aux signaux extérieurs envoyés par le stroma environnant et, notamment, par les cellules et la matrice extracellulaire (MEC) [
29] (→→). Ainsi, le rôle promoteur du microenvironnement tumoral, ou stroma tumoral, est désormais attesté par de nombreuses études [
1].
(→) Voir la Synthèse de S. Provot, page 366 de ce numéro
(→→) Voir la Synthèse de E. Buache et M.C. Rio, page 385 de ce numéro
Dans ce contexte, l’existence d’une communication étroite entre les cellules de carcinomes et les cellules stromales est maintenant amplement documentée. Nous savons désormais que les cellules cancéreuses peuvent altérer leur micro-environnement et le rendre propice au développement tumoral en favorisant la constitution d’un stroma « réactif » par une cascade d’événements définis par une réaction desmoplasique. Celle-ci se caractérise par une production excessive de MEC, par l’activation de diverses composantes cellulaires du stroma et, tout particulièrement dans les tumeurs d’origine épithéliales, par l’apparition de myofibroblastes, couramment appelés FAC (fibroblastes associés aux carcinomes), terme qui désigne collectivement une population relativement hétéroclite de fibroblastes activés. |
Origine et rôle des FAC dans le cancer Les FAC représentent une population hétérogène de cellules activées non tumorales du microenvironnement tumoral. D’origines diverses, ces cellules stimulent la progression tumorale en participant à chaque étape de la tumorigenèse depuis l’initiation jusqu’au développement métastatique au sein d’organes secondaires. De nombreux marqueurs propres aux FAC ont été utilisés afin d’en déceler la présence. Cependant, à ce jour, aucun marqueur unique ne permet d’identifier avec précision chaque composante distincte de cette population cellulaire. Origine des FAC Ils dérivent majoritairement de fibroblastes résidents adjacents à la tumeur, ou encore de cellules mésenchymateuses qui, recrutées au sein de la masse tumorale et activées par les cellules cancéreuses, donnent naissance à des cellules favorisant le développement de la tumeur elle-même. La détection des FAC dans des tumeurs requiert l’utilisation de plusieurs marqueurs, tels que l’α- smooth-muscle actine (αSMA), la ténascine-C (TN-C), le récepteur du PDGF ( platelet-derived growth factor), la protéine FAP ( fibroblast activated protein), ou encore des marqueurs de cellules mésenchymateuses, tels que la vimentine, la fibronectine, et la protéine FSP1 ( fibroblast-specific protein 1) [
2]. Ces marqueurs sont exprimés à des niveaux très variables d’une cellule à l’autre ; ils indiquent l’existence de sous-populations de FAC pouvant exercer des effets protumorigéniques distincts. Rôle des FAC dans le cancer La compréhension du rôle important des FAC dans la progression tumorale est toute récente. En effet, il est maintenant établi qu’après leur activation par les cellules tumorales, les FAC émettent des signaux oncogéniques, qu’il s’agisse de la sécrétion de cytokines, de chimiokines et de facteurs de croissance, ou de la constitution d’une MEC protumorale ; ces signaux ciblent les cellules cancéreuses et stimulent in situ la progression tumorale (Figure 1). En effet, des cellules épithéliales cancéreuses mises en présence de fibroblastes activés accroissent leurs propriétés invasives in vivo [
3] et développent une résistance exacerbée aux chimiothérapies [
4]. Ces effets sont également observés dans le cas de cellules épithéliales pancréatiques immortalisées, non tumorales, et cultivées en présence de FAC. Celles-ci acquièrent progressivement un phénotype transformé évoluant vers un phénotype malin [
5]. Ce phénomène confirme des observations effectuées précédemment sur d’autres types de tumeurs épithéliales, notamment les carcinomes prostatiques et spinocellulaires cutanés [
6]. Plus récemment, dans un modèle de carcinome mammaire spontané chez la souris, il a été montré que l’inactivation du gène pten ( phosphatase and tensin homolog) dans les fibroblastes du stroma accélère l’initiation, la progression, et la transformation maligne des tumeurs [
7]. Cette cancérisation est associée à un remodelage matriciel exacerbé, à une infiltration de cellules immunitaires, ainsi qu’à une augmentation de l’angiogenèse tumorale [ 7]. Enfin, il est maintenant bien établi que les FAC induisent la progression tumorale en sécrétant des facteurs de croissance et des cytokines pro-inflammatoires (Figure 1). En effet, une étude récente portant sur les cancers de la peau, du sein et du pancréas, montre que les FAC expriment une signature génique pro-inflammatoire dépendante du facteur de transcription NF-kB [
8]. L’ensemble de ces données suggèrent donc que les FAC créent un environnement inflammatoire, souvent associé à une carcinogenèse, et favorisant ainsi le recrutement de cellules immunitaires, l’angiogenèse et la croissance tumorale [ 8]. Les FAC participent également à l’angiogenèse tumorale par la production de VEGF ( vascular epithelial growth factor) ou du facteur SDF-1 ( stromal cell-derived factor)/CXCL12, ce dernier étant impliqué à la fois dans le recrutement de progéniteurs endothéliaux au sein même de la tumeur, et dans la croissance tumorale par la liaison à son récepteur CXCR4 ( C-X-C chemokine receptor type 4) à la surface des cellules tumorales [
9].
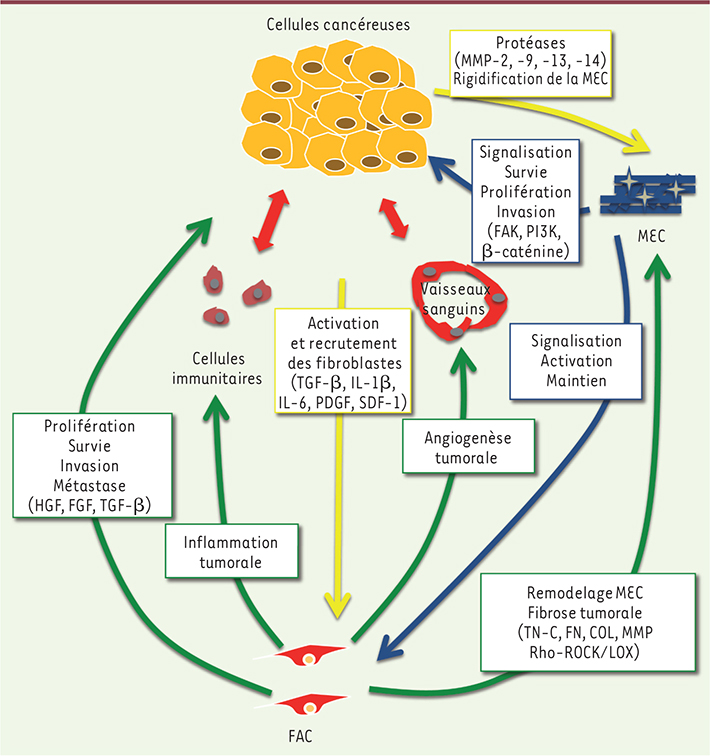
 | Figure 1.
Les FAC au cours de la tumorigenèse. Le TGF-β, produit et sécrété par les cellules cancéreuses, participe à l’activation des fibroblastes adjacents à la tumeur. Après activation, les FAC jouent un rôle prépondérant en favorisant des processus clés de la progression tumorale, tels que la prolifération, la survie, la migration et l’invasion des cellules tumorales. Les FAC sont en partie responsables de l’inflammation et de l’angiogenèse tumorales. En remodelant excessivement la MEC, les FAC sont les principaux responsables de la fibrose cancéreuse ; celle-ci favorise la dissémination des cellules tumorales et joue un rôle complémentaire à celui des MMP sécrétées par les cellules tumorales qui participent activement au processus invasif. TN-C : ténascine C ; FN : fibronectine ; COL : cofiline ; LOX : lysyl oxidase. |
|
Le rôle des FAC dans le remodelage matriciel et l’invasion tumorale Sécrétion de protéines matricielles exerçant une activité protumorale L’architecture du stroma tumoral diffère profondément de celle du tissu conjonctif sain [
10]. Les FAC modifient les propriétés de la MEC en la rendant permissive à l’invasion des cellules tumorales. En effet, les protéines de la MEC sont étroitement liées à la régulation de nombreux processus cellulaires, tels que la survie, la migration et l’invasion des cellules cancéreuses. De plus, les carcinomes invasifs sont souvent accompagnés d’une expansion du stroma tumoral et d’une augmentation du dépôt de protéines dans la MEC [ 10]. Ces dernières incluent, entre autres, la ténascine C, l’EDA-fibronectine ( extra domain A fibronectin), ou encore la protéine SPARC ( secreted protein acidic and rich in cysteine) qui, absente de la MEC des tissus sains, joue un rôle important, non seulement dans le processus invasif des cellules tumorales [ 2], mais aussi dans les fibroses pathologiques. Par ailleurs, il a été montré qu’une MEC riche en collagène de type I, et spécifiquement déposée par des FAC, confère un phénotype tumoral aux cellules pancréatiques ductales non transformées [ 5]. En accord avec ces données, la sécrétion par les fibroblastes d’une MEC exerçant une activité protumorale favorise la création d’une niche métastatique [ 27, 29] ( →). Par exemple, Malanchi et al. ont montré que les fibroblastes activés par des cellules de cancer du sein expriment et déposent de la périostine dans des sites métastatiques, créant ainsi le microenvironnement nécessaire à la colonisation des poumons par des cellules souches tumorales et leur maintien par l’activation de leur voie Wnt [
11].
(→) Voir les Synthèses de S. Provot, et de E. Buache et M.C. Rio, pages 366 et 385 de ce numéro
Rigidification de la MEC L’augmentation de la rigidité matricielle est une conséquence du développement tumoral, et cette caractéristique est exploitée en médecine pour le dépistage des cancers du sein par mammographie [
30] ( →). Cette rigidité provient d’un dépôt accru de protéines de la MEC, notamment de collagène, et de modifications post-traductionnelles des protéines qui la composent. Les FAC sont les principaux médiateurs de ces changements, qui jouent un rôle primordial dans l’acquisition du phénotype invasif des cellules tumorales [ 10]. Les fibroblastes sécrètent la majeure partie des constituants des matrices, qu’elles soient normales ou pathologiques [ 10]. Par rapport à une matrice normale, les modifications constatées touchent aussi l’organisation macromoléculaire de la MEC. Par exemple, les fibres de collagène sont réorganisées perpendiculairement à la tumeur, créant ainsi des chemins que les cellules tumorales invasives peuvent emprunter pour migrer dans le tissu environnant [
12].
(→) Voir la Synthèse de S. Le Guellec et al., page 372 de ce numéro
Chemins d’invasion et migration collective L’invasion collective, décrite essentiellement dans le cas des cellules de carcinomes et de mélanomes, est caractérisée par le maintien des jonctions intercellulaires et d’une polarité multicellulaire à l’intérieur de la cohorte invasive. Lors du processus invasif, les cellules tumorales sont guidées par des cellules leaders, rôle qui, selon le contexte tumoral, peut être tenu soit par une cellule tumorale, soit par un FAC. Grâce à la mise au point de cultures cellulaires en trois dimensions qui permettent de mimer une organisation tissulaire, nous avons décelé le rôle original exercé par les FAC dans l’invasion des cellules de carcinome. En effet, les FAC, ensemencés dans une MEC reconstituée artificiellement, la remodèlent et creusent des chemins d’invasion qui sont empruntés par les cellules tumorales, qui peuvent ainsi migrer et envahir la matrice sous-jacente. Notre approche montre également que les FAC sont toujours les cellules leaders des cohortes invasives, celles-ci ressemblant fortement aux agrégats invasifs observés dans les carcinomes spinocellulaires humains. Médiateurs de la contractilité des FAC Le remodelage de la MEC et la création de chemins d’invasion par les FAC reposent sur l’activité des métalloprotéases matricielles (MMP), la médiation de récepteurs cellulaires (les intégrines) et leur connexion au cytosquelette d’actine [
13] (Figure 2). La coordination de la liaison des intégrines à la MEC et la génération de forces contractiles, via le cytosquelette d’acto-myosine, traduisant la puissance mécanique générée par la cellule sur son substrat, permettent aux fibroblastes de remodeler les macromolécules de la MEC, telles que les fibres des collagènes [
14]. L’alignement des fibres de collagène et la formation des fibres linéaires de fibronectine requièrent, dans les FAC, l’activation de la voie de signalisation de la petite GTPase Rho et de sa kinase effectrice ROCK ( Rho-associated coiled-coil forming protein kinase), permettant la génération de forces contractiles par le cytosquelette d’actine [ 13,
15]. La régulation du cytosquelette d’actine est directement impliquée dans le remodelage matriciel et dans l’augmentation de la rigidité de la MEC induite par les FAC. In vitro, dans les cultures organotypiques contenant des FAC, la rigidité de la MEC est mimée par la contraction de gels riches en collagène I et en laminine [ 13]. Des modèles sophistiqués de cultures organotypiques en trois dimensions, qui miment les compartiments cutanés derme/épiderme, reproduisent l’augmentation de la rigidité matricielle induite par les FAC et la capacité de ces cellules à promouvoir l’invasion tumorale. Ces résultats, obtenus in vitro, ont été récemment confirmés par des résultats in vivo montrant que l’activation de la petite GTPase Rho par la cavéoline-1 entraîne la rigidité et l’organisation matricielles nécessaires à l’invasion des cellules tumorales [ 12] (Figure 2).
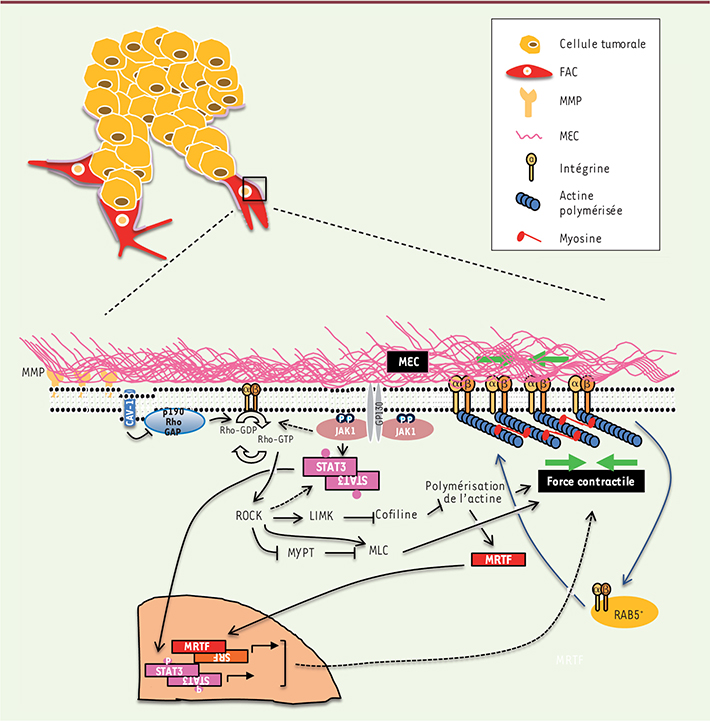
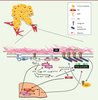 | Figure 2.
Les voies de signalisation régulant le remodelage matriciel par les FAC. Représentation schématique des voies de signalisation impliquées dans le remodelage matriciel pro-invasif par les FAC. Les voies de signalisation Rho/ROCK et JAK1/STAT3 (signal transducer and activator of transcription 3) coopèrent dans la régulation de l’activité contractile du cytosquelette d’acto-myosine dans les FAC, qui est indispensable au remodelage matriciel et à la création des chemins d’invasion dans la MEC. LIMK : LIM domain kinase ; MYPT : myosin phosphatase targeting protein ; MLC : myosine ; SRF : serum response factor ; MRTF : myocardin-related transcription factor ; CAV-1 : cavéoline-1. |
D’autres études font intervenir également les facteurs de transcription SRF (serum reponse factor) et MRTF (myocardin-related transcription factor) comme médiateurs de l’activité contractile des FAC. De manière intéressante, la signalisation de la petite GTPase Rho et la dynamique du réseau d’actine régulent l’activation du facteur de transcription SRF par MRTF qui, à son tour, est impliqué dans la contraction in vitro de matrices de collagène de type I par les FAC. Ces observations ont été confirmées récemment par la découverte que la contractilité des myofibroblastes in vitro et in vivo dépend de la régulation de SRF par les canaux calcium TRPC6 (transient receptor potential cation channel, subfamily C, member 6) [
16]. Implication de la voie de signalisation GP130-JAK des cytokines dans la contractilité des FAC Les cytokines inflammatoires sont fréquemment retrouvées dans le microenvironnement tumoral, et l’inflammation chronique est très impliquée dans l’initiation et la progression tumorales. Dans ce contexte, nous avons montré que la signalisation des cytokines inflammatoires par le récepteur GP130 ( glycoprotein 130) et la kinase JAK1 ( Janus kinase 1) régulent la contractilité des FAC via la voie de signalisation Rho/ROCK (Figure 2). L’inhibition de cette voie bloque totalement le remodelage de la MEC qui est nécessaire aux cellules de carcinomes pour déclencher in vitro toute invasion collective. La mise en évidence d’une boucle de régulation positive entre ces deux voies pourrait également expliquer l’acquisition par les FAC d’un potentiel accru de contractilité qui leur confère un pouvoir pro-invasif. Une autre étude vient confirmer le rôle des kinases JAK, et notamment de JAK2, dans la sclérose systémique, maladie associée à une fibrose accrue caractérisée par une surproduction de MEC par les fibroblastes [
17]. L’assemblage des fibres de collagène par la lysyl oxydase (l’enzyme LOX dépendante du cuivre) est également impliqué dans l’augmentation de la rigidité matricielle induite à la fois par les cellules tumorales et les FAC [
18]. Une rigidité matricielle accrue entraîne une prolifération des cellules épithéliales transformées, et active leur potentiel invasif. L’accroissement du processus d’assemblage des molécules de collagène, et la rigidité accrue de la MEC qui en découle, entraînent le regroupement des intégrines à la membrane plasmique, l’assemblage des adhésions focales, et l’activation de la PI3K (phosphoinositide 3-kinase) qui régule l’invasion des cellules épithéliales in vitro et in vivo [
19]. Protéases et remodelage de la matrice extracellulaire Le remodelage de la MEC par l’action des MMP constitue une autre étape cruciale de la progression tumorale et de la formation du microenvironnement tumoral. En conditions physiologiques, l’expression coordonnée des différentes MMP et de leurs inhibiteurs permet l’agencement d’une MEC organisée et d’une homéostasie cellulaire et tissulaire équilibrée. Ces conditions sont totalement bouleversées dans le stroma tumoral, et les FAC, par leur production importante de protéases, jouent un rôle prépondérant dans la dérégulation d’un tel équilibre. L’action des MMP sécrétées par les cellules tumorales (notamment MMP2, MMP9, MMP13 et MMP14) et par les FAC est également très importante dans la progression tumorale. En dégradant la MEC, ces enzymes assurent, par clivage protéolytique, l’activation de nombreux facteurs de croissance, de cytokines, de récepteurs et de molécules d’adhérence entraînant, de ce fait, la transition épithélio-mésenchymateuse (TEM) des cellules tumorales, processus clé au cours de l’invasion. La dégradation de la MEC par les MMP et les autres protéases influe sur la migration et l’invasion des cellules tumorales, et les contrôle. En effet, la création des chemins d’invasion par les FAC requiert l’activité protéolytique des MMP [13] et, notamment, celle de la MMP14 [
20]. De même, l’apport de protéases par les FAC peut réguler l’activation de cytokines, de facteurs de croissance et de récepteurs tels que l’IGF (insulin growth factor), le FGF (fibroblast growth factor) ou encore le TGF-β (transforming growth factor-β). Par exemple, la MMP13 produite par les FAC clive la forme latente du TGF-β en sa forme active [
21] ; par un clivage spécifique du collagène 1 en fragments actifs, elle régule l’invasion tumorale, ou encore, promeut l’angiogenèse en libérant le VEGF associé à la MEC [
22]. Une autre étude a montré que la MMP3, fortement exprimée par les fibroblastes, peut cliver le domaine extracellulaire de la cadhérine E, une protéine impliquée dans l’adhérence intercellulaire, permettant ainsi aux cellules cancéreuses d’opérer une TEM, ce qui constitue une étape cruciale du processus métastatique [
23, 28] (→). On peut également citer les MMP2, MMP9 et MMP11, sécrétées par les FAC qui, notamment, pour les MMP2 et MMP9 dans le cancer de la prostate, entraînent une TEM des cellules tumorales par une régulation de la cadhérine E [
24]. Dans chaque cas, l’acquisition par les cellules tumorales d’un phénotype « mésenchymateux » et « cellule souche » découlant de l’action des protéases est corrélée à des capacités invasive et métastatique accrues.
(→) Voir la Synthèse de S. Hubert et J.P. Abastado, page 378 de ce numéro
Un autre mode d’action des MMP lors de l’invasion tumorale est illustré par la MMP1 produite par les fibroblastes infiltrant la tumeur. Les protéines PAR (proteinase-activated receptor) sont des récepteurs couplés aux protéines G connus pour être actifs lors de l’invasion tumorale après avoir subi un clivage protéolytique. L’expression de PAR-1 est augmentée dans de nombreux cancers, tels que les cancers du sein, du côlon et des poumons. Grâce à l’utilisation d’un modèle de xénogreffes de cellules de cancer du sein, il a été montré que la MMP1, exportée à l’intérieur de la masse tumorale par les fibroblastes infiltrants, clive PAR-1 et, par ce biais, augmente les capacités migratoires et invasives des cellules tumorales [
25]. |
La mise en place progressive d’un microenvironnement protumoral joue un rôle majeur dans la prolifération, la survie et l’invasion des cellules cancéreuses. Les interactions complexes et synergiques des compartiments composant la tumeur - cellules tumorales, stroma environnant, et la MEC qui les entoure - contribuent à la création de ce microenvironnement dont les capacités protumorales sont démontrées par de nombreuses études, à la fois in vitro et in vivo. La capacité des cellules tumorales à s’affranchir de la tumeur primaire dépend, en partie, du remodelage de la MEC environnante et, notamment, de la création de chemins d’invasion creusés par les FAC. La constitution par ceux-ci d’une matrice permissive à l’invasion tumorale fait intervenir une sécrétion accrue de protéines matricielles et leur agencement dans une MEC pathologique, et ce grâce à l’action coordonnée des MMP, des intégrines et la génération de forces contractiles par les cellules fibroblastiques. À la lumière des découvertes récentes, la compréhension des interactions complexes au sein du microenvironnement tumoral demeure un enjeu crucial pour le développement de thérapies anti-invasive et antimétastatique. À ce jour, les essais cliniques effectués chez des patients atteints de cancers à un stade avancé et visant à évaluer le potentiel thérapeutique des inhibiteurs des MMP ont malheureusement échoué [
26]. Toutefois, les thérapies anticancéreuses couramment utilisées en clinique ciblent généralement les cellules tumorales par le biais d’agents antimitotiques et cytotoxiques, qui inhibent leur prolifération et entraînent leur mort. L’apport de nouvelles perspectives thérapeutiques ciblant les cellules du microenvironnement tumoral, utilisables en complément des traitements courants, pourrait donc déboucher sur des protocoles de traitements cliniques plus globaux améliorant les taux de survie des patients. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Friedl
P
,
Wolf
K
. Plasticity of cell migration: a multiscale tuning model . J Cell Biol.
2010; ; 188 : :11.–19. 2.
Kalluri
R
,
Zeisberg
M
. Fibroblasts in cancer . Nat Rev Cancer.
2006; ; 6 : :392.–401. 3.
Qian
LW
,
Mizumoto
K
,
Maehara
N
, et al.
Co-cultivation of pancreatic cancer cells with orthotopic tumor-derived fibroblasts: fibroblasts stimulate tumor cell invasion via HGF secretion whereas cancer cells exert a minor regulative effect on fibroblasts HGF production . Cancer Lett.
2003; ; 190 : :105.–112. 4.
Wilson
TR
,
Fridlyand
J
,
Yan
Y
, et al.
Widespread potential for growth-factor-driven resistance to anticancer kinase inhibitors . Nature.
2012; ; 487 : :505.–509. 5.
Ottaviano
AJ
,
Sun
L
,
Ananthanarayanan
V
,
Munshi
HG
. Extracellular matrix-mediated membrane-type 1 matrix metalloproteinase expression in pancreatic ductal cells is regulated by transforming growth factor-beta1 . Cancer Res.
2006; ; 66 : :7032.–7040. 6.
Mueller
MM
,
Fusenig
NE
. Friends or foes - Bipolar effects of the tumour stroma in cancer . Nat Rev Cancer.
2004; ; 4 : :839.–849. 7.
Trimboli
AJ
,
Cantemir-Stone
CZ
,
Li
F
, et al.
Pten in stromal fibroblasts suppresses mammary epithelial tumours . Nature.
2009; ; 461 : :1084.–1091. 8.
Erez
N
,
Truitt
M
,
Olson
P
, et al.
Cancer-associated fibroblasts are activated in incipient neoplasia to orchestrate tumor-promoting inflammation in an NF-kappaB-dependent manner . Cancer Cell.
2010; ; 17 : :135.–147. 9.
Orimo
A
,
Gupta
PB
,
Sgroi
DC
, et al.
Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion . Cell.
2005; ; 121 : :335.–348. 10.
Butcher
DT
,
Alliston
T
,
Weaver
VM
. A tense situation: forcing tumour progression . Nat Rev Cancer.
2009; ; 9 : :108.–122. 11.
Malanchi
I
,
Santamaria-Martínez
A
,
Susanto
E
, et al.
Interactions between cancer stem cells and their niche govern metastatic colonization . Nature.
2012; ; 481 : :85.–89. 12.
Goetz
JG
,
Del Pozo
MA
. La cavéoline-1 force le remodelage de la matrice extracellulaire . Med Sci (Paris).
2011; ; 27 : :940.–944. 13.
Gaggioli
C
,
Hooper
S
,
Hidalgo-Carcedo
C
, et al.
Fibroblast-led collective invasion of carcinoma cells with differing roles for RhoGTPases in leading and following cells . Nat Cell Biol.
2007; ; 9 : :1392.–1400. 14.
Grinnell
F
. Fibroblast biology in three-dimensional collagen matrices . Trends Cell Biol.
2003; ; 13 : :264.–269. 15.
Meshel
AS
,
Wei
Q
,
Adelstein
RS
,
Sheetz
MP
. Basic mechanism of three-dimensional collagen fibre transport by fibroblasts . Nat Cell Biol.
2005; ; 7 : :157.–164. 16.
Davis
J
,
Burr
AR
,
Davis
GF
, et al.
A TRPC6-dependent pathway for myofibroblast transdifferentiation and wound healing in vivo
. Dev Cell.
2012; ; 23 : :705.–715. 17.
Dees
C
,
Tomcik
M
,
Palumbo-Zerr
K
, et al.
JAK-2 as a novel mediator of the profibrotic effects of transforming growth factor beta in systemic sclerosis . Arthritis Rheum.
2012; ; 64 : :3006.–3015. 18.
Barker
HE
,
Cox
TR
,
Erler
JT
. The rationale for targeting the LOX family in cancer . Nat Rev Cancer.
2012; ; 12 : :540.–552. 19.
Levental, KR
,
Yu
H
,
Kass
L
, et al.
Matrix crosslinking forces tumor progression by enhancing integrin signaling . Cell.
2009; ; 139 : :891.–906. 20.
Wolf
K
,
Wu
YI
,
Liu
Y
, et al.
Multi-step pericellular proteolysis controls the transition from individual to collective cancer cell invasion . Nat Cell Biol.
2007; ; 9 : :893.–904. 21.
D’Angelo
M
,
Billings
PC
,
Pacifici
M
, et al.
Authentic matrix vesicles contain active metalloproteases (MMP): a role for matrix vesicle-associated MMP-13 in activation of transforming growth factor-beta . J Biol Chem.
2001; ; 276 : :11347.–11353. 22.
Bergers
G
,
Brekken
R
,
McMahon
G
, et al.
Matrix metalloproteinase-9 triggers the angiogenic switch during carcinogenesis . Nat Cell Biol.
2000; ; 2 : :737.–744. 23.
Lochter
A
,
Galosy
S
,
Muschler
J
, et al.
Matrix metalloproteinase stromelysin-1 triggers a cascade of molecular alterations that leads to stable epithelial-to-mesenchymal conversion and a premalignant phenotype in mammary epithelial cells . J Cell Biol.
1997; ; 139 : :1861.–1872. 24.
Giannoni
E
,
Bianchini
F
,
Masieri
L
, et al.
Reciprocal activation of prostate cancer cells and cancer-associated fibroblasts stimulates epithelial-mesenchymal transition and cancer stemness . Cancer Res.
2010; ; 70 : :6945.–6956. 25.
Boire
A
,
Covic
L
,
Agarwal
A
, et al.
PAR1 is a matrix metalloprotease-1 receptor that promotes invasion and tumorigenesis of breast cancer cells . Cell.
2005; ; 120 : :303.–313. 26.
Overall
CM
,
Kleifeld
O
. Tumour microenvironment - opinion: validating matrix metalloproteinases as drug targets and anti-targets for cancer therapy . Nat Rev Cancer.
2006; ; 6 : :227.–239. 27.
Provot
S
. Contrôle de la croissance et de la dissémination tumorales par le microenvironnement : certitudes et hypothèses émergentes . Med Sci (Paris).
2014; ; 30 : :366.–371. 28.
Hubert
S
,
Abastado
JP
. Les étapes précoces du processus métastatique . Med Sci (Paris).
2014; ; 30 : :378.–384. 29.
Buache
E
,
Rio
MC
. Le stroma tumoral, un terreau fertile pour la cellule cancéreuse . Med Sci (Paris).
2014; ; 30 : :385.–390. 30.
Le Guellec
S
,
Duprez-Paumier
R
,
Lacroix-Triki
M
. Microenvironnement tumoral : la vision du pathologiste . Med Sci (Paris).
2014; ; 30 : :372.–377. |