| |
| Med Sci (Paris). 2014 April; 30(4): 405–407. Published online 2014 May 5. doi: 10.1051/medsci/20143004014.Les exosomes des cellules stromales, bras armé de l’activation autocrine des cellules cancéreuses Frédéric A. Fellouse1* 1Lunenfeld Tanenbaum Research Institute, Mount Sinai Hospital, 600 University Avenue, M5G 1X5Toronto, Ontario, Canada |
Les fibroblastes représentent le type cellulaire le plus abondant dans les tissus conjonctifs, au sein desquels ils ont un rôle structurel, par leur capacité à produire les composants de la matrice extracellulaire. Lors du processus de cicatrisation, les fibroblastes entrent dans un processus d’activation. Des fibroblastes, eux aussi activés, mais de manière irréversible, sont présents dans la majorité des tumeurs cancéreuses [
1]. Ces CAF (cancer associated fibroblasts) représentent en fait la majorité des cellules et jouent un rôle très important dans la progression tumorale [
10–
13] (→). Les fibroblastes activés interagissent avec les cellules cancéreuses et peuvent inhiber les stades préliminaires du développement tumoral [
2], mais aussi promouvoir ce dernier en créant un environnement favorable au développement de la tumeur et à la formation de métastases [
3]. Nous rapportons ici un exemple de ce mécanisme de facilitation de la progression tumorale via des exosomes sécrétés par des CAF.
(→) Voir les Synthèses de S. Provot, de S. Hubert et J.P. Abastado, de J. Albrengues et al., et de E. Buache et M.C. Rio, pages 366, 378, 385 et 391 de ce numéro
|
Les L-cells murines activées augmentent l’activité métastatique de cellules cancéreuses du sein Partant de l’observation que le surnageant de L-cells murines (cellules fibroblastiques issues du tissu conjonctif sous-cutané) activées induit la formation de protrusions membranaires protubérantes et augmente la motilité cellulaire des cellules mammaires tumorales, l’équipe du Pr Wrana [
4] a exploré le rôle de ces fibroblastes activés sur le développement de métastases dans des modèles tumoraux murins. L’équipe a ainsi découvert que la co-injection de L-cells et de cellules MDA-MB-231, cellules humaines dérivées d’un cancer du sein (CCS), tumorigènes mais faiblement métastatiques, accroît le nombre de colonies métastatiques d’un facteur 4 dans les poumons des animaux (souris immunodéficientes SCID), par rapport à l’injection des seules cellules MDA-MB-231. |
La voie Wnt/PCP est essentielle Comme les protéines SMURF1 (SMAD ubiquitination regulatory factor 1) et SMURF2 interviennent dans la formation des protrusions membranaires et dans la motilité des cellules tumorales [
5], Luga et al. ont étudié l’effet de la répression de l’expression des gènes Smurf1 et Smurf2 (ARN interférence). La formation de protrusions de la membrane cytoplasmique et la motilité des cellules MDA-MB-231 induites par le surnageant des L-cells étaient non seulement dépendantes de l’expression des gènes Smurf1/2 par ces cellules, mais aussi de gènes considérés comme le noyau dur de la voie de signalisation de Wnt qui régule la polarité planaire cellulaire (Wnt/PPC) : Fzd6, Dvl1, Pk1, and Vangl1. La voie Wnt/PCP contrôle normalement l’orientation des cellules dans un plan perpendiculaire à l’axe apical-basal (par exemple l’orientation des cellules sensorielles de l’oreille interne ou les follicules pileux dans l’épiderme). Un grand nombre des gènes impliqués dans la voie Wnt/PPC sont surexprimés dans les cellules cancéreuses et associés à la croissance tumorale, la migration et la formation de métastases [
6]. En observant l’effet de la répression de l’expression du gène Pk1 dans les cellules MDA-MB-231 co-injectées avec les L-cells, Luga et al. ont aussi montré que la voie Wnt/PPC des cellules tumorales est essentielle pour l’induction de leur pouvoir métastatique par les L-cells murines. De même, Wnt11 est aussi nécessaire à cette induction, puisque la répression de son expression, mais pas celle de Wnt5a, dans les cellules tumorales inhibe l’activité du surnageant des L-cells sur ces mêmes cellules. Mais, si WNT11 et WNT5a sont produits par les cellules tumorales, ils ne le sont pas par les L-cells. De plus, pour que les facteurs sécrétés par les L-cells soient actifs, la présence de Porcupine, une acyl-transférase dont l’activité est essentielle à l’acylation et la sécrétion des molécules WNT, est essentielle dans les cellules cancéreuses, mais pas dans les L-cells. Le traitement par le surnageant paraît redistribuer les molécules WNT11 : celles-ci, dont la distribution intracellulaire dans les cellules normales est ponctuée, se localisent désormais à la surface cellulaire, et plus précisément à l’extrémité des protrusions, au même endroit que les récepteurs des ligands WNT, FZD6 (frizzled). Ces résultats indiquent que les L-cells sécrètent un ou des facteur(s) qui favorise(nt) la voie de signalisation autocrine du Wnt/PPC dans les cellules tumorales (Figure 1.
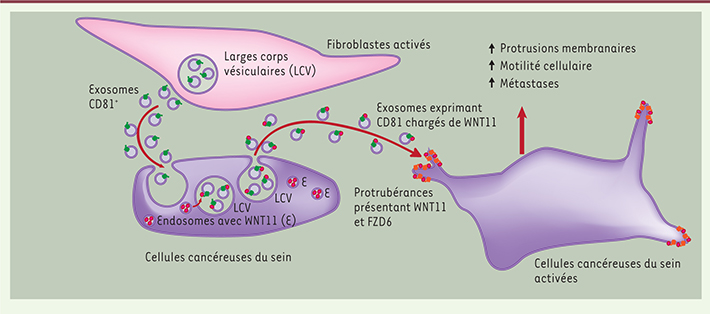
 | Figure 1.
Représentation schématique de l’échange d’exosomes entre les cellules fibroblastiques activées et les cellules tumorales mammaires. Une cellule fibroblastique activée est représentée (couleur rose), avec un large corps vésiculaire contenant des exosomes CD81+ (CD81 est représenté par un ruban de couleur verte). Ces exosomes entrent en contact avec les cellules cancéreuses du sein (couleur violette), qui chargent ces exosomes avec les molécules WNT11 (représentées par des rubans de couleur rouge). Les exosomes chargés de protéines WNT11 sont ensuite secretes et activent la formation de protrusions membranaires, la motilité et l’activité métastatique des cellules tumorales, qui portent les molecules WNT11 et FZD6 à l’extrémité de leurs protrusions membranaires. |
|
Des exosomes à l’origine de l’activation autocrine des cellules cancéreuses par les L-cells
En combinant des approches biochimiques et d’analyse par spectrométrie de masse et microscopie électronique, les chercheurs ont découvert que les facteurs sécrétés par les L-cells responsables de l’activation autocrine de la voie Wnt/PCP dans les cellules tumorales sont des exosomes dont la structure est typique. Ces exosomes, captés et internalisés par les cellules tumorales via la voie d’endocytose, se chargent de molécules WNT11 qui sont responsables de l’activation de la voie de signalisation du Wnt/PCP dans ces cellules, et donc de l’activation du potentiel métastatique de celles-ci. Les exosomes sont des vésicules membranaires provenant de larges corps vésiculaires (LCV) et sont sécrétés dans le milieu extracellulaire lors de la fusion des LCV avec la membrane cytoplasmique. Les exosomes des L-cells sont riches en de nombreuses molécules biologiquement actives. En particulier, la protéine transmembranaire CD81 (tétraspannine) s’est avérée être cruciale pour la fonctionnalité des exosomes sécrétés par les L-cells dans ce processus d’activation autocrine. En effet, la répression de l’expression du gène Cd81 dans les L-cells (par anticorps ou interférence ARN) inhibe complètement leur capacité à induire l’activité métastatique des cellules MDA-MB-231 avec lesquelles elles sont co-injectées, sans toutefois modifier la croissance de la tumeur primaire. |
Les exosomes dans le développement tumoral Le travail de Luga et al. démontre un lien mécanistique entre l’échange d’exosomes et l’activité métastatique de cellules tumorales dans un modèle murin. Il est important de mentionner que la sécrétion d’exosomes CD81+ facilitant une activité métastatique chez ces animaux a aussi été observée à partir de CAF issus de cancers du sein humains. L’existence de tels fragments cellulaires actifs capables d’interagir avec différents types cellulaires, de circuler de façon systémique et d’induire l’activation des voies de signalisation des cellules receveuses, nous incite à modifier notre façon d’appréhender les interactions cellulaires et les mécanismes de développement d’un cancer. D’autres exemples confirment l’importance des échanges d’exosomes dans le développement tumoral. Nous en citerons deux : Al-Nedawi et al. [
7] ont montré que les cellules qui expriment une forme constitutivement active du récepteur du facteur de croissance épithéliale (EGFRvIII), bien que présente à des taux faibles dans une tumeur, transmettent via des exosomes les protéines d’EGFRvIII à des cellules ne portant pas la mutation du gène d’Egfr, et induisent l’activation des voies MAPK et AKT et la transformation tumorale de ces cellules normales. D’autre part, Abusamra et al. [
8] ont montré que les exosomes sécrétés par certaines cellules cancéreuses permettent le transfert du ligand de Fas, et, ainsi, permettent aux cellules cancéreuses d’échapper au système immunitaire. Le dévoilement de ces modes de communications intracellulaires devrait ouvrir la voie à de nouvelles stratégies thérapeutiques. Cependant il est important de garder à l’esprit que les échanges d’exosomes sont aussi d’importants stimulateurs du système immunitaire [
9]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Sappino
AP
,
Skalli
O
,
Jackson
B
,
Schurch
W
,
Gabbiani
G
. Smooth-muscle differentiation in stromal cells of malignant and non-malignant breast tissues . Int J Cancer.
1988; ; 41 : :707.–712. 2.
Bissell
MJ
,
Hines
WC
. Why don’t we get more cancer? A proposed role of the microenvironment in restraining cancer progression . Nat Med. ; 17 : :320.–329. 3.
Cirri
P
,
Chiarugi
P
. Cancer associated fibroblasts: the dark side of the coin . Am J Cancer Res. ; 1 : :482.–497. 4.
Luga
V
,
Zhang
L
,
Viloria-Petit
AM
, et al.
Exosomes mediate stromal mobilization of autocrine Wnt-PCP signaling in breast cancer cell migration . Cell.
2012; ; 151 : :1542.–1556. 5.
Narimatsu
M
,
Bose
R
,
Pye
M
, et al.
Regulation of planar cell polarity by Smurf ubiquitin ligases . Cell.
2009; ; 137 : :295.–307. 6.
Jessen
JR
. Noncanonical Wnt signaling in tumor progression and metastasis . Zebrafish.
2009; ; 6 : :21.–28. 7.
Al-Nedawi
K
,
Meehan
B
,
Micallef
J
, et al.
Intercellular transfer of the oncogenic receptor EGFRvIII by microvesicles derived from tumour cells . Nat Cell Biol.
2008; ; 10 : :619.–624. 8.
Abusamra
AJ
,
Zhong
Z
,
Zheng
X
, et al.
Tumor exosomes expressing Fas ligand mediate CD8+ T-cell apoptosis . Blood Cells Mol Dis.
2005; ; 35 : :169.–173. 9.
Thery
C
,
Ostrowski
M
,
Segura
E
. Membrane vesicles as conveyors of immune responses . Nat Rev Immunol.
2009; ; 9 : :581.–593. 10.
Provot
S
. Contrôle de la croissance et de la dissémination tumorales par le microenvironnement : certitudes et hypothèses émergentes . Med Sci (Paris).
2014; ; 30 : :366.–371. 11.
Hubert
S
,
Abastado
JP
. Les étapes précoces du processus métastatique . Med Sci (Paris).
2014; ; 30 : :378.–384. 12.
Albrengues
J
,
Meneguzzi
G
,
Gaggioli
C
. L’invasion des cellules tumorales : quand les fibroblastes s’en mêlent . Med Sci (Paris).
2014; ; 30 : :391.–397. 13.
Buache
E
,
Rio
MC
. Le stroma tumoral, un terreau fertile pour la cellule cancéreuse . Med Sci (Paris).
2014; ; 30 : :385.–390. |