| |
| Med Sci (Paris). 2014 May; 30(5): 483–485. Published online 2014 June 13. doi: 10.1051/medsci/20143005003.La complexité insoupçonnée du tractus digestif de la drosophile Vers un modèle de régionalisation fonctionnelle Dani Osman1** and Nicolas Buchon2* 1Global Health Institute, Station 19, École polytechnique fédérale de Lausanne, 1015Lausanne, Suisse 2Department of Entomology, Cornell University, Ithaca, NY14850, États-Unis MeSH keywords: Animaux, Drosophila melanogaster, anatomie et histologie , Tube digestif, cytologie, physiologie, Modèles biologiques, Spécificité d'organe |
Le tractus digestif est un système vital composé de plusieurs compartiments aux rôles physiologiques hautement spécifiques. Toutefois, les déterminants moléculaires qui établissent et maintiennent une telle régionalisation durant la vie d’un organisme restent très peu connus. Deux études récentes révèlent la surprenante complexité du tractus digestif de la drosophile, lui aussi subdivisé en de multiples sous-régions. Nous exposons ici les mécanismes cellulaires et moléculaires qui permettent de maintenir cette régionalisation chez la drosophile adulte alors même que l’intestin subit un renouvellement continu tout au long de la vie. |
La régionalisation intestinale : généralités Les organes vitaux sont souvent divisés en sous-structures tissulaires qui se spécialisent et assurent des rôles distincts. Chez les métazoaires supérieurs, le tractus digestif est le meilleur exemple d’un organe disposant d’une segmentation fonctionnelle, où différentes régions de l’intestin adoptent une morphologie et des types cellulaires différents. Ceci permet d’assurer des fonctions séquentielles incluant l’ingestion, le transit, la digestion, l’absorption et l’excrétion des aliments. Le bon fonctionnement du système digestif dépend donc à la fois de l’intégrité du tractus digestif, mais aussi de la capacité de l’organe à maintenir son organisation fonctionnelle. Cette caractéristique est assurée essentiellement via l’activité de cellules souches intestinales disséminées le long de l’épithélium formant le tube digestif. Les cellules souches intestinales sont capables de se diviser et de se différencier pour compenser la perte constante des cellules qui composent l’épithélium des différentes régions du tube digestif. À ce jour, la compréhension des mécanismes cellulaires et moléculaires qui sont impliqués dans l’organisation et le maintien du tractus digestif adulte reste un défi majeur. |
La drosophile : un nouveau modèle d’étude de l’intestin Récemment, l’intestin moyen de la drosophile s’est avéré être un modèle de choix pour étudier l’activité des cellules souches intestinales [
1,
2,
8]. À l’image de ce qui se passe dans l’estomac et l’intestin humains, les cellules souches intestinales permettent le remplacement des cellules épithéliales mortes, en générant de nouvelles cellules, appelées cellules progénitrices ou entéroblastes. Ces dernières vont ensuite se différencier en cellules épithéliales matures, nommées entérocytes, ou en cellules entéroendocrines [
3]. Cependant, la plupart des études se sont focalisées sur l’analyse de l’activité des cellules souches intestinales dans la partie postérieure de l’intestin chez l’adulte, tout en négligeant d’examiner l’organisation structurelle et fonctionnelle de l’ensemble du tube digestif. Historiquement, les scientifiques ont divisé l’intestin moyen adulte en trois grandes parties : antérieure, intermédiaire et postérieure [
4]. Cette organisation, définie suite à l’identification d’une région à pH très acide au milieu de l’intestin, suggérait que le tube digestif de la drosophile est divisé en régions physiologiquement spécialisées. Ceci a amené deux laboratoires à caractériser de façon exhaustive la régionalisation de l’intestin moyen de la drosophile et à s’interroger sur les réseaux génétiques qui établissent et maintiennent une telle structure à diverses fonctions [
5,
6]. |
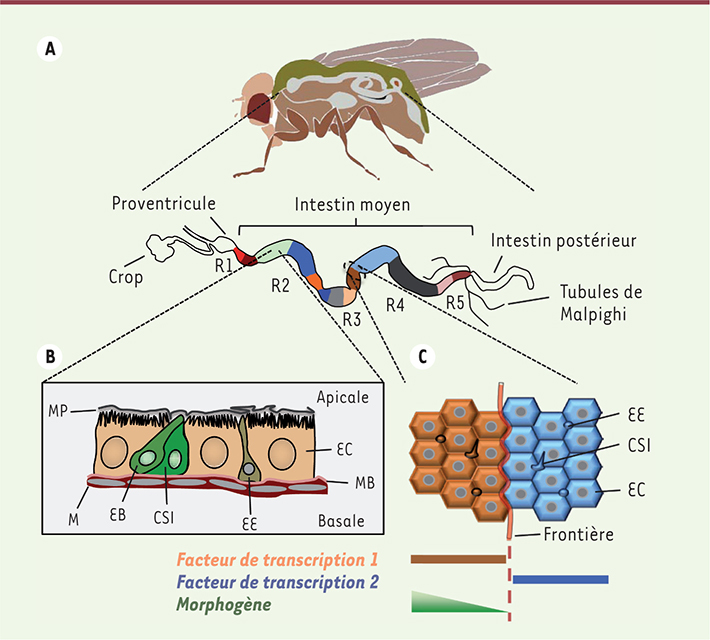
L’intestin moyen de la drosophile est composé de cinq compartiments fonctionnels Tout d’abord, une analyse micro-morphométrique chez l’adulte a permis d’identifier six constrictions majeures tout au long de la lumière intestinale. Ces constrictions délimitent cinq grands compartiments qui peuvent eux-mêmes être divisés en huit sous-régions d’histologie distincte, et 14 sous-régions exprimant des groupes de gènes spécifiques (Figure 1). Cette organisation précise n’est acquise que quelques jours après le passage au stade adulte, indiquant que les mécanismes de base qui confèrent l’identité régionale sont mis en place tardivement au cours du développement. Une fois établie, l’organisation intestinale reste stable tout au long de la vie, indépendamment de changements nutritionnels ou des dommages subis par le tissu [5]. Cependant, lors du vieillissement, la régionalisation intestinale est profondément altérée, et associée à une prolifération anormale des cellules souches [5,
7]. On peut ainsi se demander si la détérioration de la régionalisation du tube digestif n’est pas un facteur causal du développement de cancers gastro-intestinaux lors du vieillissement.
 | Figure 1.
L’intestin moyen de la drosophile est composé de cinq régions majeures. A. L’intestin moyen de la drosophile est composé de 5 régions majeures (R1-R5) qui sont subdivisées en 14 sous-régions, schématisées par des segments de couleur. MP : membrane péritrophique ; M : muscles ; MB : membrane basale. B. L’épithélium intestinal est constamment renouvelé grâce à l’activité des cellules souches intestinales (CSI) qui se divisent et génèrent un entéroblaste (EB) et une nouvelle cellule souche. L’entéroblaste se différencie soit en une cellule épithéliale absorptive/digestive (entérocyte, EC), soit sécrétrice (entéroendocrine, EE). C. Les régions intestinales sont établies et maintenues par des populations distinctes de cellules souches, dont les cellules filles ne se mélangent pas entre elles. L’action combinée de facteurs de transcription et de morphogènes exprimés localement confère une identité régionale aux cellules de l’intestin moyen. |
Afin de mieux caractériser la fonction des cinq compartiments majeurs, une analyse du transcriptome régional a révélé que chacune de ces régions est fonctionnellement spécialisée [5, 6]. Ainsi, les parties antérieures de l’intestin moyen sont impliquées dans la digestion des macromolécules telles que l’amidon, les lipides et protéines complexes, tandis que les régions postérieures finissent de dégrader et transportent les micromolécules. Les fonctions immunitaires et de détoxication sont elles aussi régionalisées, et prédominent dans les compartiments les plus antérieurs, agissant comme une première barrière de défense pour protéger le reste du tube digestif. |
Mécanismes à la base du maintien de la régionalisation intestinale Quels sont les mécanismes moléculaires et cellulaires qui maintiennent l’identité régionale des cellules intestinales chez l’adulte ? Y a-t-il une ressemblance avec ceux qui sont impliqués dans la spécification et la différenciation du système digestif au cours du développement ? Nous avons pu montrer que certains régulateurs clés utilisés lors du développement, comme les facteurs de transcription GATAe et labial, sont aussi requis pour maintenir la régionalisation et la différenciation de l’intestin tout au long de la vie adulte [5]. De plus, nous avons identifié plusieurs nouveaux facteurs de transcription impliqués dans le contrôle de cette régionalisation. Certains de ces facteurs sont exprimés tout le long de l’intestin (par ex. bigmax), d’autres de manière régionale (par ex. Ptx1). Ces données montrent que c’est la combinatoire de ces facteurs de transcription qui est requise pour générer et maintenir les compartiments intestinaux. D’autres acteurs principaux impliqués dans le contrôle de l’organogenèse sont les morphogènes. Les morphogènes sont des molécules diffusibles qui forment des gradients de concentration. Ceci confère des informations de position aux cellules avoisinantes et aboutit à leur spécification en différents types cellulaires selon la concentration du morphogène. Nous avons pu montrer que le morphogène Wnt/Wg (wingless chez la drosophile) joue un rôle primordial dans le maintien de la régionalisation intestinale [5]. La voie de signalisation Wnt/Wg est activée en suivant un gradient aux alentours des constrictions majeures séparant les régions principales de l’intestin (Figure 1). Ce résultat inattendu suggère que ces constrictions agissent à la fois comme des frontières entre régions et comme des centres organisateurs pour ces mêmes régions. Il est à noter que GATA3 et Wnt sont également détectés à la frontière entre l’intestin et l’estomac chez les mammifères, suggérant une conservation fonctionnelle des déterminants génétiques impliqués dans la segmentation du tube digestif. Ces frontières anatomiques jouent également un rôle dans le maintien de l’identité cellulaire, puisque les cellules épithéliales qui font partie de compartiments adjacents ne se mélangent pas et restent à l’intérieur de leurs compartiments respectifs (Figure 1) [6]. Les bases moléculaires qui permettent de définir ces frontières entre régions restent mystérieuses. Enfin, il est à noter qu’à l’instar des cellules souches intestinales chez l’homme, les cellules souches intestinales chez la drosophile possèdent des capacités prolifératives différentes en fonction de leur localisation régionale, et ce en conditions homéostatiques normales ou tumorales [6]. |
Régionalisation intestinale, quel avenir ? Ces travaux marquent seulement le premier pas vers une compréhension des mécanismes cellulaires et moléculaires qui contrôlent la régionalisation intestinale adulte. Plus d’efforts sont requis pour préciser quels sont les mécanismes initiateurs de cette régionalisation, et quelles sont les spécificités régionales des cellules souches intestinales et de leurs cellules filles. Ces études permettront aussi d’identifier les déterminants clés qui contrôlent le développement tumoral dans l’intestin, que ce soit spatialement ou au cours du vieillissement. Par ailleurs, et malgré la distance phylogénétique qui sépare les mammifères et la drosophile, il s’avère que les déterminants moléculaires régulant l’activité des cellules souches ainsi que la régionalisation intestinale sont conservés. Cela fait de la drosophile un excellent modèle pour enrichir notre connaissance fondamentale de la structure et de la fonction normale et pathologique du tractus digestif. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Micchelli
CA
,
Perrimon
N
. Evidence that stem cells reside in the adult Drosophila midgut epithelium . Nature.
2006; ; 439 : :475.–479. 2.
Ohlstein
B
,
Spradling
AC
. Multipotent Drosophila intestinal stem cells specify daughter cell fates by differential notch signaling . Science.
2007; ; 315 : :988.–992. 3.
Casali
A
,
Batlle
E
. Intestinal stem cells in mammals and Drosophila . Cell Stem Cell.
2009; ; 4 : :124.–127. 4.
Dubreuil
RR
. Copper cells and stomach acid secretion in the Drosophila midgut . Int J Biochem Cell Biol.
2004; ; 36 : :745.–752. 5.
Buchon
N
,
Osman
D
,
David
FPA
, et al.
Morphological and molecular characterization of adult midgut compartmentalization in Drosophila . Cell Rep.
2013; ; 3 : :1725.–1738. 6.
Marianes
A
,
Spradling
AC
,
Brand
A
. Physiological and stem cell compartmentalization within the Drosophila midgut . eLife.
2013 ; :2..
7.
Biteau
B
,
Hochmuth
CE
,
Jasper
H
. JNK activity in somatic stem cells causes loss of tissue homeostasis in the aging Drosophila gut . Cell Stem Cell.
2008; ; 3 : :442.–455. 8.
Andriatsilavo
M
,
Gervais
L
,
Fons
C
,
Bardin
AJ
. L’intestin moyen de drosophile . Med Sci (Paris).
2013; ; 29 : :75.–81. |