| |
| Med Sci (Paris). 2014 May; 30(5): 496–499. Published online 2014 June 13. doi: 10.1051/medsci/20143005007.Stress du réticulum endoplasmique et apoptose de la cellule bêta dans le diabète Chronique d’une mort annoncée Decio L. Eizirik1* and Isabelle Millard1 1Laboratoire de médecine expérimentale et centre de recherche sur le diabète, Faculté de médecine, Université Libre de Bruxelles (ULB) Route de Lennik, 808, CP618, 1070Bruxelles, Belgique MeSH keywords: Apoptose, Cytokines, métabolisme, Diabète de type 1, anatomopathologie, Diabète de type 2, Stress du réticulum endoplasmique, Humains, Insuline, Cellules à insuline, Réponse aux protéines mal repliées |
Les cellules sécrétrices, telles que les cellules bêta pancréatiques, doivent faire face en permanence au défi que représente une synthèse protéique accrue. C’est ainsi que des cellules bêta exposées à de fortes concentrations de glucose augmentent de plus de dix fois leur production d’insuline, avec une synthèse hormonale représentant près de 50 % de la synthèse protéique totale. La traduction de la (pro)insuline et d’autres protéines sécrétées a lieu dans les ribosomes situés sur la surface cytosolique du réticulum endoplasmique (RE). La (pro)insuline nouvellement synthétisée est ensuite dirigée vers le réticulum endoplasmique, où elle va former des ponts disulfures et se replier selon sa structure tridimensionnelle caractéristique [
1,
2]. Cette synthèse protéique très importante représente, à court et à long terme, une charge considérable pour le réticulum endoplasmique de la cellule bêta. D’une part, ces cellules doivent répondre à des exigences de production et de libération d’insuline en fonction des apports alimentaires [2], et, d’autre part, elles ont, chez l’homme, une durée de vie très longue (la population de cellules bêta est pratiquement établie dès l’enfance). Les cellules bêta de sujets obèses présentant une résistance à l’insuline doivent développer des mécanismes compensatoires sur de très longues périodes, afin de répondre aux besoins sans cesse croissants en insuline. Cela oblige les cellules bêta, tout comme d’autres cellules sécrétrices, à mettre en place des dispositifs de contrôle et de régulation de fonctionnement du réticulum endoplasmique. |
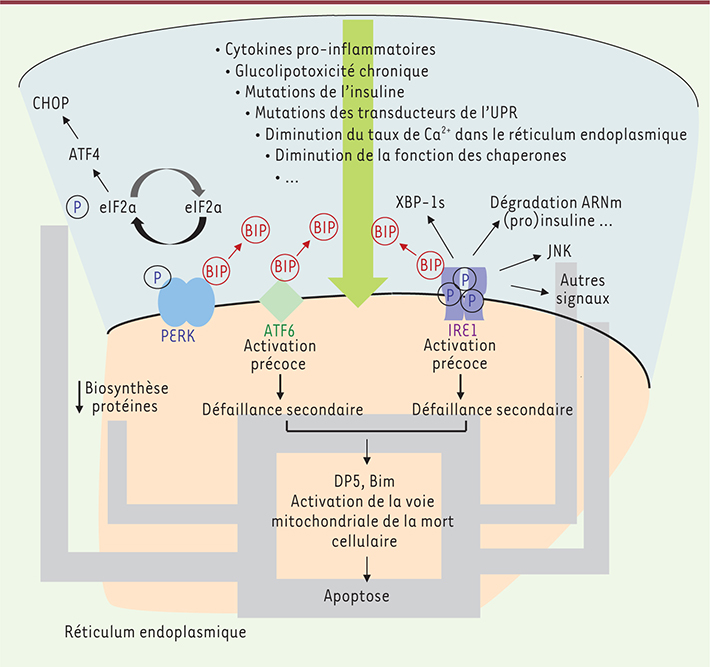
L’UPR ( unfolded protein response) : une réponse au stress du réticulum endoplasmique Les dispositifs de régulation du réticulum endoplasmique constituent une réponse adaptative, connue sous le nom de réponse UPR (unfolded protein response), et régie par des capteurs (protéines) transmembranaires du réticulum endoplasmique, dont le domaine luminal détecte de manière indirecte les protéines mal repliées dans le réticulum endoplasmique (stress du réticulum endoplasmique) tandis que le domaine cytosolique transmet l’information à des effecteurs cytosoliques et nucléaires (Figure 1). La réponse UPR a pour fonction de ralentir temporairement l’arrivée de nouvelles protéines dans le réticulum endoplasmique, d’augmenter les capacités de repliement de l’organite en stimulant la synthèse de protéines chaperones, et d’accroître la dégradation des protéines mal repliées. Néanmoins, lorsque ces différents mécanismes ne permettent pas de restaurer l’homéostasie normale du réticulum endoplasmique, un processus d’apoptose de la cellule bêta peut être déclenché (Figure 2) via l’activation de la voie mitochondriale de la mort cellulaire [
3]. Pourquoi et comment les cellules bêta subissent-elles cette transition entre une réponse UPR physiologique et une réponse pathologique, la chose reste à élucider, mais de récentes découvertes suggèrent qu’une défaillance progressive dans l’activation de XBP-1 (X-box binding protein 1) et ATF-6 (activating transcription factor 6) pourrait contribuer à la mort des cellules bêta [
4].
 | Figure 1.
Signalisation UPR dans les cellules bêta pancréatiques exposées à un stress sévère du réticulum endoplasmique. Dans des conditions d’homéostasie, la chaperone BIP est liée au domaine luminal des protéines transmembranaires ATF6 (activating transcription factor 6), PERK (protein kinase RNA- like endoplasmic reticulum kinase) et IRE1, les maintenant ainsi dans un état d’inactivité. En réponse à une accumulation de protéines mal repliées dans le lumen du réticulum endoplasmique, BIP va se lier préférentiellement à ces protéines dans le but de leur faire adopter une structure de repliement correcte. Ceci a pour effet d’activer les trois branches de la réponse UPR. (1) L’activation de PERK par autophosphorylation conduit à la phosphorylation et à l’inactivation de eIF2α. eIF2α est un initiateur clé de la traduction, et sa phosphorylation inhibe le processus global de traduction protéique, diminuant ainsi la charge du réticulum. Paradoxalement, la traduction de certains ARNm comme ATF4 s’en trouve en revanche augmentée. ATF4 active CHOP (C/EBP homologous protein) qui peut, en retour, contribuer à l’inflammation et à l’apoptose induites par un stress du réticulum. (2) ATF6 migre dans l’appareil de Golgi, où elle subit un clivage par les protéases SP1 et SP2. Le fragment ainsi généré, ATF6(f), est un facteur transcriptionnel qui module l’expression de chaperones telles que BIP et d’enzymes indispensables au fonctionnement du réticulum endoplasmique. (3) La branche la plus conservée de la réponse UPR est sous l’influence de IRE1, elle-même activée par autophosphorylation. IRE1 activée possède une activité endoribonucléasique et induit l’épissage du facteur transcriptionnel XBP1 (X-box binding protein 1). XBP1 ainsi épissé (XBP1s) déclenche la transcription d’autres gènes impliqués dans le repliement et la maturation des protéines, ainsi que dans la dégradation des protéines anormales. IRE1 peut aussi dégrader des ARNm comme l’insuline, diminuant ainsi la charge de travail du réticulum. IRE1 active également TRAF2 (TNF receptor-associated factor 2), contribuant de cette façon à l’activation de JNK et de NF-κB. Dans des conditions de stress sévère ou chronique du réticulum, l’activation de JNK ou d’autres gènes, médiée par IRE1α, ainsi que l’induction du facteur transcriptionnel pro-apoptotique CHOP en aval de PERK, activent DP5, Bim et d’autres signaux mitochondriaux déclenchant l’apoptose mitochondriale. Parallèlement, on assiste à une défaillance progressive de l’activation d’ATF6, ce qui a pour conséquence directe de priver la cellule bêta d’une réponse protectrice via la synthèse de la chaperone BIP dépendante d’ATF6. |
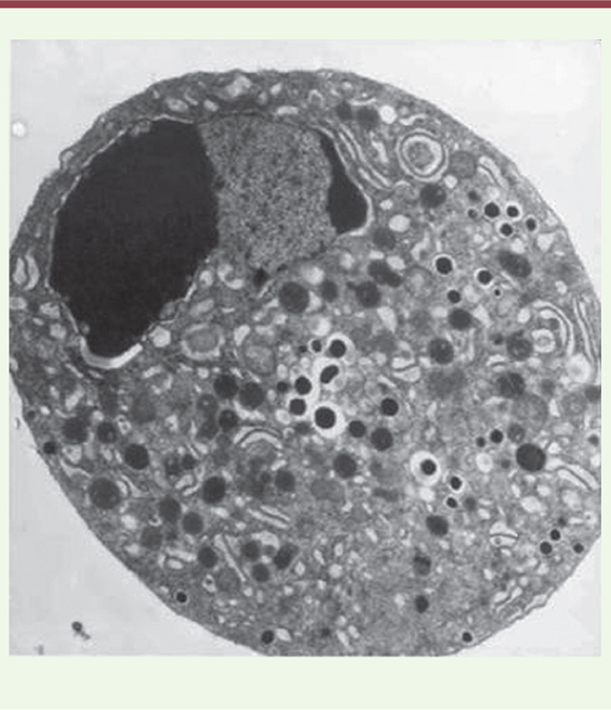
 | Figure 2.
Micrographie électronique d’une cellule bêta en phase d’apoptose précoce après un stress sévère du réticulum endoplasmique. Noter la dilatation du réticulum endoplasmique et la condensation de la chromatine (image fournie par le Dr Miriam Cnop, Laboratoire de médecine expérimentale, Centre de recherche sur le diabète, ULB). |
|
Stress du réticulum endoplasmique et diabète de types 1 et 2 Une réponse UPR excessive ou prolongée, en raison d’une résistance à l’insuline et d’une concentration élevée en acides gras saturés (secondaires à de l’obésité), participe probablement au dysfonctionnement et à la mort des cellules bêta dans le diabète de type 2 (DT2)1, [1,
5,
11]. Il existe cependant un autre aspect de la réponse UPR qui présente un intérêt tout particulier dans le diabète de type 1 (DT1). Il s’agit du dialogue croisé entre l’UPR et l’immunité naturelle. Ce dialogue est à l’origine d’une augmentation des phénomènes inflammatoires locaux, de l’initiation/amplification de l’insulite et de la mort des cellules bêta pancréatiques [
6]. Les composants de ce dialogue sont décrits ci-dessous. Le rôle des cytokines inflammatoires dans l’altération de la réponse UPR L’interleukine-1 bêta (IL-1β) et l’interféron gamma (IFN-γ), deux cytokines pro-inflammatoires produites au cours de l’insulite [
7], ont pour effet d’induire, chez le rat, in vitro, une déplétion en Ca 2+ du réticulum endoplasmique, un stress de ce dernier et l’apoptose des cellules bêta. La raison principale en est l’inhibition de la pompe calcique du réticulum sarco(endo)plasmique SERCA-2b via la synthèse d’oxyde nitrique (NO) [
8]. SERCA-2b a pour fonction de pomper le calcium dans le réticulum endoplasmique, et toute inhibition chimique de cette pompe (par de la thapsigargine ou de l’acide cyclopiazonique CPA) se traduit, comme avec les cytokines, par un épuisement des réserves en Ca 2+ du réticulum endoplasmique, un stress de ce dernier et la mort des cellules bêta. Les médiateurs intervenant dans le stress du réticulum induit par les cytokines dans les cellules bêta pancréatiques, semblent être spécifiques des espèces considérées. Le NO joue un rôle prépondérant dans l’apparition du stress du réticulum endoplasmique dans les cellules bêta de rat, alors que le mécanisme à la base du stress du réticulum induit par les cytokines chez l’homme et la souris est largement indépendant de la production de NO [ 6]. La nature précise de ce(s) mécanisme(s) reste encore largement méconnue, mais il est intéressant de noter que le palmitate induit également une inhibition de SERCA-2b, un stress du réticulum endoplasmique et l’apoptose des cellules bêta, et ce indépendamment de la formation de NO [ 5]. Il semble que dans les cellules bêta, différentes cytokines pro-inflammatoires affectent préférentiellement certaines branches de la réponse UPR. Ainsi, alors que l’IL-1β induit l’épissage alternatif de Xbp1 (Xbp1s) et la phosphorylation de PERK/eIF2α, l’IFN-γ diminue l’expression de Xbp-1s, de BIP et d’autres chaperones du réticulum endoplasmique en aval de ATF6/XBP1s, sensibilisant ainsi les cellules bêta à l’apoptose induite par des agents chimiques de stress ou par l’IL-1β [6]. En lien avec ce qui précède, l’inhibition in vivo de la voie ATF6 accélère le développement d’un diabète dans des souris NOD (non obese diabetic) [4]. Arguments in vivo en faveur d’une réponse UPR Deux récentes études fournissent de solides indications quant à la présence de marqueurs de la réponse UPR in vivo dans des îlots enflammés de DT1. La première, comparant des îlots de souris NOD pré-diabétiques (âgées de 6 à 10 semaines) à ceux de souris contrôles, montre un réticulum endoplasmique anormalement gonflé (caractéristique d’un stress) et une augmentation de l’expression de l’ARNm de BIP, Xbp1s et Chop ( C/EBP homologous protein) [
9]. La seconde étude a utilisé une approche quantitative non biaisée afin d’évaluer la présence de marqueurs de stress du réticulum dans des coupes de pancréas de 13 patients atteints de diabète de type 1 (DT1) versus 15 sujets contrôles. Chez les patients diabétiques, on observe une augmentation de l’expression de CHOP et de BIP dans les îlots présentant une insulite [
10]. Ces résultats laissent à penser que les cellules insulaires enflammées de sujets atteints de DT1 développent une réponse partielle au stress du réticulum. Cette réponse est probablement de type dynamique, comme le suggèrent des études time course sur des souris NOD montrant une augmentation précoce de l’expression d’ATF6 et de XBP-1, suivie par une diminution graduelle de l’expression de ces deux marqueurs de la réponse UPR, ce qui coïncide avec la perte progressive des cellules bêta [ 4]. Il est important de souligner que la restauration du niveau d’expression d’ATF6 par des chaperones chimiques prévient la mort des cellules bêta et le diabète. En effet, l’administration d’acide tauroursodéoxycholique (TUDCA), une chaperone chimique utilisée en pratique clinique pour traiter certaines maladies hépatiques, réduit l’incidence du diabète et améliore la survie et la morphologie des cellules bêta dans deux modèles murins de DT1 [ 4]. |
Conclusions et perspectives De plus en plus d’éléments semblent indiquer que le stress du réticulum, induit par un stress immun (DT1) ou métabolique (DT2), contribue à la perte des cellules bêta, ouvrant la voie à de nouvelles possibilités thérapeutiques. Les bénéfices apportés par des chaperones chimiques, comme le TUDCA, administrées à des modèles murins de DT1 et de DT2 ne font que renforcer cette hypothèse. Néanmoins, ces chaperones ne sont pas spécifiques, ce qui rend indispensable le développement de nouveaux modulateurs spécifiques du stress du réticulum. De plus, il serait intéressant d’observer si des modifications du mode de vie comme une perte de poids associée à des exercices physiques, peuvent ralentir la progression du DT1 chez les jeunes obèses présentant des autoanticorps, via une diminution du stress du réticulum endoplasmique de leurs cellules bêta. Il convient de garder à l’esprit qu’une prévention efficace de la perte des cellules bêta dans le DT1 doit passer par la mise en œuvre d’approches multiples et complémentaires, que les différentes voies de la réponse UPR sont essentielles au bon fonctionnement et à la survie des cellules bêta et que cette réponse, déclenchée par l’inflammation, est très hétérogène. Ainsi, moduler le stress du réticulum endoplasmique dans le but de protéger les cellules bêta devra nécessairement s’accompagner d’une stratégie visant à restaurer une certaine tolérance immunitaire, tout en tenant compte du rapport coût-bénéfice engendré par une intervention sur la réponse UPR dans des cellules hautement sécrétrices comme les cellules bêta. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ces travaux ont été soutenus par des fonds de l’Union européenne (projets BetaBat et Naimit dans le 7e Programme cadre de la communauté européenne), par le Juvenile Diabetes Research Foundation International (JDRFI), le Fonds national de la recherche scientifique (FNRS) et l’Actions de recherche concertées de la communauté française (ARC), Belgique.
|
Footnotes |
1.
Eizirik
DL
,
Cardozo
AK
,
Cnop
M
. The role for endoplasmic reticulum stress in diabetes mellitus . Endocrine reviews.
2008; ; 29 : :42.–61. 2.
Ron
D
,
Harding
HP.
Protein-folding homeostasis in the endoplasmic reticulum and nutritional regulation . Cold Spring Harbor perspectives in biology.
2012 ; :4.. 3.
Gurzov
EN
,
Eizirik
DL
. Bcl-2 proteins in diabetes: mitochondrial pathways of beta-cell death and dysfunction . Trends Cell Biol.
2011; ; 21 : :424.–431. 4.
Engin
F
,
Yermalovich
A
,
Nguyen
T
, et al.
Restoration of the unfolded protein response in pancreatic beta cells protects mice against type 1 diabetes . Sci Transl Med.
2013; ; 5 : :211ra156.. 5.
Cnop
M
,
Foufelle
F
,
Velloso
LA
. Endoplasmic reticulum stress, obesity and diabetes . Trends Mol Med.
2012; ; 18 : :59.–68. 6.
Eizirik
DL
,
Miani
M
,
Cardozo
AK
. Signalling danger: endoplasmic reticulum stress and the unfolded protein response in pancreatic islet inflammation . Diabetologia.
2013; ; 56 : :234.–241. 7.
Eizirik
DL
,
Colli
ML
,
Ortis
F
. The role of inflammation in insulitis and beta-cell loss in type 1 diabetes . Nat Rev Endocrinol.
2009; ; 5 : :219.–226. 8.
Cardozo
AK
,
Ortis
F
,
Storling
J
, et al.
Cytokines downregulate the sarcoendoplasmic reticulum pump Ca2+ ATPase 2b and deplete endoplasmic reticulum Ca2+, leading to induction of endoplasmic reticulum stress in pancreatic beta-cells . Diabetes.
2005; ; 54 : :452.–461. 9.
Tersey
SA
,
Nishiki
Y
,
Templin
AT
, et al.
Islet beta-cell endoplasmic reticulum stress precedes the onset of type 1 diabetes in the nonobese diabetic mouse model . Diabetes.
2012; ; 61 : :818.–827. 10.
Marhfour
I
,
Lopez
XM
,
Lefkaditis
D
, et al.
Expression of endoplasmic reticulum stress markers in the islets of patients with type 1 diabetes . Diabetologia.
2012; ; 55 : :2417.–2420. 11.
Flamment
M
,
Foufelle
F
. Le stress du réticulum endoplasmique : de la physiologie à la pathogenèse du diabète de type 2 . Med Sci (Paris).
2013; ; 29 : :756.–764. |