 |
| |||
Med Sci (Paris). 2014 May; 30(5): 519–525. Published online 2014 June 13. doi: 10.1051/medsci/20143005014.Nouveaux rôles physiopathologiques pour le récepteur PLA2R1 dans le cancer et la glomérulonéphrite extramembraneuse 1Institut de pharmacologie moléculaire et cellulaire, CNRS et université de Nice-Sophia Antipolis UMR 7275, 660 route des lucioles, Sophia Antipolis, 06560Valbonne, France 2Service de néphrologie, CHU hôpital Pasteur, université de Nice-Sophia Antipolis, Nice, France 3Inserm U1052, centre de recherche en cancérologie de Lyon, CNRS et université de Lyon, UMR 5286, centre Léon Bérard, 69373Lyon, France Corresponding author. | ||||||
| ||||||
PLA2R1 (phospholipase A2 receptor 1) est une glycoprotéine transmembranaire de 180-kDa appartenant à la superfamille des lectines de type C (Figure 1) [ 1]. Il présente une structure complexe composée de 10 domaines extracellulaires (représentant 95 % de la protéine), d’un seul segment transmembranaire et d’une courte queue cytoplasmique d’une quarantaine d’acides aminés contenant un motif consensus d’endocytose NPXY [ 2, 3]. Depuis son extrémité amino-terminale extracellulaire, on distingue une région riche en cystéine (CysR), un domaine fibronectine de type II (FNII) et huit domaines lectine de type C distincts (CTLD). Trois autres récepteurs ont la même structure et forment un sous-groupe au sein de la superfamille des lectines de type C : le récepteur mannose du macrophage (MRC1), le récepteur Endo-180 (MRC2) et le récepteur des cellules dendritiques (DEC-205, LY75) (pour revue voir [ 4]). Les séquences en acides aminés de ces quatre récepteurs présentent cependant moins de 30 % d’identité, suggérant des fonctions distinctes. Par ailleurs, PLA2R1 existe sous deux formes, transmembranaire et soluble [2]. La forme soluble est clivée après le CTLD8, et est dépourvue de segment transmembranaire et de domaine cytoplasmique. Elle peut être générée par épissage alternatif ou par protéolyse de la forme membranaire [2, 5]. Chez l’homme, PLA2R1 est constitutivement exprimé dans le rein, le poumon, la rate et le côlon, et dans certaines cellules fibroblastiques, épithéliales et immunitaires. Cette distribution tissulaire varie cependant d’une espèce à l’autre.
| ||||||
Notre équipe a découvert PLA2R1 (initialement appelé récepteur de type M) en 1990 à l’aide d’une phospholipase A2 sécrétée (sPLA2) de venin de serpent (donc exogène) appelée OS2 [ 6]. Cette dernière se lie à PLA2R1 avec une très haute affinité de 7 pM. On ne connaissait en 1990 que deux sPLA2 de mammifère, IB et IIA, et la question se posait alors de savoir si ces sPLA2 pouvaient être les ligands naturels endogènes de PLA2R1. Suite à une série de résultats en apparence confus car obtenus avec des sPLA2 et du PLA2R1 issus de différentes espèces de mammifères, une première réponse claire a été apportée en 1999, au moins chez la souris, pour ces deux sPLA2 [ 7]. Dans cette espèce, les sPLA2 IB et IIA se lient à PLA2R1 avec une haute affinité de l’ordre du nM. Cependant, les résultats apparaissaient différents chez le rat et l’homme, suggérant des propriétés de liaison de PLA2R1 dépendantes de l’espèce [7]. On sait maintenant qu’il existe une douzaine de sPLA2 humaines ou de souris (IB, IIA, IIC, IID, IIE, IIF, III, V, X, XIIA, XIIB et otoconin-95) [ 8, 9]. À nouveau chez la souris, nous avons montré que sept de ces 12 sPLA2 se lient à PLA2R1, ce qui renforce l’idée que ces dernières sont bien des ligands naturels de PLA2R1 [ 10]. Les propriétés de liaison des sPLA2 sur PLA2R1 restent cependant à caractériser finement dans les autres espèces de mammifères, notamment chez l’homme. On sait aussi que PLA2R1, au moins dans certaines espèces, peut lier du collagène et certains sucres, suggérant que PLA2R1 pourrait avoir d’autres types de ligands endogènes, associés à différentes fonctions de type adhésion ou lectine (Figure 1) [10, 11]. Enfin, les expériences de mutagenèse dirigée ont montré que le domaine fibronectine de type II lie le collagène de type IV [11], tandis que les domaines CTLD4-6 lient les sPLA2 et certains sucres, comme le mannose ou le glucose [ 12]. La liaison des sPLA2 sur les domaines CTLD4-6 de PLA2R1 se fait cependant par interaction protéine-protéine [10]. L’interaction sPLA2-PLA2R1 pourrait avoir des rôles opposés (Figure 1). Les sPLA2 sont de petites enzymes très stables de 13- à 18-kDa qui hydrolysent les phospholipides pour libérer des acides gras et des lysophospholipides, deux précurseurs de la synthèse de nombreux médiateurs lipidiques [8, 9, 41] (→). Cette propriété est à la base d’un grand nombre de leurs fonctions biologiques [8, 9]. La liaison sPLA2-PLA2R1 pourrait donc être un moyen efficace de stopper leur activité biologique, en inhibant leur activité enzymatique et en favorisant leur élimination du milieu extracellulaire. En effet, in vitro, la liaison des sPLA2 au récepteur PLA2R1 soluble entraîne une inhibition de leur activité enzymatique, et leur liaison au récepteur membranaire conduit non seulement à leur inhibition, mais aussi à leur internalisation et leur dégradation dans les lysosomes [2, 3, 10]. Inversement, PLA2R1 pourrait relayer la transduction de certaines fonctions biologiques des sPLA2 en activant diverses voies de signalisation intracellulaire [ 13] ou, peut-être même, en les adressant dans des compartiments intracellulaires, comme le noyau [ 14]. Mais, la démonstration formelle du rôle de PLA2R1 dans ces deux derniers cas reste à apporter. (→) Voir la synthèse de H. Ait-Oufella et al., page 526 de ce numéro | ||||||
Rôles opposés de PLA2R1 dans l’inflammation Plusieurs sPLA2 (IIA, V et X) et le récepteur PLA2R1 sont exprimés dans les poumons [9]. Les sPLA2 IIA et X sont présentes dans les lavages broncho-alvéolaires de patients souffrant d’asthme. Henderson et al. ont mis en évidence un rôle clé de la sPLA2-X dans un modèle d’asthme chez la souris [
15]. Dans ce modèle induit par administration intranasale d’ovalbumine, les souris invalidées pour la sPLA2-X produisent moins d’icosanoïdes pro-inflammatoires et ont moins d’asthme. In vitro, la liaison des sPLA2 à PLA2R1 entraîne leur internalisation et leur dégradation dans la voie lysosomale [3, 13]. Ces observations ont conduit Tamaru et al. à étudier le rôle de PLA2R1 dans l’asthme [
16]. Dans le même modèle que celui utilisé par Henderson et al., ils ont observé que les souris invalidées pour PLA2R1 (souris Pla2r1-/-
) présentent une réponse inflammatoire plus intense que les souris sauvages, caractérisée par une infiltration plus importante de cellules inflammatoires dans les voies respiratoires. Les lavages broncho-alvéolaires des souris Pla2r1-/-
contenaient davantage de sPLA2 IB et X, et des concentrations plus élevées de plusieurs icosanoïdes et de cytokines Th2. Par administration intratrachéale de sPLA2 radiomarquée, ces auteurs ont pu mettre en évidence que ces taux plus élevés de sPLA2 résultaient d’une clairance et d’une dégradation réduites de ces sPLA2 [16]. Au niveau pulmonaire, PLA2R1 pourrait donc jouer un rôle protecteur dans la pathogenèse de l’asthme en inhibant l’activité des sPLA2 et en les éliminant du milieu extracellulaire.Contrairement à son rôle anti-inflammatoire au niveau pulmonaire, il semblerait que PLA2R1 joue un rôle pro-inflammatoire dans le choc septique [ 17]. L’administration de lipopolysacharide (LPS, un composant de la membrane des bactéries Gram-négatives) chez des souris sauvages induit un choc septique qui provoque la mort des animaux en 24 heures. Chez ces souris, d’importantes quantités de TNFα (tumor necrosis factor α) sont produites dans les poumons, la rate, le rein et l’utérus, des tissus qui expriment la sPLA2 IB. L’expression de PLA2R1 est également augmentée dans les cellules épithéliales des alvéoles pulmonaires et dans les lymphocytes spléniques des souris sauvages exposées au LPS [ 18]. In vitro, l’application de sPLA2 IB sur des cellules de parenchyme pulmonaire ou des cellules endothéliales vasculaires provoque la sécrétion d’icosanoïdes. Lorsqu’ils sont appliqués sur des macrophages exposés à une endotoxine, ces dérivés lipidiques stimulent la production de cytokines pro-inflammatoires, telles que le TNFα et l’IL-1β (interleukine-1β). Ces observations ont conduit Hanasaki et al. à étudier le rôle du complexe sPLA2 IB/PLA2R1 dans la pathogenèse du choc septique. Ils ont montré que, comme le LPS, la sPLA2 IB induit un choc septique lorsqu’elle est administrée à des souris préalablement sensibilisées avec des doses sub-léthales de LPS. En revanche, les souris Pla2r1 -/- sont plus résistantes que les souris sauvages au choc septique, induit aussi bien par le LPS que par la sPLA2 IB [17]. De plus, chez ces souris, les concentrations plasmatiques de TNFα et d’IL-1β induites par le LPS sont sensiblement réduites. L’ensemble de ces résultats suggèrent que dans ce modèle inflammatoire, PLA2R1 pourrait cette fois relayer la transduction de certains effets des sPLA2 et participer, notamment via la production de cytokines pro-inflammatoires, à la progression du choc septique. Rôles de PLA2R1 dans le cancer L’équipe de David Bernard, en collaboration avec notre équipe, a été la première à suggérer un rôle antitumoral de PLA2R1, lors d’un criblage génétique fonctionnel destiné à identifier des gènes contrôlant la sénescence cellulaire [
19]. La sénescence est un arrêt irréversible de la prolifération cellulaire. Elle constitue, au même titre que l’apoptose, un puissant mécanisme antitumoral [
20,
42,
43]. Plusieurs mécanismes provoquent l’entrée en sénescence : l’épuisement du pouvoir réplicatif des cellules (on parle alors de sénescence réplicative), et l’exposition à un stress oncogénique (on parle alors d’oncogene-induced senescence ou OIS). Le rôle crucial de PLA2R1 dans la sénescence réplicative a d’abord été mis en évidence in vitro, dans des cultures primaires de fibroblastes pulmonaires humains (WI38) et dans des cellules épithéliales mammaires (HMEC) [19]. Lorsque ces cellules entrent en sénescence, elles expriment davantage de PLA2R1 (Figure 2). La diminution d’expression de PLA2R1 par ARN interférence retarde l’entrée en sénescence, tandis que la surexpression de PLA2R1 l’induit de façon prématurée [19]. L’effet pro-sénescent de PLA2R1 dépend de la production de radicaux oxygénés (reactive oxygen species, ROS), de l’induction de dommages à l’ADN et de l’activation du gène suppresseur de tumeurs p53 [19]. Les sPLA2 IB et IIA contrôlent également la sénescence cellulaire [19,
21, 42, 43]. Néanmoins, la contribution de PLA2R1 dans leurs effets n’est pas clairement établie [19].
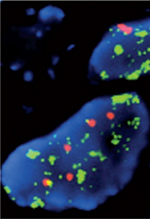
PLA2R1 joue également un rôle clé dans l’OIS. En effet, in vitro, la déplétion de PLA2R1 permet l’échappement à l’OIS, ainsi que la transformation de kératinocytes et des HMEC exposés à l’oncogène RasV12G [ 22]. In vivo, cela se traduit par l’apparition plus rapide et en plus grand nombre de papillomes chez les souris Pla2r1 -/- dans un modèle de tumorigenèse cutanée induite chimiquement [22]. L’analyse de la base de données Oncomine (https://www.oncomine.org) révèle que l’expression de PLA2R1 diminue dans plusieurs cancers (sein, rein, côlon, tête, cou, etc.) [22]. Chez certains patients atteints de leucémie, et dans des lignées tumorales lymphocytaires (Jurkat, U937) et mammaires (MDAMB-453, Cama1, BT20), cette perte d’expression semble être la conséquence d’un contrôle épigénétique via une hyperméthylation du promoteur [ 23]. Lorsque PLA2R1 est réintroduit par une approche virale dans des lignées tumorales mammaires, il induit leur apoptose [ 24]. Cette réponse pro-apoptotique, plutôt que pro-sénescente, pourrait résulter de l’altération fréquente dans ces cellules des voies p16/Rb et p53, qui participent à l’effet pro-sénescent de PLA2R1 dans les cellules normales. L’effet pro-apoptotique de PLA2R1 ne semble dépendre ni de son domaine cytosolique, ni du domaine de liaison des sPLA2. L’utilisation d’inhibiteurs pharmacologiques suggère que l’effet de PLA2R1 ne dépend pas non plus de la production de médiateurs lipidiques [22, 24]. En revanche, il impliquerait l’activation d’une voie de signalisation dépendante de JAK2 (Janus kinase 2) et la production de ROS d’origine mitochondriale [22, 24]. L’action de PLA2R1 pourrait ainsi être déterminante à plusieurs étapes clés du processus tumoral. Dans les cellules normales, PLA2R1 pourrait empêcher la formation de tumeurs en participant à leur entrée en sénescence, à la suite d'un stress oncogénique. Dans les cellules cancéreuses, sa réexpression pourrait freiner la progression tumorale en favorisant leur apoptose. Les travaux de Judith Campisi ont montré que la sénescence cellulaire produit un environnement pro-inflammatoire riche en cytokines [ 25, 43]. Il serait donc tentant de rapprocher les effets de PLA2R1 décrits ci-dessus sur l’inflammation et la production de cytokines de son rôle pro-sénescent. Cependant, nous n’avons à ce jour aucune donnée suggérant une contribution claire des cytokines dans la réponse de type sénescence induite par PLA2R1. Rôle de PLA2R1 dans la glomérulonéphrite extra-membraneuse idiopathique La glomérulonéphrite extra-membraneuse (GEM) est la première cause de syndrome néphrotique chez l’adulte [
26,
27]. On distingue la GEM primitive ou idiopathique (80 % des cas), dont l’origine est indéterminée, de la GEM secondaire (20 % des cas), qui est associée à une pathologie extra-rénale (lupus, cancers, infections, expositions à certains médicaments). La GEM idiopathique est une maladie auto-immune dont l’évolution clinique est variable. Certains patients entrent en rémission spontanée, tandis que d’autres progressent vers une insuffisance rénale terminale, nécessitant le recours à la dialyse ou à la greffe de rein. Le diagnostic de GEM idiopathique repose exclusivement sur l’analyse histologique d’une biopsie rénale. La GEM se caractérise par la présence de dépôts auto-immuns au niveau de la membrane basale glomérulaire (MBG). Ces dépôts, généralement composés d’immunoglobulines de type IgG4 et de protéines du complément, sont associés à une perte de sélectivité de la barrière glomérulaire, ce qui conduit au passage anormal de protéines sanguines dans les urines, expliquant la protéinurie de rang néphrotique retrouvée chez les patients atteints de GEM (Figure 3).
L’identification des cibles moléculaires des auto-anticorps a fait l’objet d’intenses recherches. En 1959, Heymann fut le premier à développer un modèle de GEM chez le rat et à montrer que l’antigène principal était dans ce cas la mégaline, une protéine exprimée à la surface des podocytes, les cellules épithéliales essentielles à la filtration glomérulaire [26, 28]. La mégaline étant absente du podocyte humain, ces découvertes n’étaient cependant pas transposables à l’homme. Il fallut attendre 2002 pour que l’équipe de Pierre Ronco identifie chez l’homme l’endopeptidase neutre (NEP) comme un premier antigène de la GEM [ 29, 44]. Cependant, cet antigène est impliqué dans une forme rare de GEM néonatale de type allo-immune, mais pas dans les GEM idiopathiques de l’adulte. C’est enfin en 2009 que l’équipe de David Salant, en collaboration avec notre équipe, a mis en évidence qu’environ 70 % des patients atteints de GEM idiopathique avaient des auto-anticorps circulants de type IgG4 dirigés contre PLA2R1 [ 30]. Les anticorps anti-PLA2R1 sont absents chez les patients souffrant de GEM secondaires ou d’autres néphropathies glomérulaires. Ces anticorps reconnaissent des épitopes conformationnels de PLA2R1, et sont insensibles à son état de glycosylation. En accord avec l’hypothèse émise 50 ans plus tôt par Heymann, PLA2R1 est bien exprimé à la surface des podocytes chez le sujet sain (Figure 3). Chez les patients, son expression serait augmentée, et il est colocalisé avec les IgG4 qui forment les dépôts auto-immuns [30, 31]. Ces résultats suggèrent que les dépôts immuns observés in situ au niveau de la MBG des patients atteints de GEM idiopathique résultent de la reconnaissance par les auto-anticorps anti-PLA2R1 circulants de l’antigène PLA2R1 exprimé à la surface des podocytes. Cette reconnaissance pourrait déclencher l’activation du complément ou d’autres mécanismes cytotoxiques, conduisant au dysfonctionnement des podocytes et au syndrome néphrotique. Plusieurs études indiquent aujourd’hui que le titre des anticorps anti-PLA2R1 est corrélé à l’activité de la maladie (Figure 3) et serait prédictif de la sévérité du pronostic [ 32, 33]. Ainsi, il diminue sensiblement chez les patients en rémission spontanée ou induite par un traitement, et augmente lors de rechutes [32, 34]. De plus, les taux des anticorps anti-PLA2R1 circulants varient plus rapidement après un traitement immunosuppresseur que la protéinurie des patients, permettant de prédire la réponse au traitement et d’anticiper la rechute [34]. Ces observations pourraient s’avérer particulièrement intéressantes pour prédire les récidives de GEM chez les patients transplantés [ 35], bien que l’apport du suivi des anticorps anti-PLA2R1 reste encore discuté [31, 36, 37]. Enfin, certains polymorphismes des gènes PLA2R1 et HLA-DQA1 confèrent un risque accru de développement d’une GEM idiopathique [ 38]. Ces découvertes ont déjà permis de développer de nouveaux tests diagnostiques non invasifs permettant une meilleure prise en charge des malades [ 39, 40]. De plus, elles devraient contribuer à une meilleure classification des GEM et à une meilleure stratification des patients à risque. Enfin, elles pourraient ouvrir la voie vers des traitements plus spécifiques de la maladie, ciblant PLA2R1, les auto-anticorps et/ou leurs voies d’activation. | ||||||
PLA2R1 apparaît donc aujourd’hui comme un récepteur multifonctionnel capable d’exercer plusieurs fonctions dans l’inflammation, le cancer et la GEM, une maladie auto-immune. Par ses différents domaines extracellulaires, il serait capable de lier différents types de ligands, comme les sPLA2, le collagène et certains sucres, mais l’importance relative de ces ligands dans ses effets biologiques reste à préciser. Il semble aussi que ses fonctions et ses propriétés de liaison dépendent de l’espèce, et ne sont pas systématiquement conservées de la souris à l’homme et vice versa. Ainsi, chez la souris, PLA2R1 jouerait un rôle dans l’inflammation qui semble associé à la liaison des sPLA2, mais une telle fonction, ainsi que la contribution des sPLA2, restent à valider chez l’homme. Inversement, son effet antitumoral et son rôle dans la GEM idiopathique ont d’abord été mis en évidence chez l’homme. Un rôle équivalent chez la souris, notamment dans le cas de la GEM, et la contribution des sPLA2 ou des autres ligands de PLA2R1 dans ces effets, restent à démontrer. Nos travaux futurs devront prendre en compte cet état des lieux. Par exemple, au niveau fonctionnel, la mise en place d’un modèle animal de la GEM pourrait s’avérer délicate chez la souris puisque PLA2R1 est fortement exprimé dans le rein humain au sein des podocytes, mais pas dans le rein de souris, de rat ou de lapin, ce qui suggère une fonction rénale de PLA2R1 spécifique à l’homme. L’étude du rôle antitumoral de PLA2R1 chez la souris pourrait aussi être rendue difficile par les différences de liaison et d’expression observées entre les récepteurs dans les deux espèces. Il s’agira aussi de savoir dans quel contexte les patients atteints de GEM génèrent des auto-anticorps contre PLA2R1, et s’il existe un lien entre la fonction antitumorale de PLA2R1 et son dysfonctionnement dans les podocytes, après liaison des auto-anticorps de patients. Au niveau moléculaire, les travaux à venir auront pour but d’identifier les ligands endogènes du récepteur PLA2R1, notamment chez l’homme, et aussi d’identifier les partenaires moléculaires directs de PLA2R1, chez l’homme et la souris, lesquels pourraient être différents. Enfin, les propriétés de liaison et les effets en apparence complexes de PLA2R1 sont à mettre en regard de ce que l’on sait, ou plutôt de ce que l’on ne sait pas, pour ses paralogues MRC1 (mannose receptor, C type 1), MRC2 et LY75 (lymphocyte antigen 75). Leurs fonctions et leurs ligands sont, là aussi, loin d’être compris, aussi bien chez la souris que l’homme. Nonobstant cette complexité apparente et la place des sPLA2, premiers ligands de PLA2R1, ce dernier apparaît maintenant sous un jour nouveau, comme un acteur clé de la GEM idiopathique, cible directe d’auto-anticorps, et peut-être comme un nouveau gène antitumoral, ouvrant de nouvelles perspectives diagnostiques et thérapeutiques en santé publique. C’est déjà le cas pour la GEM, puisque le dosage des auto-anticorps améliore significativement la prise en charge des patients, et permet de mieux identifier leur maladie et de leur prescrire un traitement plus efficace. | ||||||
Les auteurs déclarent n’avoir aucun lien d’interêt concernant les données publiées dans cet article. | ||||||
Nous tenons à remercier la fondation ARC pour la recherche sur le cancer, l’association pour la recherche internationale sur le cancer (AICR), et le ministère des Affaires sociales et de la santé (PHRC PRAM-KT) pour leur soutien financier. Nous remercions aussi le Dr. Damien Ambrosetti (service d’anatomopathologie du CHU de Nice) pour la figure d’immunomarquage de PLA2R1 dans le glomérule rénal humain et Nadège Parassol-Girard pour ses commentaires. Ce travail a bénéficié d’une aide de l’Agence nationale de la recherche au titre du programme Labex SIGNALIFE « investissements d’avenir » portant la référence ANR-11-LABX-0028-01. | ||||||
1.
Lambeau
G
,
Lazdunski
M
. Receptors for a growing family of secreted phospholipases A2 . Trends Pharmacol Sci.
1999; ; 20 : :162.–170. 2.
Ancian
P
,
Lambeau
G
,
Mattéi
MG
,
Lazdunski
M
. The human 180-kDa receptor for secretory phospholipases A2. Molecular cloning, identification of a secreted soluble form, expression, and chromosomal localization . J Biol Chem.
1995; ; 270 : :8963.–8970. 3.
Zvaritch
E
,
Lambeau
G
,
Lazdunski
M
. Endocytic properties of the M-type 180-kDa receptor for secretory phospholipases A2 . J Biol Chem.
1996; ; 271 : :250.–257. 4.
East
L
,
Isacke
CM
. The mannose receptor family . Biochim Biophys Acta.
2002; ; 1572 : :364.–386. 5.
Higashino
K
,
Yokota
Y
,
Ono
T
, et al.
Identification of a soluble form phospholipase A2 receptor as a circulating endogenous inhibitor for secretory phospholipase A2 . J Biol Chem.
2002; ; 277 : :13583.–13588. 6.
Lambeau
G
,
Schmid-Alliana
A
,
Lazdunski
M
,
Barhanin
J
. Identification and purification of a very high affinity binding protein for toxic phospholipases A2 in skeletal muscle . J Biol Chem.
1990; ; 265 : :9526.–9532. 7.
Cupillard
L
,
Mulherkar
R
,
Gomez
N
, et al.
Both group IB and group IIA secreted phospholipases A2 are natural ligands of the mouse 180-kDa M-type receptor . J Biol Chem.
1999; ; 274 : :7043.–7051. 8.
Lambeau
G
,
Gelb
MH
. Biochemistry and physiology of mammalian secreted phospholipases A2 . Annu Rev Biochem.
2008; ; 77 : :495.–520. 9.
Murakami
M
,
Taketomi
Y
,
Girard
C
, et al.
Emerging roles of secreted phospholipase A2 enzymes: Lessons from transgenic and knockout mice . Biochimie.
2010; ; 92 : :561.–582. 10.
Rouault
M
,
Le Calvez
C
,
Boilard
E
, et al.
Recombinant production and properties of binding of the full set of mouse secreted phospholipases A2 to the mouse M-type receptor . Biochemistry.
2007; ; 46 : :1647.–1662. 11.
Ancian
P
,
Lambeau
G
,
Lazdunski
M
. Multifunctional activity of the extracellular domain of the M-type (180 kDa) membrane receptor for secretory phospholipases A2 . Biochemistry.
1995; ; 34 : :13146.–13151. 12.
Nicolas
J-P
,
Lambeau
G
,
Lazdunski
M
. Identification of the binding domain for secretory phospholipases A2 on their M-type 180 kDa membrane receptor . J Biol Chem.
1995; ; 270 : :28869.–28873. 13.
Hanasaki
K
,
Arita
H
. Phospholipase A2 receptor: a regulator of biological functions of secretory phospholipase A2 . Prostaglandins Other Lipid Mediat.
2002; ; 68–69 : :71.–82. 14.
Fayard
JM
,
Tessier
C
,
Pageaux
JF
, et al.
Nuclear location of PLA2-I in proliferative cells . J Cell Sci.
1998; ; 111 : :985.–994. 15.
Henderson
WR, Jr
,
Chi
EY
,
Bollinger
JG
, et al.
Importance of group X-secreted phospholipase A2 in allergen-induced airway inflammation and remodeling in a mouse asthma model . J Exp Med.
2007; ; 204 : :865.–877. 16.
Tamaru
S
,
Mishina
H
,
Watanabe
Y
, et al.
Deficiency of phospholipase A2 receptor exacerbates ovalbumin-induced lung inflammation . J Immunol.
2013; ; 191 : :1021.–1028. 17.
Hanasaki
K
,
Yokota
Y
,
Ishizaki
J
, et al.
Resistance to endotoxic shock in phospholipase A2 receptor-deficient mice . J Biol Chem.
1997; ; 272 : :32792.–32797. 18.
Yokota
Y
,
Ikeda
M
,
Higashino
K
, et al.
Enhanced tissue expression and elevated circulating level of phospholipase A(2) receptor during murine endotoxic shock . Arch Biochem Biophys.
2000; ; 379 : :7.–17. 19.
Augert
A
,
Payré
C
,
de Launoit
Y
, et al.
The M-type receptor PLA2R regulates senescence through the p53 pathway . EMBO Rep.
2009; ; 10 : :271.–277. 20.
Collado
M
,
Serrano
M
. Senescence in tumours: evidence from mice and humans . Nat Rev Cancer.
2010; ; 10 : :51.–57. 21.
Kim
HJ
,
Kim
KS
,
Kim
SH
, et al.
Induction of cellular senescence by secretory phospholipase A2 in human dermal fibroblasts through an ROS-mediated p53 pathway . J Gerontol A Biol Sci Med Sci.
2009; ; 64 : :351.–362. 22.
Vindrieux
D
,
Augert
A
,
Girard
CA
, et al.
PLA2R1 mediates tumor suppression by activating JAK2 . Cancer Res.
2013; ; 73 : :6334.–6345. 23.
Menschikowski
M
,
Platzbecker
U
,
Hagelgans
A
, et al.
Aberrant methylation of the M-type phospholipase A2 receptor gene in leukemic cells . BMC Cancer.
2012; ; 12 : :576.. 24.
Augert
A
,
Vindrieux
D
,
Girard
CA
, et al.
PLA2R1 kills cancer cells by inducing mitochondrial stress . Free Radic Biol Med.
2013; ; 65C : :969.–977. 26.
Ronco
P
,
Debiec
H
. Pathogenesis of membranous nephropathy: recent advances and future challenges . Nat Rev Nephrol.
2012; ; 8 : :203.–213. 27.
Ponticelli
C
,
Glassock
RJ
. Glomerular diseases: membranous nephropathy - A modern view . Clin J Am Soc Nephrol.
2013 ; DOI. : 10.2215/CJN.04160413. 28.
Heymann
W
,
Hackel
DB
,
Harwood
S
, et al.
Production of nephrotic syndrome in rats by Freund’s adjuvants and rat kidney suspensions . Proc Soc Exp Biol Med.
1959; ; 100 : :660.–664. 29.
Debiec
H
,
Guigonis
V
,
Mougenot
B
, et al.
Antenatal membranous glomerulonephritis due to anti-neutral endopeptidase antibodies . N Engl J Med.
2002; ; 346 : :2053.–2060. 30.
Beck
LH, Jr.
,
Bonegio
RG
,
Lambeau
G
, et al.
M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy . N Engl J Med.
2009; ; 361 : :11.–21. 31.
Debiec
H
,
Ronco
P
. PLA2R autoantibodies and PLA2R glomerular deposits in membranous nephropathy . N Engl J Med.
2011; ; 364 : :689.–690. 32.
Hofstra
JM
,
Beck
LH, Jr.
,
Beck
DM
, et al.
Anti-phospholipase A2 receptor antibodies correlate with clinical status in idiopathic membranous nephropathy . Clin J Am Soc Nephrol.
2011; ; 6 : :1286.–1291. 33.
Kanigicherla
D
,
Gummadova
J
,
McKenzie
EA
, et al.
Anti-PLA2R antibodies measured by ELISA predict long-term outcome in a prevalent population of patients with idiopathic membranous nephropathy . Kidney Int.
2013; ; 83 : :940.–948. 34.
Beck
LH, Jr
,
Fervenza
FC
,
Beck
DM
, et al.
Rituximab-induced depletion of anti-PLA2R autoantibodies predicts response in membranous nephropathy . J Am Soc Nephrol.
2011; ; 22 : :1543.–1550. 35.
Rodriguez
EF
,
Cosio
FG
,
Nasr
SH
, et al.
The pathology and clinical features of early recurrent membranous glomerulonephritis . Am J Transplant.
2012; ; 12 : :1029.–1038. 36.
Stahl
R
,
Hoxha
E
,
Fechner
K
. PLA2R autoantibodies and recurrent membranous nephropathy after transplantation . N Engl J Med.
2010; ; 363 : :496.–498. 37.
Debiec
H
,
Martin
L
,
Jouanneau
C
, et al.
Autoantibodies specific for the phospholipase A2 receptor in recurrent and de novo membranous nephropathy . Am J Transplant.
2011; ; 11 : :2144.–2152. 38.
Stanescu
HC
,
Arcos-Burgos
M
,
Medlar
A
, et al.
Risk HLA-DQA1 and PLA2R1 alleles in idiopathic membranous nephropathy . N Engl J Med.
2011; ; 364 : :616.–626. 39.
Hofstra
JM
,
Debiec
H
,
Short
CD
, et al.
Antiphospholipase A2 receptor antibody titer and subclass in idiopathic membranous nephropathy . J Am Soc Nephrol.
2012; ; 23 : :1735.–1743. 40.
Dahnrich
C
,
Komorowski
L
,
Probst
C
, et al.
Development of a standardized ELISA for the determination of autoantibodies against human M-type phospholipase A2 receptor in primary membranous nephropathy . Clin Chim Acta.
2013; ; 421C : :213.–218. 41.
Ait-Oufella
H
,
Mallat
Z
,
Tedgui
A
. Lp-PLA2 et sPLA2 : biomarqueurs cardiovasculaires . Med Sci (Paris).
2014; ; 30 : :526.–531. 42.
Bischof
O
,
Dejean
A
,
Pineau
P
. Une re-vue de la sénescence cellulaire . Med Sci (Paris).
2009; ; 25 : :153.–160. | ||||||