| |
| Med Sci (Paris). 2014 June; 30(6-7): 616–618. Published online 2014 July 11. doi: 10.1051/medsci/20143006006.TTC7A, un acteur essentiel de l’homéostasie de l’intestin et du système immunitaire Roxane Lemoine,1,2 Amélie Bigorgne,1,2 Henner Farin,3 and Geneviève de Saint Basile1,2* 1Inserm, unité U1163, laboratoire homéostasie normale et pathologique du système immunitaire, hôpital Necker Enfants-malades, Paris, France 2Université Paris Descartes-Sorbonne Paris Cité, Institut Imagine, 24, boulevard du Montparnasse, 75015Paris, France 3Hubrecht Institute for Developmental Biology and Stem Cell Research and University Medical Centre Utrecht, Uppsalalaan 8, 3584CTUtrecht, Pays-Bas MeSH keywords: Polarité de la cellule, génétique, Entérocytes, physiologie, Homéostasie, Humains, Système immunitaire, Atrésie intestinale, complications, immunologie, Intestins, Protéines, Immunodéficience combinée grave, Protéine G RhoA |
Les cellules épithéliales constituent des barrières (épithéliums) qui séparent les milieux intérieur et extérieur. Ce sont des cellules polarisées présentant une orientation fonctionnelle et morphologique préférentielle. Les cellules épithéliales de l’intestin sont connues pour être hautement polarisées avec un pôle apical bien différencié qui assure une activité d’échange avec la lumière intestinale, et un pôle baso-latéral interagissant avec les cellules avoisinantes et avec la matrice extracellulaire sous-jacente. Des interactions spécifiques ont lieu par l’intermédiaire de protéines transmembranaires, principalement l’E-cadhérine et les intégrines, reliées aux constituants du cytosquelette intracellulaire. L’établissement et le maintien de la fonction des tissus épithéliaux multicellulaires nécessitent que chaque cellule soit correctement orientée, polarisée et interconnectée. C’est en particulier ce qui détermine la formation de la lumière intestinale [
1]. |
L’atrésie intestinale multiple associée à un déficit immunitaire combiné sévère L’atrésie intestinale multiple (MIA) est une maladie congénitale grave, caractérisée par une obstruction de la lumière de l’intestin qui présente des rétrécissements étagés pouvant s’étendre de l’estomac au rectum [
2]. L’atrésie est déjà détectable en période anténatale par échographie. L’atrésie intestinale multiple peut être associée à un déficit immunitaire combiné sévère, caractérisé par une lymphopénie T et B et une hypogammaglobulinémie (MIA-CID)[
3]. Les patients atteints de MIA-CID présentent une susceptibilité accrue aux infections, en particulier aux germes opportunistes. Cette pathologie nécessite une intervention chirurgicale rapide pour réséquer les parties atrophiées et établir une dérivation. La mise sous nutrition parentérale, une substitution par des immunoglobulines et une antibioprophylaxie adaptée ne changent pas le pronostic très sombre de cette affection. Depuis longtemps, une des questions soulevées était de savoir si une même anomalie pouvait directement perturber le développement et/ou la fonction des cellules de l’intestin et du système immunitaire, ou si l’atrésie intestinale était la conséquence d’une attaque précoce de l’intestin par un système immunitaire défectueux. Très récemment, la protéine tetratricopeptide repeat domain-7A (TTC7A) a été montrée responsable de cette affection [
4–
7]. TTC7A est exprimée de façon ubiquitaire, et sa fonction n’est pas connue. Nous nous sommes attachés à essayer de comprendre par quel(s) mécanisme(s) un déficit en TTC7A pouvait rendre compte de la pathologie observée. |
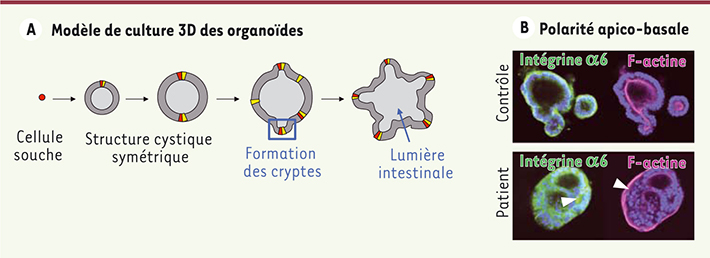
TTC7A est nécessaire à la polarité apico-basale des cellules épithéliales L’étude histologique des biopsies issues du tractus gastrointestinal des patients a révélé une architecture de l’épithélium très perturbée [4]. Les cellules épithéliales forment des amas cellulaires répartis en multicouches désorganisées, associés à des images d’apoptose et à une destruction partielle ou totale des glandes. Les villosités sont rares voire absentes, et un infiltrat inflammatoire constitué de polynucléaires éosinophiles et de macrophages est présent. L’établissement d’un modèle de culture 3D d’organoïdes (mini-intestins) à partir de biopsies d’intestin [
8] a permis d’approcher les mécanismes en cause dans cette affection. Contrairement aux organoïdes contrôles dont les cellules prolifèrent et s’organisent pour former des cryptes et une lumière centrale, les organoïdes déficients en TTC7A ont une croissance très ralentie et ne parviennent jamais à ce stade de différenciation (Figure 1). Ils forment des amas cellulaires sans lumière centrale, qui ne peuvent être maintenus en culture. Cette désorganisation cellulaire a fait soupçonner une anomalie de polarisation des cellules épithéliales qui a pu être mise en évidence à l’aide de différents marqueurs spécifiques. Dans les organoïdes déficients en TTC7A, l’expression basolatérale de l’intégrine alpha 6 est partiellement perdue et l’intégrine s’accumule au niveau des jonctions intercellulaires dans les amas cellulaires (Figure 1). À l’inverse, l’actine, un marqueur apical de la bordure en brosse, est délocalisée en périphérie dans les organoïdes dérivés de ces patients (Figure 1), alors que le marqueur des jonctions serrées zonula occludens (ZO-1) est anormalement localisé aux deux pôles de la cellule épithéliale. Ainsi, l’étude des organoïdes dérivés de l’intestin a clairement mis en évidence un rôle de TTC7A dans la polarisation des cellules épithéliales(Figure 2).
 | Figure 1.
Les organoïdes intestinaux dérivés de patients MIA-CID présentent des défauts de prolifération, de différenciation et de polarité épithéliale. A. Modèle de culture 3D des organoïdes dérivés de l’iléon humain. Les organoïdes de patient forment des amas cellulaires condensés sans développer de lumière centrale ni de cryptes. B. Analyse par immunofluorescence des marqueurs de polarité apico-basale, l’intégrine-α6 (en vert, pôle basal) et l’actine-F (en rose, pôle apical), les noyaux (en bleu, DAPI) dans les organoïdes contrôles et d’un patient. Les pointes de flèche blanches désignent les anomalies de localisation de ces marqueurs. |
 | Figure 2.
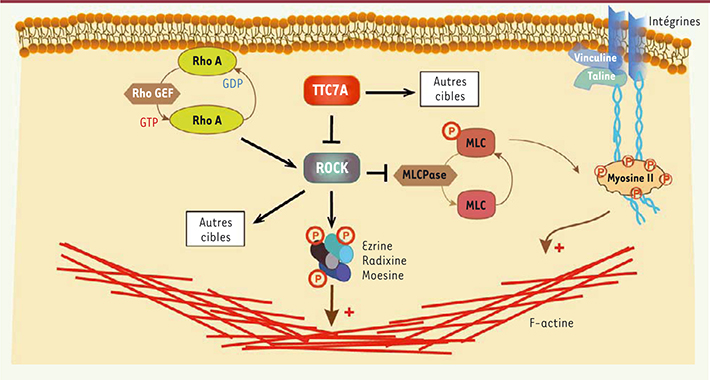
Fonction de TTC7A dans la voie de signalisation RhoA. TTC7A apparaît comme étant un acteur majeur de la voie de signalisation de RhoA en régulant négativement l’activité de la kinase de RhoA (ROCK). ROCK active par phosphorylation ses cibles ezrine/radixine/moesine (ERM) et la chaîne légère de la myosine II (MLC) qui modulent l’organisation du cytosquelette d’actine. |
|
Le défaut de polarité relie TTC7A à la voie RhoA L’activation des intégrines au contact de la matrice extracellulaire induit l’activation de différentes voies de signalisation. Une précédente étude avait montré que le blocage de l’intégrine bêta-1 dans des cellules épithéliales rénales induisait une inversion de la polarité apico-basale des cellules en activant la voie RhoA. Ce phénotype pouvait être modifié et la polarité restaurée par l’ajout de Y27632, un inhibiteur de la kinase de RhoA (ROCK) [
9]. De même, nous avons pu montrer que les organoïdes déficients en TTC7A, cultivés en présence de cet inhibiteur de ROCK, retrouvaient une polarité normale. De plus, en l’absence de TTC7A, les organoïdes expriment des niveaux anormalement élevés des protéines phosphorylées ezrine/radixine/moesine (P-ERM) et de la chaîne légère de la myosine II (P-MLC), toutes des cibles effectrices de ROCK [
10]. Le niveau de phosphorylation de ces protéines est normalisé par le traitement des organoïdes déficients en TTC7A avec Y27632. Une activation exagérée de la voie RhoA est également observée dans des cellules non épithéliales comme des fibroblastes issus de biopsies de peau des patients. Dans ces cellules, un rôle direct de TTC7A dans la voie RhoA est confirmé par la réintroduction d’une forme fonctionnelle de TTC7A, qui normalise la phosphorylation des cibles de ROCK. Ainsi, TTC7A régule négativement l’activité de ROCK et de ses cibles qui participent au réarrangement du cytosquelette d’actine. |
Quelle fonction de TTC7A dans le système immunitaire ? Comment relier le déficit en TTC7A au déficit immunitaire qui caractérise les patients MIA-CID ? La lymphopénie observée chez ces patients peut résulter d’un défaut de différenciation, de prolifération et/ou de survie des lymphocytes. Les patients MIA-CID présentent une hypoplasie thymique, associée à une mauvaise démarcation entre les zones médullaire et corticale [4,
6]. L’utilisation de marqueurs spécifiques de ces deux zones dans lesquelles se déroulent les différentes phases de la différenciation lymphocytaire nous a permis de mettre en évidence une distribution en partie ectopique de ces marqueurs, suggérant que le défaut fonctionnel de TTC7A dans l’épithélium thymique pourrait participer à la lymphopénie observée [4]. Le trop petit nombre de lymphocytes circulants chez les patients MIA-CID n’a pas permis d’étudier cette population. Cependant, nous avons récemment pu mener une étude fonctionnelle sur les lymphocytes de patients présentant des mutations hypomorphes de TTC7A (manuscrit soumis). Ces patients ont une expression beaucoup moins sévère de la maladie, caractérisée par une diarrhée chronique précoce et une lymphopénie T très progressive ([6, 7] et manuscrit soumis). L’étude des lymphocytes de ces patients suggère que TTC7A intervient dans le contrôle de l’homéostasie des lymphocytes en régulant des fonctions telles que l’adhésion, la migration et la prolifération, également en lien avec l’activation de la voie RhoA et la réorganisation du cytosquelette d’actine. |
TTC7A est donc un acteur majeur de la voie de signalisation RhoA : il intervient en régulant négativement l’activité de ROCK et de ses effecteurs cibles comme les protéines ERM et la myosine II. En interagissant avec ces différents régulateurs du cytosquelette, l’activité de TTC7A interfère avec des fonctions essentielles à l’homéostasie des cellules épithéliales et du système immunitaire comme la différenciation, la prolifération et la survie cellulaires. Néanmoins, il reste à comprendre le lien moléculaire entre TTC7A, la voie de signalisation RhoA et d’autres voies impliquant également cette protéine [7]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions Nicole Brousse pour l’étude histologique des biopsies de patients et tous les cliniciens pour leur collaboration et l’accès aux patients. Nous remercions également Alain Fischer et Hans Clevers pour leur contribution à l’étude.
|
1.
Reed
RA
,
Womble
MA
,
Dush
MK
, et al.
Morphogenesis of the primitive gut tube is generated by Rho/ROCK/myosin II-mediated endoderm rearrangements . Dev Dyn.
2009; ; 238 : :3111.–3125. 2.
Lambrecht
W
,
Kluth
D
. Hereditary multiple atresias of the gastrointestinal tract: report of a case and review of the literature . J Ped Surg.
1998; ; 33 : :794.–797. 3.
Rothenberg
ME
,
White
FV
,
Chilmonczyk
B
,
Chatila
T
. A syndrome involving immunodeficiency and multiple intestinal atresias . Immunodeficiency.
1995; ; 5 : :171.–178. 4.
Bigorgne
AE
,
Farin
HF
,
Lemoine
R
, et al.
TTC7A mutations disrupt intestinal epithelial apicobasal polarity . J Clin Invest.
2014; ; 124 : :328.–337. 5.
Samuels
ME
,
Majewski
J
,
Alirezaie
N
, et al.
Exome sequencing identifies mutations in the gene TTC7A in French-Canadian cases with hereditary multiple intestinal atresia . J Med Genet.
2013; ; 50 : :324.–329. 6.
Chen
R
,
Giliani
S
,
Lanzi
G
, et al.
Whole-exome sequencing identifies tetratricopeptide repeat domain 7A (TTC7A) mutations for combined immunodeficiency with intestinal atresias . J Allergy Clin Immunol.
2013; ; 132 : :656.–664. 7.
Avitzur
Y
,
Guo
C
,
Mastropaolo
LA
, et al.
Mutations in tetratricopeptide repeat domain 7A result in a severe form of very early onset inflammatory bowel disease . Gastroenterology.
2014; ; 146 : :1028.–1039. 8.
Sato
T
,
Stange
DE
,
Ferrante
M
, et al.
Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium . Gastroenterology.
2011; ; 141 : :1762.–1772. 9.
Yu
W
,
Shewan
AM
,
Brakeman
P
, et al.
Involvement of RhoA, ROCK I and myosin II in inverted orientation of epithelial polarity . EMBO reports.
2008; ; 9 : :923.–929. 10.
Fehon
RG
,
McClatchey
AI
,
Bretscher
A
. Organizing the cell cortex: the role of ERM proteins . Nat Rev Mol Cell Biol.
2010; ; 11 : :276.–287. |