| |
| Med Sci (Paris). 2014 June; 30(6-7): 621–624. Published online 2014 July 11. doi: 10.1051/medsci/20143006008.Diminuer l’expression de la dynamine 2 Une piste thérapeutique dans la myopathie myotubulaire ? Jocelyn Laporte1* and Belinda Cowling1** 1Département de médecine translationnelle, IGBMC, Inserm U964, CNRS UMR7104, Université de Strasbourg, 1, rue Laurent Fries, 67404Illkirch, France MeSH keywords: Animaux, Régulation négative, Dynamine-II, génétique, Épistasie, Humains, Souris, Souris transgéniques, Myopathies congénitales structurales, mortalité, anatomopathologie, Protein Tyrosine Phosphatases, Non-Receptor, Induction de rémission, Survie |
Les myopathies centronucléaires Les muscles représentent 40 % du poids sec d’un individu et sont importants pour la génération de mouvements, pour la thermogenèse et le métabolisme entre autres. Les fibres musculaires striées peuvent atteindre 20 cm de long et sont multinucléées ; les noyaux sont localisés en périphérie et la majorité du cytoplasme est occupée par les protéines contractiles et le réticulum sarcoplasmique. Les myopathies centronucléaires sont des myopathies sévères se caractérisant, comme leur nom l’indique, par une position anormalement centrale des noyaux en l’absence de régénération musculaire excessive [
1]. Différentes formes de myopathies centronucléaires (CNM pour centronuclear myopathies) sont connues (Figure 1A). La forme liée au chromosome X (XLCNM) est la plus fréquente et est aussi appelée myopathie myotubulaire. Elle est due à des mutations de la myotubularine, une phosphatase à phosphoinositides codée par le gène MTM1 [
2]. Les nouveau-nés atteints présentent une forte hypotonie et une faiblesse musculaire engageant le pronostic vital. La forme autosomique dominante (ADCNM) est associée à une faiblesse musculaire lentement progressive pouvant démarrer dès l’enfance, à l’adolescence ou seulement à l’âge adulte. Elle est liée à des mutations du gène DNM2 codant pour la dynamine 2 [
3]. Les dynamines sont des GTPases régulant principalement la fission des membranes, et donc l’endocytose et le trafic intracellulaire [
4]. La forme autosomique récessive des myopathies centronucléaires est liée soit à des mutations du gène BIN1 codant pour l’amphiphysine 2 dans le cas d’une formule histologique classique avec forte prédominance de noyaux centraux [
5], soit à des mutations de la titine ou du récepteur de la ryanodine chez des patients ayant un spectre phénotypique plus large.
 | Figure 1.
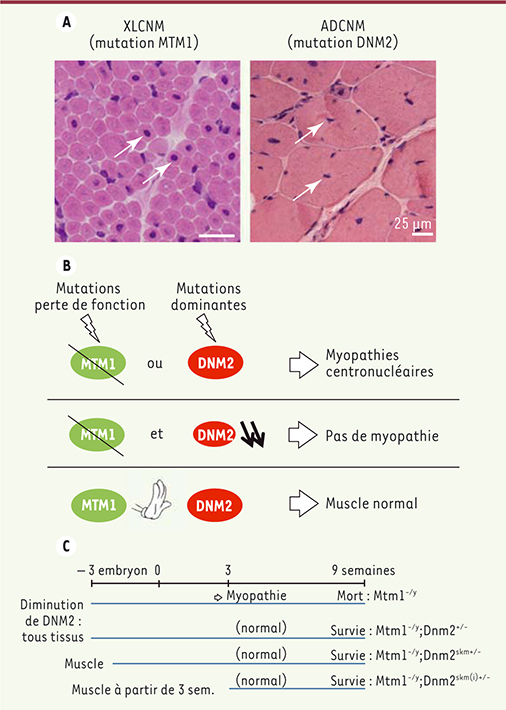
La myotubularine et la dynamine 2 dans les myopathies centronucléaires. A. Des mutations de MTM1 codant la myotubularine ou de DNM2 codant la dynamine 2 conduisent aux myopathies centronucléaires liée à l’X (XLCNM) ou autosomique dominante (ADCNM), respectivement. La forme liée à MTM1 est aussi appelée myopathie myotubulaire. Coloration hématoxyline-éosine des muscles (adapté de figure 1 [
11]). B. L’hypothèse de travail est que les mutations MTM1 entraînent des pertes de fonction et les mutations DNM2 des gains de fonction. La diminution de la dynamine 2 dans des souris sans myotubularine restaure un phénotype normal, ce qui suggère que la myotubularine inhibe la dynamine 2 lors du fonctionnement normal du muscle. C. La souris Mtm1
-/y reproduit un phénotype de myopathie myotubulaire à partir de l’âge de 2 à 3 semaines, et développe une myopathie progressive menant au décès de l’animal. La diminution de l’expression de Dnm2 dans tous les tissus ( Dnm2
+/-), ou sélectivement dans le muscle de façon constitutive ( Dnm2
skm+/-), ou sélectivement dans le muscle à partir de 3 semaines de vie ( Dnm2
skm(i)+/-), stoppe la progression de la myopathie et corrige le phénotype tout en augmentant grandement la survie des animaux Mtm1
-/y. |
Il n’existe pas à ce jour de thérapie ciblée pour la myopathie myotubulaire ni pour les autre formes de myopathies centronucléaires ; de plus les fonctions de la myotubularine et de la dynamine 2 ainsi que leur relation dans le muscle squelettique étaient peu établies jusqu’à maintenant. |
Une hypothèse d’épistasie entre MTM1 et DNM2
Chez la plupart des patients atteints de myopathie myotubulaire liée à l’X, les niveaux de myotubularine sont fortement diminués, suggérant que cette forme de myopathie centronucléaire est due à une perte de fonction. Les mutations de DNM2 ségrégent de façon dominante, et des expériences in vitro suggèrent que certaines mutations augmentent l’activité GTPase et l’oligomérisation de la dynamine 2 sans influencer le taux de la protéine. De plus, la diminution de 50 % de l’expression de Dnm2 chez la souris ne cause aucun phénotype détectable, écartant un mécanisme d’haploinsuffisance, alors que l’introduction par transgenèse constitutive ou transduction virale d’une mutation de Dnm2 observée chez un patient à l’état hétérozygote reproduit la myopathie [
6–
8]. Or, la surexpression de la protéine sauvage, que ce soit par transfert génique ou transgenèse, conduit elle aussi à un phénotype de myopathie centronucléaire [8,
9]. Tout ceci nous a amené à proposer que les myopathies centronucléaires sont dues à une perte de fonction de la myotubularine ou à un gain de fonction de la dynamine 2 (Figure 1B). En d’autres termes, si ces deux protéines sont bien dans la même voie, l’une inhibe l’autre pour un fonctionnement normal du muscle. Cette hypothèse a été testée dans la souris Mtm1
-/y reproduisant la myopathie myotubulaire ; nous avons évalué l’amélioration du phénotype après réduction du niveau de dynamine 2 de façon constitutive, spécifiquement dans le muscle, ou après la naissance au début de la myopathie (Figure 1C). |
La diminution de dynamine 2 sauve les souris myopathes Les souris Mtm1
-/y développent une faiblesse musculaire progressive à partir de 2 à 3 semaines après la naissance, et l’histologie musculaire est similaire à celle qui est observée chez les patients (fibres hypotrophiques à noyaux centraux) ; elles meurent entre un et trois mois. En revanche, les souris Mtm1
-/y chez lesquelles une diminution de 50 % de l’expression de Dnm2 a été induite (Mtm1
-/y;Dnm2
+/-) survivent jusqu’à plus de deux ans, une durée de vie normale pour une souris (Figure 2A–B) [6]. Le poids et le déplacement sont normalisés, et la masse musculaire, qui était fortement réduite dans les souris Mtm1
-/y, est corrigée dans la majorité des muscles testés. Il est remarquable d’observer que les performances physiques ainsi que la force de muscles isolés et la capacité respiratoire sont corrigées. L’examen histologique des souris Mtm1
-/y;Dnm2
+/- révèle une normalisation de la taille des fibres musculaires ainsi qu’une diminution très nette du nombre de fibres à noyaux centraux (Figure 2C–D). L’organisation intracellulaire des fibres musculaires est aussi normalisée ainsi que la forme et la position des triades, des structures membranaires permettant la transformation de l’influx nerveux en contraction.
 | Figure 2.
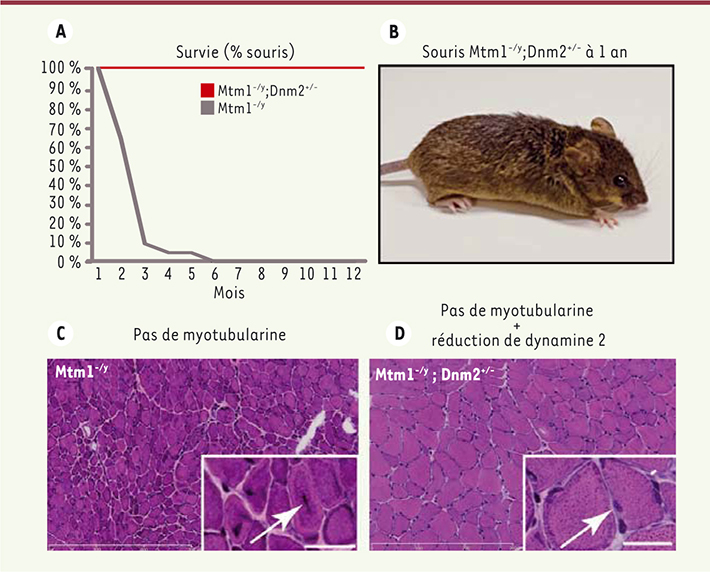
La diminution de la dynamine 2 améliore la myopathie myotubulaire dans des souris. A. Alors que toutes les souris Mtm1 -/y sont mortes avant l’âge de 6 mois, 100 % des souris Mtm1-/y;Dnm2+/- survivent, et les plus âgées ont atteint l’âge de 2 ans, une durée de vie normale (adapté de [ 6]). B. La première souris sans myotubularine ayant atteint l’âge de 1 an (adapté de la figure 7A de [ 6]). C. Les fibres des muscles de souris Mtm1 -/y ont un phénotype « centronucléaire » caractérisé par des fibres hypotrophiques avec des noyaux centralisés. D. La diminution de 50 % de la dynamine 2 normalise la taille des fibres et diminue significativement les défauts de positionnement des noyaux. Échelles 300 μm et 25 μm dans les grossissements (adapté de la figure 3A de [ 6]). |
|
La diminution de la dynamine 2 améliore la myopathie même une fois les premiers signes déclarés Nous avons ensuite testé si la correction de la myopathie est due à une diminution spécifique de la dynamine 2 dans le tissu musculaire et si cette stratégie pouvait être appliquée après le début de la maladie, puisque les patients sont déjà affectés à la naissance. Nous avons pour cela provoqué la délétion d’un allèle de Dnm2 (construction floxée) par la recombinase Cre, placée sous contrôle du promoteur musculaire de l’actine squelettique humaine et couplée à un mutant du récepteur des œstrogènes ; l’activité du récepteur, et donc de Cre, peut être induite par l’injection de tamoxifène (souris Mtm1
-/y ; Dnm2
+/flox ; HSA-Cre ou Cre-ERT2). La diminution de la dynamine 2 seulement dans les fibres musculaires dès l’embryogenèse est suffisante pour améliorer grandement le phénotype musculaire et la survie des souris. Parallèlement à la diminution constitutive de la dynamine 2, nous avons noté une amélioration de la force et de la structure des muscles ainsi qu’une forte relocalisation des noyaux dans les fibres musculaires et donc une diminution de leur position centronucléaire. Ces données suggèrent que l’effet thérapeutique de la réduction de cette molécule intervient directement dans le muscle atteint, et que la myotubularine et la dynamine 2 interagissent fonctionnellement dans ce tissu. Nous avons également provoqué la délétion d’un allèle de Dnm2 dans le muscle des souris Mtm1
-/y;Dnm2
+/flox;HSA-Cre-ERT2 à partir de 3 semaines, un âge où un début d’atrophie musculaire et de centralisation des noyaux est observé chez les souris Mtm1
-/y. Comme précédemment, la diminution de Dnm2 augmente la survie et diminue, voire stoppe, l’atrophie musculaire et le phénotype centronucléaire. |
Quel lien fonctionnel entre myotubularine et dynamine dans le muscle ? Ces données génétiques démontrent que la myotubularine et la dynamine 2 appartiennent à une même voie contrôlant la force et la structure des fibres musculaires ainsi que le positionnement des organites. Ces deux protéines régulent le remodelage des membranes : la myotubularine joue sur la courbure membranaire du réticulum sarcoplasmique et le positionnement et la structure des triades, et la dynamine est impliquée dans la tubulation et la fission des membranes de différents compartiments [
10]. De plus, la myotubularine déphosphoryle certains phosphoinositides, alors que la fonction de la dynamine 2 est régulée par une liaison directe à des phospho-inositides et à des protéines régulées par des phosphoinositides. Il reste à tester si la myotubularine inhibe la dynamine 2 directement ou via son action sur les membranes et/ou ces phosphoinositides. D’autre part, le taux de dynamine 2 est augmenté dans les souris sans myotubularine ainsi que chez les patients atteints de myopathie myotubulaire, après le début des signes cliniques [6]. Cette augmentation pourrait être en partie la cause d’une trop grande activité de la dynamine 2, qui est corrigé par la diminution génétique de Dnm2. |
Applications thérapeutiques envisageables L’identification de la dynamine 2 comme excellente cible thérapeutique dans la myopathie myotubulaire ouvre plusieurs perspectives. Il est techniquement envisageable de diminuer le niveau ou l’activité de la dynamine 2 chez l’homme. Les résultats suggèrent aussi une fenêtre d’action assez large et une intervention possible après l’apparition de la maladie. De plus, il sera important de tester si cette approche améliore les autres formes de myopathies centronucléaires dues à des mutations de BIN1 ou titine par exemple. Enfin, il s’agit d’une des premières propositions de « thérapie croisée », où la diminution d’une protéine impliquée dans les myopathies centronucléaires (dynamine 2) guérit le phénotype dû à la perte d’une autre protéine impliquée dans les myopathies centronucléaires (myotubularine). |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Belinda Cowling a été soutenue par la Fondation pour la recherche médicale et Jocelyn Laporte par l’Inserm et un contrat hospitalier de recherche translationnelle avec l’AP-HP.
|
1.
Jungbluth
H
,
Wallgren-Pettersson
C
,
Laporte
J
. Centronuclear (myotubular) myopathy . Orphanet J Rare Dis.
2008; ; 3 : :26.. 2.
Laporte
J
,
Mandel
JL
. Le clonage du gène de la myopathie myotubulaire définit une nouvelle famille de tyrosine phosphatases . Med Sci (Paris).
1996; ; 12 : :856.–857. 3.
Bitoun
M
,
Romero
NB
,
Guicheney
P
. Des mutations de la dynamine 2 à l’origine de la forme dominante de la myopathie centronucléaire . Med Sci (Paris).
2006; ; 22 : :101.–102. 4.
Praefcke
GJ
,
McMahon
HT
. The dynamin superfamily: universal membrane tubulation and fission molecules? . Nat Rev Mol Cell Biol.
2004; ; 5 : :133.–147. 5.
Toussaint
A
,
Nicot
AS
,
Mandel
JL
,
Laporte
J
. Mutations de l’amphiphysine 2 (BIN1) dans les myopathies centronucléaires récessives . Med Sci (Paris).
2007; ; 23 : :1080.–1082. 6.
Cowling
BS
,
Chevremont
T
,
Prokic
I
, et al.
Reducing dynamin 2 expression rescues X-linked centronuclear myopathy . J Clin Invest.
2014; ; 124 : :1350.–1363. 7.
Durieux
AC
,
Vignaud
A
,
Prudhon
B
, et al.
A centronuclear myopathy-dynamin 2 mutation impairs skeletal muscle structure and function in mice . Hum Mol Genet.
2010; ; 19 : :4820.–4836. 8.
Cowling
BS
,
Toussaint
A
,
Amoasii
L
, et al.
Increased expression of wild-type or a centronuclear myopathy mutant of dynamin 2 in skeletal muscle of adult mice leads to structural defects and muscle weakness . Am J Pathol.
2011; ; 178 : :2224.–2235. 9.
Liu
N
,
Bezprozvannaya
S
,
Shelton
JM
, et al.
Mice lacking microRNA 133a develop dynamin 2-dependent centronuclear myopathy . J Clin Invest.
2011; ; 121 : :3258.–3268. 10.
Cowling
BS
,
Toussaint
A
,
Muller
J
,
Laporte
J
. Defective membrane remodeling in neuromuscular diseases: insights from animal models . PLoS Genet.
2012; ; 8 : :e1002595.. 11.
Toussaint
A
,
Cowling
BS
,
Hnia
K
. Defects in amphiphysin 2 (BIN1) and triads in several forms of centronuclear myopathies . Acta Neuropathol.
2011; ; 121 : :253.–266. |