| |
| Med Sci (Paris). 2014 June; 30(6-7): 624–627. Published online 2014 July 11. doi: 10.1051/medsci/20143006009.Les tanycytes hypothalamiques Porte d’entrée de la leptine dans le cerveau Églantine Balland1,2 and Vincent Prévot1,2* 1Inserm, équipe développement et plasticité du cerveau postnatal, Centre de recherche Jean-Pierre Aubert, Inserm U837, bâtiment Biserte, 1, place de Verdun59045 Lille Cedex, France 2Université de Lille, faculté de médecine, Lille, France MeSH keywords: Animaux, Poids du corps, Cellules cultivées, Résistance aux substances, Métabolisme énergétique, Cellules épendymogliales, métabolisme, Humains, Hypothalamus, Leptine, Souris, Souris obèse, Obésité, Transport de protéines |
Balance énergétique et poids corporel Le poids corporel d’un individu est défini par sa balance énergétique, c’est-à-dire par l’équilibre entre la prise alimentaire et les dépenses énergétiques de l’organisme (activité physique et métabolique). Si la prise alimentaire est plus importante que la dépense énergétique, le bilan sera en faveur d’un stockage d’énergie sous forme de graisses. Dans le cas inverse, les réserves graisseuses seront utilisées pour produire de l’énergie, provoquant une perte de poids. Comme toute fonction indispensable à la survie, la balance énergétique est finement régulée, notamment par divers facteurs hormonaux sécrétés par les tissus périphériques, qui informent le système nerveux central (SNC) de l’état des réserves énergétiques afin d’adapter le comportement alimentaire et la dépense énergétique. |
La leptine, hormone clé du métabolisme Parmi les facteurs régulant la balance énergétique, la leptine produite par les adipocytes a été identifiée comme un régulateur majeur du poids corporel [
1]. En effet, un défaut de production de leptine provoque l’obésité, et l’administration de cette adipokine permet le retour à un poids corporel normal aussi bien chez l’homme que chez la souris mutante ob/ob [
2,
3]. De même, une souris ne possédant pas le récepteur de la leptine LepRb (souris mutante db/db) développe une obésité [
4]. La leptine exerce donc un effet inhibiteur sur la prise alimentaire proportionnel au degré d’adiposité de l’organisme. Ainsi, si la masse graisseuse augmente, la quantité de leptine produite augmente, ce qui déclenche une diminution de la consommation de nourriture. Cet effet sur la prise alimentaire est relayé par le système nerveux central où la leptine active les circuits neuronaux anorexigènes et inhibe les circuits neuronaux orexigènes. L’hypothalamus est une région clé de la régulation de la prise alimentaire, en particulier le noyau arqué hypothalamique (ARH). Le rôle essentiel joué par la leptine au niveau de ce noyau est bien illustré par les modèles mutants : en effet, l’absence du récepteur LepRb provoque l’obésité. Cependant, le retour à un poids normal est rendu possible par l’administration de vecteurs viraux permettant d’exprimer à nouveau LepRb spécifiquement au niveau du noyau arqué hypothalamique [
5]. |
Obésité et résistance à la leptine L’obésité est définie comme l’accumulation excessive de masse adipeuse résultant d’un déséquilibre chronique de la balance énergétique [
6]. L’obésité due à un défaut de leptine peut être traitée par l’administration de cette hormone [2], mais les formes d’obésité congénitale sont très rares chez l’homme. Bien que des prédispositions génétiques à l’obésité existent, il est admis que l’hyperphagie est la cause majeure de « l’épidémie » d’obésité observée aujourd’hui dans les pays industrialisés1. L’excès de masse graisseuse chez les personnes obèses est systématiquement associé à des taux sanguins de leptine élevés. Cependant, pour des raisons qui ne sont pas encore totalement expliquées, cette leptinémie élevée ne s’accompagne ni d’une faible prise alimentaire ni d’une forte dépense énergétique [
7]. De manière similaire dans les modèles animaux, l’hyperleptinémie induite par un régime riche en graisses (high fat diet ou HFD) aggrave la prise de poids et les anomalies métaboliques [
8]. De plus, l’injection de leptine exogène, même à dose élevée, n’entraîne pas de diminution de la prise alimentaire ni du poids corporel en cas d’obésité chez les animaux et l’humain, sauf dans les rares cas de déficience en leptine. Ces observations ont fait naître le concept de résistance hormonale à la leptine, qui correspond à l’incapacité des individus obèses (hommes ou animaux) à répondre de manière adaptée à l’augmentation de la leptine endogène ou exogène [
9]. Deux mécanismes moléculaires responsables de la résistance à la leptine ont été identifiés : (1) une altération du transport de la leptine du sang vers le cerveau et notamment l’hypothalamus, site d’action critique pour la régulation de la balance énergétique par la leptine [
10,
11] ; (2) une altération de l’activation du récepteur LepRb par la leptine au niveau du noyau arqué hypothalamique, qui expliquerait la diminution de l’effet anorexigène de la leptine chez les souris rendues obèses par le régime riche en graisses [
12]. Plusieurs altérations des voies de signalisation en aval de l’activation de LepRb ont été identifiées [9]. Néanmoins, une question très importante reste à élucider, notamment pour proposer de nouvelles voies thérapeutiques chez les patients obèses : comment la leptine entre t-elle dans le cerveau? |
Tanycytes et transport de la leptine dans le cerveau Le cerveau est protégé par la barrière hémato-encéphalique (BHE), qui forme un obstacle au passage des molécules du sang vers le cerveau. Cette barrière est constituée d’un assemblage de protéines spécialisées (jonctions serrées) qui rendent imperméable l’espace entre les cellules (endothéliales) formant les vaisseaux sanguins. Ainsi, les molécules ayant accès au cerveau sont sélectivement transportées via des récepteurs spécifiques. Le noyau arqué hypothalamique se situe à proximité de l’éminence médiane hypothalamique, une zone du cerveau où la fonction de barrière hémato-encéphalique est assurée par des cellules gliales spécialisées appelées tanycytes, dont les corps cellulaires bordent le plancher du troisième ventricule et les prolongements contactent les capillaires fenêtrés du sang porte hypothalamo-hypophysaire2 à la surface piale du cerveau (Figure 1) [
13].
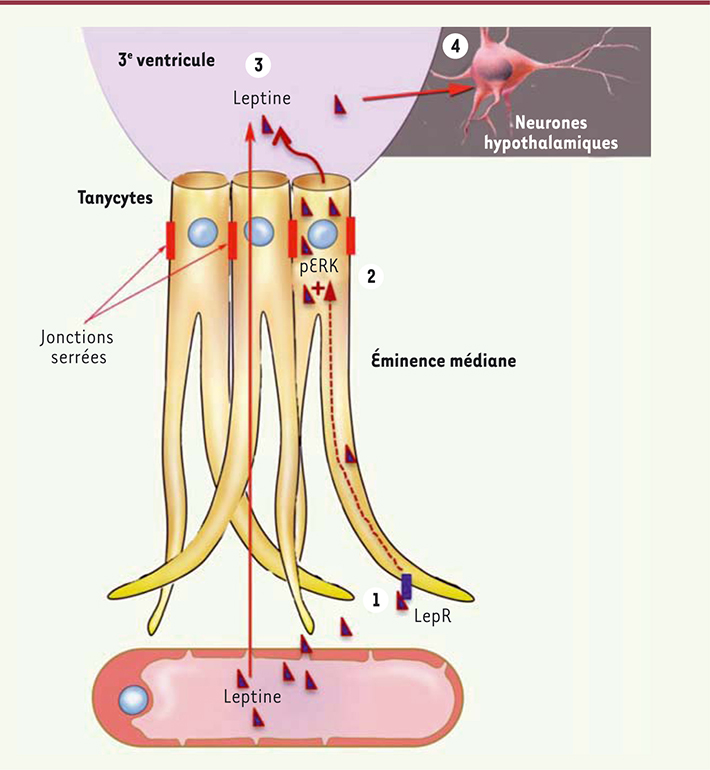
 | Figure 1.
Transport de la leptine vers le cerveau. Les tanycytes capturent la leptine circulante à partir des vaisseaux sanguins du système porte hypothalamo-hypophysaire dont l’endothélium a la particularité d’être fenêtré (étape 1). Lors de son parcours dans le tanycyte, la leptine, capturée par une voie nécessitant la présence de récepteurs fonctionnels (LepR), active une voie de signalisation dépendant de ERK (étape 2) qui enclenche sa libération dans le liquide céphalorachidien (étape 3). La leptine active alors les zones cérébrales qui véhiculent son action anorexigène (étape 4). |
Dans une étude publiée dans Cell Metabolism [
14], nous avons testé l’hypothèse que ces tanycytes pouvaient être le support cellulaire du transport de la leptine du sang vers l’hypothalamus. Nos études réalisées chez la souris ont démontré que lorsque la leptine est injectée en périphérie (dans la cavité intra-péritonéale), elle peut être détectée de manière séquentielle d’abord dans l’éminence médiane, puis ensuite dans le noyau arqué hypothalamique. L’activation du récepteur LepRb mis en évidence par le marqueur d’activation intracellulaire phospho-STAT3 suit la même séquence temporelle. Ce résultat suggère que l’éminence médiane représente une porte d’entrée pour la leptine vers le cerveau. L’utilisation de leptine fluorescente nous a permis de montrer que l’hormone transite de manière polarisée dans les tanycytes au sein de l’éminence médiane (in vivo chez la souris et dans des tanycytes en culture). La leptine quitte la circulation sanguine au niveau des capillaires sanguins situés à la base de l’éminence médiane, elle est ensuite internalisée dans les prolongements tanycytaires, transite jusqu’au pôle apical des tanycytes afin d’être libérée dans le 3e ventricule (3V), puis diffuse librement dans le noyau arqué hypothalamique (Figure 1). L’administration d’un anticorps neutralisant la leptine dans le 3e ventricule empêche en partie la leptine injectée en périphérie d’atteindre sa cible, confirmant le trajet emprunté par la leptine pour atteindre le cerveau. Au contraire, les mêmes études faites chez des souris obèses (régime riche en graisses et mutation db/db) montrent que la leptine injectée reste « piégée » dans les tanycytes de l’éminence médiane. |
La voie de signalisation ERK : un acteur indispensable Nos expériences dans des cultures de tanycytes ont permis d’identifier les mécanismes cellulaires de la capture de leptine au niveau des prolongements basaux (cette étape du transport ne nécessite pas l’activation de LepRb et n’est pas altérée par l’obésité) et de sa libération au niveau du pôle apical du tanycyte (cette étape du transport nécessite l’activation de LepRb et est altérée chez les souris obèses). En testant divers composés antagonistes des principales voies de signalisation activées par LepRb, nous avons identifié la voie de signalisation ERK comme étant indispensable à la libération de la leptine par les tanycytes (Figure 1). Ce résultat majeur obtenu in vitro nous a permis de restaurer cette étape du transport de la leptine chez les souris obèses au moyen d’un composé – l’epidermal growth factor ou EGF – capable d’activer la voie de signalisation ERK dans les tanycytes indépendamment de la leptine. Ainsi, lors du retour à un régime standard, les souris obèses recevant de l’EGF quotidiennement retrouvent leur sensibilité à la leptine 2,5 fois plus rapidement, et leur perte de poids est donc considérablement accélérée. |
Conclusion et perspectives La découverte que l’activation de ERK par l’EGF offre un moyen de restaurer le transport de la leptine a fait l’objet d’un dépôt de brevet. Une collaboration avec l’industrie pharmaceutique pourrait permettre de mettre au point des traitements contre l’obésité faisant intervenir des molécules capables d’activer la voie de signalisation ERK spécifiquement dans les tanycytes. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ces travaux ont été réalisés en collaboration avec l’Institut Cochin (Inserm U1016, Université Paris Descartes), l’Université de Rouen (Inserm U982) et Cisbio Bioassays. Ils ont été financés par l’ANR-05-JCJC, ANR-09-BLAN-0267 et la Fondation pour la recherche médicale (équipe FRM 2005 et DEQ20130326524).
|
Footnotes |
1.
Campfield
LA
,
Smith
FJ
,
Guisez
Y
,
Devos
R
,
Burn
P
. Recombinant mouse OB protein: evidence for a peripheral signal linking adiposity and central neural networks . Science.
1995; ; 269 : :546.–549. 2.
Farooqi
IS
,
Jebb
SA
,
Langmack
G
, et al.
Effects of recombinant leptin therapy in a child with congenital leptin deficiency . N Engl J Med.
1999; ; 341 : :879.–884. 3.
Pelleymounter
MA
,
Cullen
MJ
,
Baker
MB
, et al.
Effects of the obese gene product on body weight regulation in ob/ob mice . Science.
1995; ; 269 : :540.–543. 4.
Chen
H
,
Charlat
O
,
Tartaglia
LA
, et al.
Evidence that the diabetes gene encodes the leptin receptor: identification of a mutation in the leptin receptor gene in db/db mice . Cell.
1996; ; 84 : :491.–495. 5.
Coppari
R
,
Ichinose
M
,
Lee
CE
, et al.
The hypothalamic arcuate nucleus: a key site for mediating leptin’s effects on glucose homeostasis and locomotor activity . Cell Metab.
2005; ; 1 : :63.–72. 6.
Stunkard
AJ
. Current views on obesity . Am J Med.
1996; ; 100 : :230.–236. 7.
Maffei
M
,
Halaas
J
,
Ravussin
E
, et al.
Leptin levels in human and rodent: measurement of plasma leptin and ob RNA in obese and weight-reduced subjects . Nat Med.
1995; ; 1 : :1155.–1161. 8.
Ogus
S
,
Ke
Y
,
Qiu
J
,
Wang
B
,
Chehab
FF
. Hyperleptinemia precipitates diet-induced obesity in transgenic mice overexpressing leptin . Endocrinology.
2003; ; 144 : :2865.–2869. 9.
Myers
MG, Jr.
,
Leibel
RL
,
Seeley
RJ
,
Schwartz
MW
. Obesity and leptin resistance: distinguishing cause from effect . Trends Endocrinol Metab.
2010; ; 21 : :643.–651. 10.
Caro
JF
,
Kolaczynski
JW
,
Nyce
MR
, et al.
Decreased cerebrospinal-fluid/serum leptin ratio in obesity: a possible mechanism for leptin resistance . Lancet.
1996; ; 348 : :159.–161. 11.
Van Heek
M
,
Compton
DS
,
France
CF
, et al.
Diet-induced obese mice develop peripheral, but not central, resistance to leptin . J Clin Invest.
1997; ; 99 : :385.–390. 12.
El-Haschimi
K
,
Pierroz
DD
,
Hileman
SM
,
Bjorbaek
C
,
Flier
JS
. Two defects contribute to hypothalamic leptin resistance in mice with diet-induced obesity . J Clin Invest.
2000; ; 105 : :1827.–1832. 13.
Langlet
F
,
Levin
BE
,
Luquet
S
, et al.
Tanycytic VEGF-A boosts blood-hypothalamus barrier plasticity and access of metabolic signals to the arcuate nucleus in response to fasting . Cell Metab.
2013; ; 17 : :607.–617. 14.
Balland
E
,
Dam
J
,
Langlet
F
, et al.
Hypothalamic tanycytes are an ERK-gated conduit for leptin into the brain . Cell Metab.
2014; ; 19 : :293.–301. 15.
Vatier
C
,
Capeau
J
,
Vigouroux
C
. La leptine, nouvelle perspective thérapeutique dans le traitement du diabète ? . Med Sci (Paris).
2010; ; 26 : :803.–807. |