| |
| Med Sci (Paris). 2014 August; 30(8-9): 724–726. Published online 2014 September 1. doi: 10.1051/medsci/20143008003.Dégradation spécifique de l’ADN nucléaire responsable de la persistance du virus de l’hépatite B Julie Lucifora,1,2,3*** Yuchen Xia,1** Florian Reisinger,1 Daniela Stadler,1 Mathias Heikenwälder,1** and Ulrike Protzer1,2** 1Institute of Virology, Technische Universität München/Helmholtz Zentrum München, Munich, Allemagne 2German Center for Infection Research (DZIF), Allemagne 3affiliation actuelle : Inserm U1052, CNRS UMR 5286, centre de recherche en cancérologie de Lyon (CRCL), Université de Lyon (UCBL), Lyon, France MeSH keywords: Antiviraux, pharmacologie, Noyau de la cellule, effets des médicaments et des substances chimiques, génétique, virologie, Cytokines, Cytosine deaminase, physiologie, Clivage de l'ADN, Altération de l'ADN, ADN circulaire, métabolisme, ADN viral, Virus de l'hépatite B, Humains |
Malgré l’existence d’un vaccin efficace, un tiers de la population mondiale a été en contact avec le virus de l’hépatite B (HBV) et plus de 240 millions de personnes sont infectées de façon chronique selon les dernières estimations de l’Organisation mondiale de la santé. Ces porteurs chroniques ont un risque accru de développer des maladies graves du foie comme une cirrhose ou un carcinome hépatocellulaire (CHC). Le carcinome hépatocellulaire, l’un des cinq cancers les plus répandus au monde, est la cause de plus de deux millions de décès par an. |
Persistance du virus de l’hépatite B malgré les traitements disponibles HBV est un petit virus enveloppé à ADN qui a l’originalité de se répliquer par l’intermédiaire d’un ARN. Dans la capside virale, le génome HBV est présent sous la forme d’un ADN relâché circulaire, partiellement double brin, appelé ADN-rc. Après l’entrée du virus dans la cellule et l’importation du génome viral dans le noyau, l’ADN-rc est converti en un ADN circulaire covalemment clos appelé ADNccc. Cet ADNccc, qui persiste dans le noyau des cellules infectées sous forme d’un mini-chromosome viral, sert de matrice pour la transcription des ARN viraux [
1]. Dans la majorité des cas, les patients atteints de façon chronique sont traités avec des analogues de nucléos(t)ides. Ces molécules permettent de contrôler, mais pas d’éliminer, HBV puisqu’elles inhibent très efficacement la réplication de HBV mais n’ont aucun effet sur l’ADNccc [
2]. Par conséquent, ces traitements coûteux doivent être administrés à très long terme, les patients font face à des problèmes de résistance et restent exposés aux risques de développer un carcinome hépatocellulaire [
3]. L’élimination de l’ADNccc, nécessaire pour guérir définitivement les patients atteints d’hépatite B, est donc un enjeu majeur pour la recherche médicale. |
Des cytokines pouvant entraîner la dégradation de l’ADNccc La guérison de l’infection durant la phase aiguë de la maladie était traditionnellement attribuée à la clairance du virus une fois les cellules infectées détruites. Ce concept a été remis en cause il y a quelques années par des études montrant qu’HBV, et notamment l’ADNccc, pourraient aussi être contrôlés, indépendamment de l’effet cytopathique, durant la phase aiguë de l’infection [
4]. En utilisant des cellules T CD8+ spécifiques de HBV, il a même été montré, in vitro, que la majeure partie de l’effet anti-HBV met en jeu des mécanismes non cytopathiques impliquant l’activité de différentes cytokines [
5]. Le mécanisme d’action précis ainsi que l’implication de ces cytokines dans la déstabilisation de l’ADNccc n’étaient, toutefois, pas encore résolus. Nous avons montré qu’à fortes doses, certaines cytokines telles que l’IFN (interféron) alpha (IFN-α) peuvent effectivement induire la dégradation de l’ADNccc indépendamment de la lyse cellulaire [
6]. L’IFN-α est utilisé depuis de nombreuses années comme traitement chez les patients infectés de façon chronique par HBV, mais les doses nécessaires pour aboutir à la dégradation de l’ADNccc in vitro sont bien supérieures à celles qui peuvent être administrées aux patients. Nous avons donc testé d’autres molécules pouvant avoir un effet similaire sur l’ADNccc, mais à des doses compatibles avec une possible administration ultérieure à des patients. Comme alternative au TNF (tumor necrosis factor) alpha, connu pour son action anti-HBV [
7], nous avons testé l’effet antiviral de l’activation du récepteur de la lymphotoxine bêta (LTβR) dont les ligands (lymphotoxines) appartiennent à la superfamille du TNF alpha et activent aussi la voie NF-κB [
8]. Nous avons observé que l’utilisation d’anticorps agonistes du LTβR entraîne également la dégradation de l’ADNccc dans les cellules infectées sans qu’aucun rebond de la réplication de HBV ne soit observé à l’arrêt des traitements, contrairement à ce qui est habituellement observé avec les analogues de nucléos(t)ides [6]. |
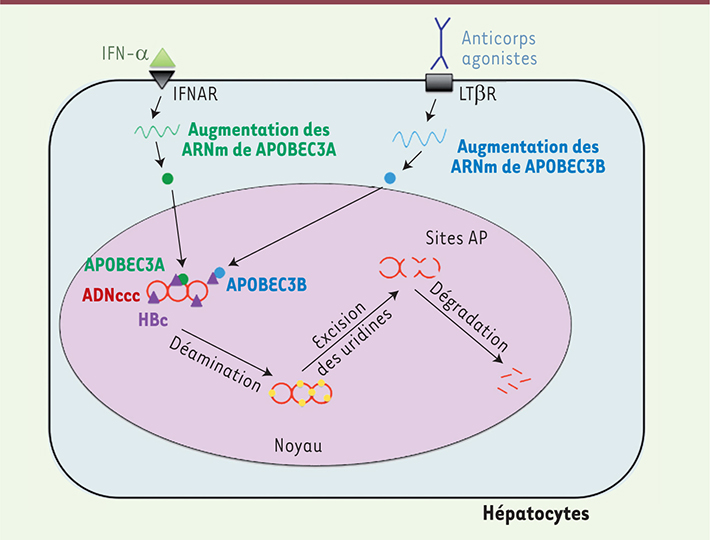
Les APOBEC3 nucléaires au cœur des mécanismes menant à la dégradation de l’ADNccc Afin de comprendre comment l’IFN-α ou les agonistes du LTβR induisent la dégradation de l’ADNccc, nous avons étudié la nature de l’ADNccc au cours des traitements. Grâce à des techniques d’amplifications différentielles de l’ADN basées sur des variations de la température de dénaturation, nous avons montré que, en réponse à ces traitements, l’ADNccc subit de nombreuses déaminations au niveau des cytidines [6]. Ces dernières, transformées en uridine, sont retirées par une ou plusieurs enzymes cellulaires (restant à identifier), créant des sites apurinique/apyrimidique [6]. Ceux-ci sont reconnus par des endonucléases cellulaires qui vont digérer l’ADN adjacent à ces sites et entraîner la dégradation de l’ADNccc. Ce mécanisme de dégradation semble être spécifique de l’ADNccc, car nous n’avons pas observé de déamination d’autres ADN épisomaux ou surtout de l’ADN génomique [6]. Grâce à des analyses transcriptomiques, nous avons découvert qu’APOBEC3B (apolipoprotein B mRNA editing enzyme, catalytic polypeptide-like 3B), une protéine connue pour son activité de déaminase, était fortement surexprimée dans des hépatocytes infectés par HBV et traités avec des agonistes du LTβR [6]. Dans le cas de l’IFN-α, c’est APOBEC3A qui est fortement surexprimée à la suite du traitement, aussi bien in vitro que chez des patients traités avec de l’IFN-α pégylé [6]. Des expériences d’inhibition directe (par la surexpression de la protéine Vif du virus de l’immunodéficience humaine [VIH] ou par des techniques d’interférence ARN) ou de surexpression de APOBEC3A et APOBEC3B nous ont permis de montrer que ces deux enzymes nucléaires sont responsables de la déamination de l’ADNccc observée lors de traitements par l’IFN-α ou des agonistes du LTβR respectivement [6] (Figure 1).
 | Figure 1.
Modèle de dégradation de l’ADNccc suite aux traitements par de l’IFN-α ou des agonistes du LTβR. De fortes dose d’l’IFN-α ou l’activation du LTβR entraînent la surexpression de APOBEC3A et APOBEC3B, respectivement, qui colocalisent et/ou interagissent directement avec HBc, elle-même liée à l’ADNccc. Les protéines APOBEC3A/B exercent alors leur activité de déamination sur l’ADNccc. Les uracyles ainsi introduits dans l’ADNccc sont reconnus et excisés par une ou plusieurs ADN glycosylases, créant des sites apurinique/apyrimidique reconnus par des endonucléases spécialisées qui vont dégrader l’ADNccc. IFNAR : récepteur aux interférons de type I ; LTβR : récepteur de la lymphotoxine bêta. |
Comme la protéine core de HBV (HBc) est associée à l’ADNccc [
9], nous avons cherché à savoir si elle était responsable du ciblage de APOBEC3A et APOBEC3B sur l’ADNccc. Nous avons d’abord observé que APOBEC3A, tout comme HBc, se lie à l’ADNccc [6] mais pas à l’ADN génomique. De plus, grâce à différentes méthodes (marquages, co-immunoprécipitations, transfert d’énergie entre molécules fluorescentes de type FRET [fluorescence resonance energy transfer] ou PLA [proximity ligation assay]), nous avons montré que APOBEC3A colocalise et interagit avec HBc, suggérant que cette dernière aurait effectivement un rôle dans l’adressage de APOBEC3A vers l’ADNccc. Reste à savoir pourquoi l’ADNccc est dégradé au lieu d’être réparé par la machinerie cellulaire. En utilisant des combinaisons d’enzymes variés, nous avons pu réparer, in tubo, l’ADNccc déaminé suite aux traitements par de l’IFN-α ou des agonistes du LTβR [6]. Ceci suggère l’existence d’un facteur additionnel promouvant la dégradation de l’ADNccc ou un blocage de la machinerie de réparation cellulaire plutôt qu’un défaut de reconnaissance par cette dernière. Différentes hypothèses sont testées à l’heure actuelle : (1) soit le nombre de sites apurinique/apyrimidique introduits après les traitements excède la capacité de la machinerie de réparation cellulaire, (2) soit l’IFN-α, les agonistes du LTβR ou HBV lui-même [
10] modulent la machinerie cellulaire en faveur de la dégradation de l’ADNccc plutôt que de sa réparation. Enfin, comment APOBEC3A et APOBEC3B peuvent-elles agir sur un ADN double brin alors qu’elles ont été décrites comme étant efficaces presque exclusivement sur des ADN simple brin [
11] ? Une possibilité, qui est actuellement testée, serait que ces déaminases agissent sur l’ADNccc quand il est transitoirement rendu simple brin au moment de l’initiation de sa transcription. |
Conclusions et perspectives La dégradation de l’ADNccc, indépendamment de tout effet cytopathique sur la cellule infectée, est donc bien possible. Ces données sont importantes à plus d’un titre : d’un point de vue fondamental, car elles révèlent un mécanisme cellulaire permettant de dégrader un ADN viral nucléaire (Figure 1) tout en gardant intact l’intégralité du génome cellulaire ; d’un point de vue thérapeutique, puisqu’elles ouvrent la voie au développement de nouvelles stratégies antivirales aboutissant à l’élimination complète d’HBV. À cet égard, il sera important de tester des combinaisons d’analogues de nucléos(t)ides avec des molécules permettant d’activer la dégradation de l’ADNccc (utilisation d’agonistes du LTβR ou de petites molécules permettant l’activation plus directement de APOBEC3A ou APOBEC3B). |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Dandri
M
,
Locarnini
S.
New insight in the pathobiology of hepatitis B virus infection . Gut.
2012; ; 61 : (suppl 1)
:16.–17. 2.
Lucifora
J
,
Zoulim
F
. The life cycle of hepatitis B virus and antiviral targets . Futur Virology.
2011; ; 6 : :599.–614. 3.
Zoulim
F
,
Locarnini
S.
Management of treatment failure in chronic hepatitis B.
J Hepatol.
2012; ; 56 : (suppl 1)
:S112.–S122. 4.
Guidotti
LG
,
Rochford
R
,
Chung
J
, et al.
Viral clearance without destruction of infected cells during acute HBV infection . Science.
1999; ; 284 : :825.–829. 5.
Phillips
S
,
Chokshi
S
,
Riva
A
, et al.
CD8(+) T cell control of hepatitis B virus replication: direct comparison between cytolytic and noncytolytic functions . J Immunol.
2010; ; 184 : :287.–295. 6.
Lucifora
J
,
Xia
Y
,
Reisinger
F
, et al.
Specific and nonhepatotoxic degradation of nuclear hepatitis B virus cccDNA . Science.
2014; ; 343 : :1221.–1228. 7.
Biermer
M
,
Puro
R
,
Schneider
RJ
. Tumor necrosis factor alpha inhibition of hepatitis B virus replication involves disruption of capsid Integrity through activation of NF-kappaB . J Virol.
2003; ; 77 : :4033.–4042. 8.
Wolf
MJ
,
Seleznik
GM
,
Zeller
N
,
Heikenwalder
M
. The unexpected role of lymphotoxin beta receptor signaling in carcinogenesis: from lymphoid tissue formation to liver and prostate cancer development . Oncogene.
2010; ; 29 : :5006.–5018. 9.
Bock
CT
,
Schwinn
S
,
Locarnini
S
, et al.
Structural organization of the hepatitis B virus minichromosome . J Mol Biol.
2001; ; 307 : :183.–196. 10.
Lee
TH
,
Elledge
SJ
,
Butel
JS
. Hepatitis B virus X protein interacts with a probable cellular DNA repair protein . J Virol.
1995; ; 69 : :1107.–1114. 11.
Smith
HC
,
Bennett
RP
,
Kizilyer
A
, et al.
Functions and regulation of the APOBEC family of proteins . Sem Cell Dev Biol.
2012; ; 23 : :258.–268. |