| |
| Med Sci (Paris). 2014 August; 30(8-9): 742–744. Published online 2014 September 1. doi: 10.1051/medsci/20143008009.Régulation de la visibilité immunologique par le récepteur de l’EGF Pierre Vantourout1,2* and Adrian Hayday1,2,3,4** 1Peter Gorer Department of Immunobiology, King’s College London, London, Royaume-Uni 2London Research Institute, Cancer Research UK, London, Royaume-Uni 3Medical Research Council Centre for Transplantation Biology, London, Royaume-Uni 4Comprehensive Biomedical Research Centre of Guy’s and St Thomas’ Hospitals and King’s College London, Great Maze Pond, SE1 9RTLondon, Royaume-Uni MeSH keywords: Animaux, Présentation d'antigène, génétique, Humains, Immunité innée, Lymphocytes, immunologie, Souris, Sous-famille K des récepteurs de cellules NK de type lectine, physiologie, Tumeurs, Stabilité de l'ARN, Récepteur du facteur de croissance épidermique, Stress physiologique, Échappement de la tumeur à la surveillance immunitaire |
Le terme « visibilité immunologique » désigne l’ensemble des phénomènes permettant au système immunitaire de détecter tout statut anormal des cellules de l’organisme. Traditionnellement, ceux-ci furent principalement considérés dans le contexte des infections, comme par exemple la présentation, par les complexes majeurs d’histocompatibilité (CMH), d’antigènes du « non-soi » dérivant de protéines exprimées par des agents pathogènes. Il est à présent très bien établi que le système immunitaire est également capable de détecter des dérégulations cellulaires causées par divers types de stress dits « stériles », tels que des perturbations physico-chimiques ou une transformation tumorale. Cette « réponse lymphoïde au stress » (RLS) [
1] est principalement le résultat de la détection du « soi modifié » par les cellules du système immunitaire via la reconnaissance, par divers récepteurs activateurs, de protéines endogènes qui, normalement, ne sont pas exprimées à la surface des cellules saines. |
NKG2D, un élément clé de la réponse lymphoïde au stress NKG2D, un récepteur activateur appartenant à la superfamille des lectines de type C, est exprimé par la plupart des cellules natural killer (NK) et par la majorité des sous-populations lymphocytaires T cytotoxiques (lymphocytes T CD8+, γδ, et NKT). Il reconnaît de nombreux ligands dits « de stress », MICA/B (major histocompatibility complex class I-related chain A/B) et ULBP1-6 (UL16 binding protein 1 to 6) chez l’homme, qui sont apparentés au complexe majeur d’histocompatibilité de classe I, mais ne présentent pas de peptides antigéniques. Après leur découverte, il fut rapidement établi que ces ligands sont régulés par choc thermique et surexprimés par de nombreuses lignées tumorales, mais pas par la grande majorité des cellules saines, suggérant que leur expression avertit le système immunitaire d’une situation de stress anormale. L’importance de la reconnaissance de ces ligands dans l’activation de réponses immunitaires variées est également soulignée par le fait qu’ils sont fréquemment la cible de mécanismes d’évasion - visant à réduire leur immunogénicité - de la part de divers virus ainsi que de cellules tumorales [
2,
3]. Plus récemment, l’activation de l’expression des ligands de NKG2D en réponse aux dommages à l’ADN a été décrite, principalement dans des systèmes expérimentaux murins [
4]. Nous avons exploré à nouveau ce concept dans le contexte de divers stress stériles appliqués à des cellules épithéliales humaines. |
Le récepteur de l’EGF régule l’expression des ligands de NKG2D L’activation de l’EGFR induit l’expression des ligands de NKG2D Nous avons initialement observé une forte surexpression des ARNm codant pour divers ligands de NKG2D après traitement de cellules épithéliales par une dose modérée d’UVB (rayons ultraviolets) [
5], une approche souvent utilisée pour induire des dommages à l’ADN. Toutefois, une telle surexpression ne fut pas observée dans les cellules traitées par divers agents chimiques génotoxiques. L’irradiation par UVB peut également induire une transactivation de la signalisation par plusieurs récepteurs de facteurs de croissance, tels que le récepteur de l’EGF (EGFR, epidermal growth factor receptor) [
6], par divers mécanismes moléculaires tels que l’inactivation de phosphatases ou le clivage de pro-facteurs de croissance membranaires [
7,
8]. L’inhibition de ce récepteur causa une forte diminution de la surexpression des ligands de NKG2D en réponse à l’irradiation par UVB. Ceci fut également observé pour d’autres types de stress stériles tels qu’un choc osmotique ou un stress oxydatif, dont on sait qu’ils peuvent aussi transactiver l’EGFR [
9,
10]. Inversement, le traitement des cellules par l’EGF entraîna une augmentation rapide de l’expression des transcrits codant pour les ligands de NKG2D, accompagnée d’une surexpression des protéines à la surface des cellules. Cette augmentation, bien que modérée, fut toutefois détectée par les cellules NK et les lymphocytes T γδ, principaux acteurs de la réponse lymphoïde au stress. L’EGFR agit via la stabilisation des ARNm La surexpression des ligands de NKG2D induite par l’EGF persista après l’inhibition globale de la transcription par un traitement des cellules par l’actinomycine D, suggérant que le mécanisme responsable implique une stabilisation des ARNm, et non leur expression de novo. La stabilité des ARNm est principalement régulée par divers motifs nucléotidiques situés dans la région 3’ non traduite (3’UTR). L’analyse des séquences de plusieurs ligands humains de NKG2D révéla la présence d’une classe spécifique de tels motifs, appelées AU- rich elements (ARE) [
11], qui sont généralement responsables d’une diminution basale de la stabilité des ARNm pouvant être régulée par divers mécanismes de signalisation. La fusion du 3’UTR de MICA à divers gènes rapporteurs indiqua son potentiel de déstabilisation. L’implication de l’ARE fut confirmée par la génération de mutants de cette séquence. Le facteur de déstabilisation des ARNm AUF1 [
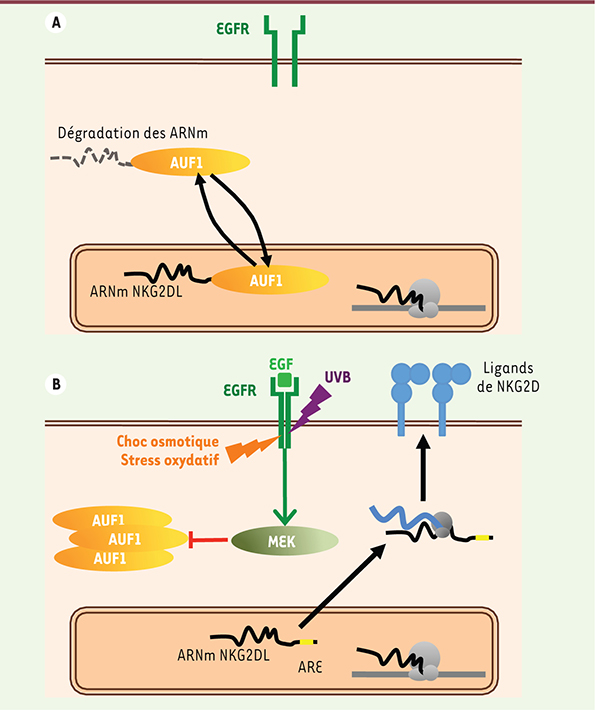
12] fut identifié comme étant un des éléments responsables de la restriction de l’expression des ligands de NKG2D. Généralement, la fonction des protéines déstabilisant les ARNm requiert leur constant transit entre le noyau, où ils lient leurs cibles, et le cytoplasme, où les ARNm sont séquestrés et/ou dégradés. Nous avons pu faire le lien entre l’EGFR et la stabilisation des ARNm des ligands de NKG2D : en effet, dans les cellules traitées par l’EGF, AUF1 était totalement exclu du compartiment nucléaire. Cette exclusion, ainsi que la surexpression des ligands de NKG2D à la surface cellulaire, furent inhibées par le blocage de MEK (mitogen-activated extracellular signal-regulated protein kinase), une des MAPK (mitogen-activated protein kinase) majeures en aval de l’EGFR (Figure 1).
 | Figure 1.
Mécanisme de surexpression des ligands de NKG2D par l’EGFR. A. En conditions normales, les ARNm des ligands de NKG2D (NKG2DL) sont constitutivement ciblés pour être dégradés, via la liaison de AUF1 à leurs séquences ARE. B. L’activation de l’EGFR, soit par des taux élevés de son ligand EGF, soit par plusieurs stress physicochimiques, entraîne l’exclusion d’AUF1 du compartiment nucléaire via MEK, et donc la stabilisation des ARNm codant pour les ligands de NKG2D et l’expression de ces derniers à la surface des cellules ; ils peuvent ainsi être reconnus par les lymphocytes cytotoxiques exprimant NKG2D. |
Pour finir, l’analyse de données de microarray générées à partir d’échantillons de plus de 170 tumeurs primaires du sein révéla une corrélation positive entre les niveaux d’expression de l’EGFR et des ligands de NKG2D, et une corrélation négative entre ceux de AUF1 et de LRIG1 (leucine-rich repeats and immunoglobulin-like domains protein 1, un inhibiteur cellulaire du récepteur de l’EGF) et les ligands de NKG2D. De plus, le traitement in vitro de lignées cellulaires par divers inhibiteurs de l’EGFR utilisés en clinique dans le traitement de nombreuses tumeurs solides, entraîna également une diminution de l’expression des ligands de NKG2D, suggérant donc un effet secondaire potentiellement délétère du traitement antitumoral envers la réponse immunitaire dirigée contre les cellules tumorales. |
Nos travaux décrivent un nouveau mécanisme de surexpression des ligands de NKG2D par divers phénomènes de stress cellulaire (Figure 1), et contribuent donc à accroître nos connaissances des mécanismes régissant l’expression de protéines jouant un rôle clé dans la détection de dérégulations cellulaires par le système immunitaire, en particulier dans le contexte du cancer [
13]. Des mutations activatrices du récepteur à l’EGF sont fréquemment observées dans de nombreux types de tumeurs solides. De ce fait, l’EGFR est une cible thérapeutique majeure de plusieurs classes d’inhibiteurs anticancéreux utilisés en clinique (tels que l’erlotinib ou le cétuximab) [
14]. Bien que ces traitements puissent limiter la croissance des tumeurs, nos résultats suggèrent qu’ils pourraient, concomitamment, diminuer la reconnaissance des cellules tumorales par diverses cellules du système immunitaire. Un tel effet suppresseur pourrait également être en partie responsable du développement de rash cutanés causés par Staphylococcus aureus, fréquemment observés chez les patients recevant un traitement par un anti-EGFR [
15]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Hayday
AC
. Gammadelta T cells and the lymphoid stress-surveillance response . Immunity.
2009; ; 31 : :184.–196. 2.
Waldhauer
I
,
Goehlsdorf
D
,
Gieseke
F
, et al.
Tumor-associated MICA is shed by ADAM proteases . Cancer Res.
2008; ; 68 : :6368.–6376. 3.
Wilkinson
GW
,
Tomasec
P
,
Stanton
RJ
, et al.
Modulation of natural killer cells by human cytomegalovirus . J Clin Virol.
2008; ; 41 : :206.–212. 4.
Gasser
S
,
Orsulic
S
,
Brown
EJ
,
Raulet
DH
. The DNA damage pathway regulates innate immune system ligands of the NKG2D receptor . Nature.
2005; ; 436 : :1186.–1190. 5.
Vantourout
P
,
Willcox
C
,
Turner
A
, et al.
Immunological visibility: posttranscriptional regulation of human NKG2D ligands by the EGF receptor pathway . Sci Transl Med.
2014; ; 6 : :231.ra249. 6.
Zheng
ZS
,
Chen
RZ
,
Prystowsky
JH
. UVB radiation induces phosphorylation of the epidermal growth factor receptor, decreases EGF binding and blocks EGF induction of ornithine decarboxylase gene expression in SV40-transformed human keratinocytes . Exp Dermatol.
1993; ; 2 : :257.–265. 7.
Gross
S
,
Knebel
A
,
Tenev
T
, et al.
Inactivation of protein-tyrosine phosphatases as mechanism of UV-induced signal transduction . J Biol Chem.
1999; ; 274 : :26378.–26386. 8.
Singh
B
,
Schneider
M
,
Knyazev
P
,
Ullrich
A
. UV-induced EGFR signal transactivation is dependent on proligand shedding by activated metalloproteases in skin cancer cell lines . Int J Cancer.
2009; ; 124 : :531.–539. 9.
Cheng
H
,
Kartenbeck
J
,
Kabsch
K
, et al.
Stress kinase p38 mediates EGFR transactivation by hyperosmolar concentrations of sorbitol . J Cell Physiol.
2002; ; 192 : :234.–243. 10.
Knebel
A
,
Rahmsdorf
HJ
,
Ullrich
A
,
Herrlich
P
. Dephosphorylation of receptor tyrosine kinases as target of regulation by radiation, oxidants or alkylating agents . EMBO J.
1996; ; 15 : :5314.–5325. 11.
Khabar
KS
. Post-transcriptional control during chronic inflammation and cancer: a focus on AU-rich elements . Cell Mol Life Sci.
2010; ; 67 : :2937.–2955. 12.
White
EJ
,
Brewer
G
,
Wilson
GM
. Post-transcriptional control of gene expression by AUF1: mechanisms, physiological targets, and regulation . Biochim Biophys Acta.
2013; ; 1829 : :680.–688. 13.
Raulet
DH
,
Gasser
S
,
Gowen
BG
, et al.
Regulation of Ligands for the NKG2D Activating Receptor . Annu Rev Immunol.
2013; ; 31 ::413.–441. 14.
Zhang
H
,
Berezov
A
,
Wang
Q
, et al.
ErbB receptors: from oncogenes to targeted cancer therapies . J Clin Invest.
2007; ; 117 : :2051.–2058. 15.
Mascia
F
,
Lam
G
,
Keith
C
, et al.
Genetic ablation of epidermal EGFR reveals the dynamic origin of adverse effects of anti-EGFR therapy . Sci Transl Med.
2013; ; 5 : :199.ra210. |