| |
| Med Sci (Paris). 2014 October; 30(10): 834–836. Published online 2014 October 14. doi: 10.1051/medsci/20143010005.L’érythroferrone, un régulateur érythroïde du métabolisme du fer Léon Kautz1* 1Department of Medicine ; David Geffen School of Medicine, University of California, Los Angeles, UCLA, department of Medicine, 10833 LeConte avenue, CHS37-131, CA90095Los Angeles, CA, États-Unis MeSH keywords: Animaux, Clonage moléculaire, Complément C1q, génétique, Cytokines, métabolisme, Cellules érythroïdes, Érythropoïèse, Hepcidines, Humains, Fer, Souris, Souris knockout, Protéines du muscle, Similitude de séquences, Facteur de nécrose tumorale alpha, bêta-Thalassémie |
Le fer est un élément indispensable à de nombreux processus biologiques comme la respiration cellulaire, la réparation et la synthèse d’ADN ou le transport de l’oxygène via l’hémoglobine. La production et la maturation des précurseurs des érythrocytes dans la moelle osseuse mobilisent les deux tiers du fer présent dans l’organisme. Chez l’homme, la majeure partie de ce fer provient du recyclage des globules rouges sénescents par les macrophages. Une partie du fer disponible est également stockée dans les hépatocytes par la ferritine. En conditions physiologiques, l’absorption intestinale du fer alimentaire est suffisante pour compenser les pertes minimes occasionnées par la sueur, la desquamation des cellules et les pertes sanguines. Le taux de fer dans l’organisme est contrôlé directement par un peptide hormonal produit par le foie, l’hepcidine, qui est le régulateur central de l’homéostasie martiale [
1] (Figure 1). L’hepcidine se fixe sur la ferroportine, le seul exportateur de fer connu à la surface des entérocytes, des hépatocytes et des macrophages. Cette interaction provoque l’ubiquitination, l’internalisation et la dégradation de la ferroportine [
2], avec pour conséquence la séquestration du fer dans ces cellules.
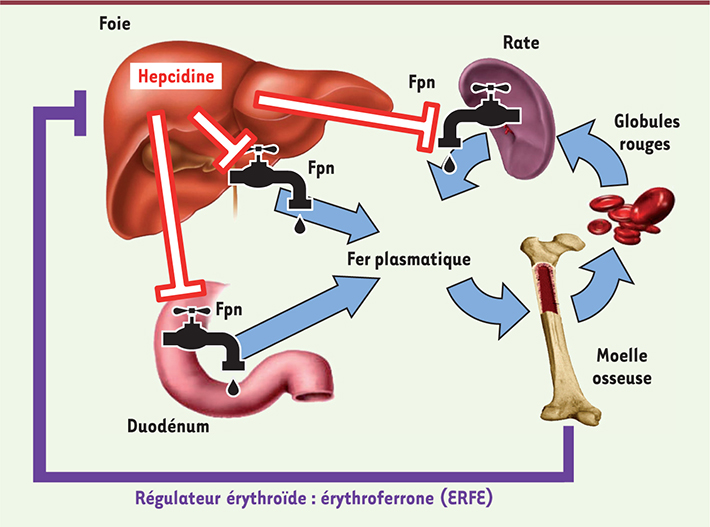
 | Figure 1.
L’hepcidine coordonne la disponibilité en fer pour l’érythropoïèse. L’hepcidine contrôle l’entrée du fer dans la circulation en fixant la ferroportine (Fpn) à la surface des entérocytes et des macrophages dans le foie et la rate. Ceci provoque la dégradation de la ferroportine, bloquant le fer dans ces cellules. En cas de besoin en fer accru lors d’une forte activité érythropoïétique, les précurseurs érythroïdes produisent un ou des facteurs appelé(s) régulateur(s) érythroïde(s), dont la fonction est de réprimer l’expression de l’hepcidine dans le foie afin d’augmenter la disponibilité en fer pour la moelle osseuse. Nos travaux décrivent l’identification d’un nouveau régulateur érythroïde, l’érythroferrone (ERFE) (© cette figure a été préalablement publiée dans Blood [
9]). |
|
Hepcidine, fer et érythropoïèse : la notion de régulateur érythroïde En cas de stimulation de l’érythropoïèse lors d’une hémorragie, d’une hémolyse ou toute autre condition déclenchant une érythropoïèse de stress, la synthèse de l’hémoglobine, et donc la consommation en fer par la moelle osseuse, sont augmentées afin de normaliser rapidement le nombre de globules rouges et la capacité de transport de l’oxygène. Pour faire face à ce besoin accru en fer, la production d’hepcidine diminue de manière à stabiliser la ferroportine à la surface des cellules qui l’expriment, ce qui conduit à l’augmentation de l’absorption du fer alimentaire au niveau du duodénum et du relargage du fer par les macrophages et les hépatocytes. Jusqu’à récemment, le lien entre l’augmentation de l’érythropoïèse, la modulation de la production d’hepcidine et la disponibilité en fer était mal caractérisé. Il était communément admis qu’un facteur inconnu, historiquement désigné sous le nom de « régulateur érythroïde » [
3], contrôlait ce processus. L’érythropoïèse est régulée principalement par l’érythropoïétine (EPO), un facteur de croissance indispensable à la survie et à la prolifération des précurseurs érythroïdes. Dans des conditions particulières telles qu’une anémie ou une l’hypoxie, le taux d’EPO augmente conjointement à la diminution de l’expression de l’hepcidine. Les données de la littérature suggéraient que la régulation de l’hepcidine n’était pas directement dictée par l’EPO, mais impliquait un facteur rapidement produit par les précurseurs érythroïdes de la moelle osseuse, puis sécrété dans la circulation pour réprimer la production d’hepcidine afin d’augmenter la quantité de fer disponible pour la synthèse de nouveaux globules rouges par la moelle osseuse [
4–
7]. |
Les troubles du métabolisme du fer et de l’érythropoïèse Les régulateurs érythroïdes peuvent causer des complications cliniques sévères chez les patients atteints de thalassémie ou d’anémie dysérythropoïétique congénitale. Ces pathologies, qui ont en commun une érythropoïèse inefficace, s’accompagnent d’un niveau d’EPO sérique élevé et d’une production massive de précurseurs érythroïdes qui subissent une apoptose accélérée au stade d’érythroblaste. Ceci a pour conséquence une importante diminution de la production de l’hepcidine [
8]. La suppression pathologique de la synthèse de l’hepcidine conduit à une hyperabsorption du fer alimentaire et à une surcharge en fer multiviscérale délétère, indépendante du fait que les patients soient transfusés ou non. Le régulateur érythroïde responsable de ces effets exercerait donc son action inhibitrice sur l’expression de l’hepcidine non seulement dans la phase de récupération après une hémorragie, mais aussi dans les pathologies associées à une érythropoïèse inefficace, ces conditions ayant en commun un niveau élevé d’EPO et l’expansion des compartiments érythroïdes. Bien que plusieurs candidats aient été proposés comme régulateurs érythroïdes potentiels (GDF15 [growth differentiation factor 15], TWSG1 [twisted gastrulation BMP signaling modulator 1] etc.), leur importance physiologique dans cette régulation reste à confirmer [9]. |
L’érythroferrone, un nouveau régulateur érythroïde de l’hepcidine Nous avons récemment identifié un nouveau facteur : l’érythroferrone (ERFE) — une hormone appartenant à la famille de protéines C1q/TNF (tumor necrosis factor) — [
10], qui pourrait être le régulateur érythroïde recherché de longue date (Figure 2). En réponse à l’EPO, la synthèse d’ERFE est rapidement induite dans les précurseurs érythroïdes de la moelle osseuse et de la rate via la voie de signalisation JAK2/STAT5. Nous avons montré que les souris invalidées pour ERFE sont incapables de réprimer l’expression de l’hepcidine après phlébotomie ou administration d’EPO. ERFE est donc absolument indispensable pour diminuer rapidement l’expression de l’hepcidine lors d’une demande accrue de l’érythropoïèse. Ces souris Erfe-/-
présentent des paramètres hématologiques normaux, suggérant qu’ERFE n’est pas un acteur majeur de l’érythropoïèse en conditions physiologiques normales, mais que son rôle serait restreint aux situations d’érythropoïèse de stress. Á noter cependant que lors de la phase de croissance rapide et d’expansion érythroïde chez des souris juvéniles (entre 3 et 6 semaines) dépourvues d’ERFE, une érythropoïèse active est suffisante pour occasionner une légère anémie transitoire chez ces animaux. In vivo, l’injection directe de la protéine ERFE, ou sa surexpression à l’aide d’un vecteur lentiviral, a confirmé son action suppressive sur l’expression de l’hepcidine. De plus, l’expression de l’ARN messager de l’hepcidine est diminuée de façon très significative lorsque des hépatocytes primaires de souris sont traités par de l’érythroferrone recombinante. Bien que ni le récepteur d’ERFE ni la voie de signalisation qu’il induit ne soient actuellement identifiés, nos données suggèrent qu’ERFE agirait directement sur les hépatocytes pour réprimer la transcription de l’hepcidine. Nos travaux révèlent également qu’ERFE pourrait jouer un rôle important dans la bêta thalassémie.
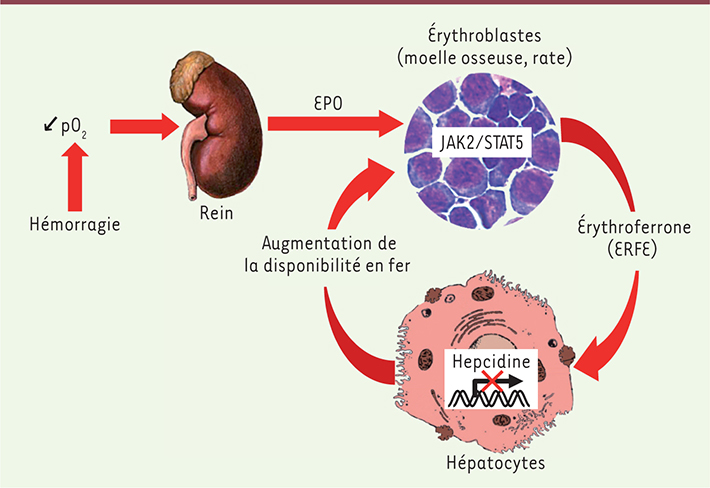
 | Figure 2.
Mécanisme d’action de l’érythroferrone. Après une hémorragie ou une hémolyse, la diminution de la concentration en oxygène conduit à la production d’EPO par le rein. L’EPO se fixe à son récepteur à la surface des précurseurs érythroïdes dans la moelle osseuse et la rate et stimule la voie de signalisation JAK2/STAT5 et la production rapide d’érythroferrone. ERFE est ensuite sécrétée dans la circulation et agit directement sur les hepatocytes pour réprimer l’expression de l’hepcidine et ainsi augmenter la disponibilité en fer pour la synthèse de nouveaux globules rouges. Le récepteur d’ERFE et la voie de signalisation menant à la diminution de l’hepcidine sont en cours d’identification (© cette figure a été préalablement publiée dans Blood [ 9]). |
Dans le modèle murin de cette pathologie (Hbbth3/th3
), le taux d’ARN messager d’Erfe est très significativement augmenté dans la moelle osseuse et la rate. De façon intéressante, l’invalidation du gène Erfe chez les souris thalassémiques Hbbth3/th3
conduit au rétablissement du niveau physiologique d’hepcidine et à une diminution significative de la sidérémie et de la surcharge en fer dans le foie. ERFE pourrait donc également agir comme répresseur de l’hepcidine dans certaines pathologies humaines. Une étude plus approfondie chez les patients atteints de bêta-thalassémie ou d’autres formes d’anémie héréditaire est désormais nécessaire afin de confirmer que l’érythroferrone est le régulateur érythroïde responsable de la diminution de l’hepcidine et de la surcharge martiale chez ces patients. |
Nos travaux ont mis en évidence le rôle fondamental de l’érythroferrone, un nouveau facteur érythroïde, dans la régulation physiopathologique de l’hepcidine lors d’une érythropoïèse accrue. Notre équipe développe actuellement une méthode de dosage de l’érythoferrrone afin d’étudier son rôle chez l’homme. Enfin, nos travaux montrent qu’ERFE est une nouvelle cible thérapeutique. En l’inhibant, on pourrait augmenter la production d’hepcidine chez les patients atteints d’anémie héréditaire avec surcharge en fer. Au contraire, en l’administrant à des patients présentant une anémie associée à une maladie inflammatoire, une affection rénale chronique ou un cancer, on pourrait corriger le déficit en fer lié à un excès d’hepcidine. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Aux Docteurs Tomas Ganz et Elizabeta Nemeth pour leur mentorat ; aux Docteurs Anaïs Briot, Hélène Coppin, Marie-Paule Roth et Bertrand Grenier pour leur aide dans la préparation de ce manuscrit.
|
1.
Ganz
T
,
Nemeth
E
. Hepcidin and disorders of iron metabolism . Annu Rev Med.
2011; ; 62 : :347.–360. 2.
Qiao
B
,
Sugianto
P
,
Fung
E
, et al.
Hepcidin-induced endocytosis of ferroportin is dependent on ferroportin ubiquitination . Cell Metab.
2012; ; 15 : :918.–924. 3.
Finch
C
. Regulators of iron balance in humans . Blood.
1994; ; 84 : :1697.–1702. 4.
Ashby
DR
,
Gale
DP
,
Busbridge
M
, et al.
Erythropoietin administration in humans causes a marked and prolonged reduction in circulating hepcidin . Haematologica.
2010; ; 95 : :505.–508. 5.
Mastrogiannaki
M
,
Matak
P
,
Mathieu
JRR
, et al.
Hepatic hypoxia-inducible factor-2 down-regulates hepcidin expression in mice through an erythropoietin-mediated increase in erythropoiesis . Haematologica.
2012; ; 97 : :827.–834. 6.
Pak
M
,
Lopez
MA
,
Gabayan
V
, et al.
Suppression of hepcidin during anemia requires erythropoietic activity . Blood.
2006; ; 108 : :3730.–3735. 7.
Vokurka
M
,
Krijt
J
,
Sulc
K
,
Necas
E
. Hepcidin mRNA levels in mouse liver respond to inhibition of erythropoiesis . Physiol Res.
2006; ; 55 : :667.–674. 8.
Origa
R
,
Galanello
R
,
Ganz
T
, et al.
Liver iron concentrations and urinary hepcidin in beta-thalassemia . Haematologica.
2007; ; 92 : :583.–588. 9.
Kautz
L
,
Nemeth
E
. Molecular liaisons between erythropoiesis and iron metabolism . Blood.
2014; ; 124 : :479.–482. 10.
Kautz
L
,
Jung
G
,
Valore
EV
, et al.
Identification of erythroferrone as an erythroid regulator of iron metabolism . Nat Genet.
2014; ; 46 : :678.–684. |