| |
| Med Sci (Paris). 2014 October; 30(10): 896–901. Published online 2014 October 14. doi: 10.1051/medsci/20143010017.L’excrétion trans-intestinale de cholestérol (TICE) Une nouvelle voie d’épuration du cholestérol plasmatique Claire Blanchard,1# François Moreau,1# Bertrand Cariou,1 and Cédric Le May1* 1IRS-UN, institut du thorax, unité Inserm UMR 1087/CNRS UMR 6291, 8, quai Moncousu, 44007Nantes Cedex 1, France |
La rédaction de cet article1 intervient à la veille d’une nouvelle étude réalisée par l’unité de surveillance et d’épidémie nutritionnelles dans le cadre du programme national nutrition-santé 2011-2015 visant, entre autres, à déterminer l’état nutritionnel des Français. Il a ainsi été estimé en 2007 que 37,4 % des Français âgés de 65 à 74 ans étaient traités par des molécules hypolipémiantes. L’hypercholestérolémie constitue un des facteurs de risque cardiovasculaires modifiables, et des bénéfices cardiovasculaires sont associés à une diminution de la concentration en LDL (low density lipoprotein)-cholestérol (LDLc). Les statines, qui ciblent spécifiquement le LDLc, sont prescrites en première intention, surtout en prévention secondaire des maladies cardiovasculaires. Néanmoins, elles ne permettent pas, chez les patients à très haut risque cardiovasculaire, d’atteindre les objectifs thérapeutiques recommandés (LDLc < 0,7 g/l) [
1]. De nouvelles recherches sont donc en cours pour identifier de nouvelles stratégies thérapeutiques visant à réduire le LDLc [
2]. |
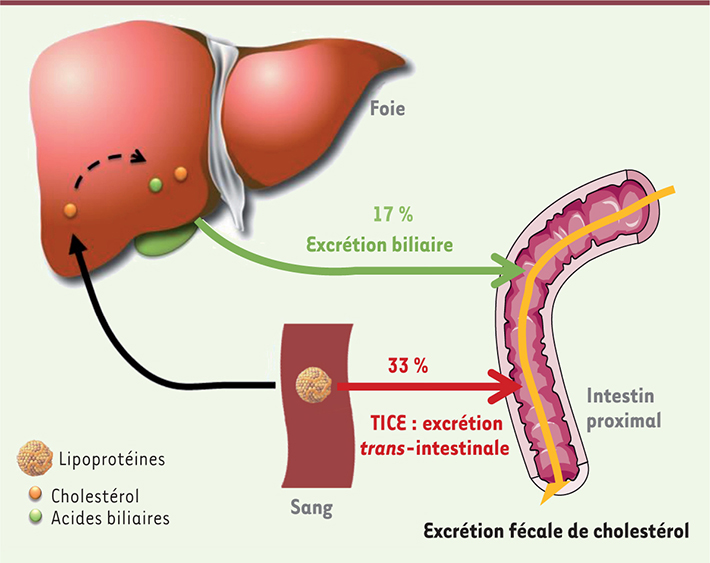
Arguments en faveur d’une excrétion trans-intestinale de cholestérol Jusqu’à récemment, la voie hépatobiliaire était considérée comme la seule voie d’élimination du cholestérol sanguin (Figure 1). Celui-ci est capté par le foie, puis excrété dans la bile via le canal cholédoque, sous forme de cholestérol ou après sa conversion en acides biliaires. Une fois dans l’intestin, le cholestérol est soit réabsorbé (environ 50 %), soit éliminé dans les fèces.
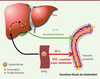 | Figure 1.
Représentation schématique de l’excrétion trans-intestinale de cholestérol et de l’excrétion biliaire.
|
Cependant, une altération de l’excrétion biliaire de cholestérol n’a pas nécessairement de conséquence sur l’excrétion fécale de cholestérol [
3]. Ainsi, Sperry en 1927 ou Pertsemlidis et al. en 1973, ont montré que des chiens porteurs d’une dérivation externe de la voie biliaire excrétaient beaucoup plus de cholestérol dans leurs fèces qu’attendu [
4]. L’émergence de modèles de rongeurs génétiquement modifiés a permis de confirmer ces premières observations. Ainsi, chez les souris déficientes en transporteurs ABCG5 (ATP-binding cassette G5) et ABCG8, l’excrétion biliaire de cholestérol est réduite de 90 % sans que l’absorption intestinale de cholestérol ne soit altérée [
5]. Toutefois, ces souris ne présentent qu’une baisse modérée, de l’ordre de 30 à 50 %, de l’excrétion fécale de cholestérol [5]. Les souris déficientes pour le transporteur ABCB4, que caractérise une altération majeure de l’excrétion biliaire des phospholipides et du cholestérol, conservent la capacité d’excréter par voie fécale du cholestérol radiomarqué préalablement injecté par voie veineuse [
6]. Enfin, la surexpression hépatique du transporteur Niemann-Pick C1-like 1 (NPC1L1) chez la souris (souris transgéniques NPC1L1) entraîne la réabsorption par les hépatocytes de 90 % du cholestérol excrété dans la bile sans pour autant altérer l’excrétion biliaire des phospholipides et des acides biliaires, l’absorption intestinale ou l’excrétion fécale du cholestérol [
7]. L’ensemble de ces travaux suggèrent indirectement l’existence d’une voie alternative intestinale permettant l’élimination directe du cholestérol plasmatique. En 2007, l’équipe hollandaise de Groen a apporté la première démonstration de l’existence d’une excrétion trans-intestinale de cholestérol sanguin (TICE) (Figure 1) [
8]. Les chercheurs ont créé une dérivation de la voie biliaire et perfusé la lumière intestinale avec une solution iso-osmotique contenant des accepteurs de cholestérol ; puis ils ont mesuré, 30 minutes après l’injection par voie veineuse de cholestérol radioactif, son apparition dans les perfusats intestinaux. Enfin, ce même groupe a démontré que le TICE est principalement actif dans la partie proximale de l’intestin ; les auteurs ont estimé que, chez des souris C57BL6, 33 % du cholestérol fécal proviendraient du TICE, alors que 17 % proviendraient de la voie biliaire. Ces résultats font du TICE une voie majeure d’épuration du cholestérol de l’organisme [
9]. Cependant, la contribution relative cette voie à l’excrétion fécale de cholestérol est probablement dépendante du fonds génétique de la souris étudiée ; chez les souris FVB (Friend virus B-type), la contribution du TICE serait de 20 % [6]. À l’heure actuelle, les mécanismes moléculaires régulant cette voie métabolique restent très mal caractérisés. Cette revue résume les connaissances actuellement disponibles sur le TICE. |
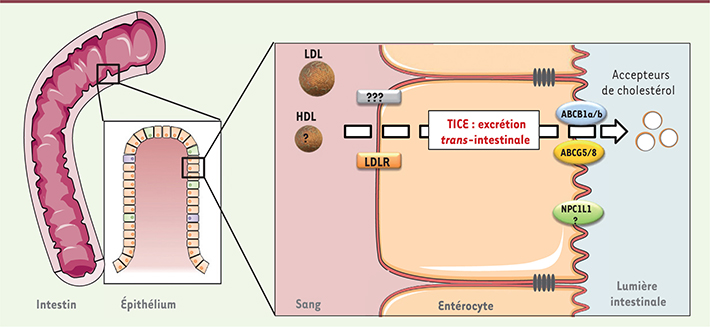
Quelles lipoprotéines fournissent le cholestérol au TICE ? Le cholestérol, du fait de son hydrophobicité, circule au niveau sanguin dans des complexes moléculaires sphériques constitués de lipides et de protéines (apolipoprotéines, Apo) nommés lipoprotéines. On distingue deux grandes classes de lipoprotéines : les lipoprotéines à Apo-B (chylomicrons, VLDL [very low density lipoprotein], LDL) et les lipoprotéines à Apo-A (HDL, high density lipoprotein). L’une des questions actuellement étudiée est de savoir quelle lipoprotéine fournit préférentiellement le cholestérol pour le TICE. Plusieurs études suggèrent que ce sont les lipoprotéines à Apo-B (Figure 2). Ainsi, nous avons montré, in vivo chez la souris et ex vivo sur des explants de souris sauvages et sur des biopsies jéjunales humaines, que les LDL étaient capables d’apporter du cholestérol au TICE [
10]. La même année, Marschall et al. ont mis en évidence que les VLDL étaient probablement également impliquées. Ainsi, la réduction de production de VLDL par l’administration d’oligonucléotides antisens dirigés contre la protéine microsomale de transfert des triglycérides (MTP, microsomal triglyceride transfer protein) réduit significativement le TICE [
11]. Le rôle des HDL dans le TICE reste à ce jour plus débattu. Plösch et al. ont montré que l’activation des récepteurs nucléaires LXR (liver X receptor) augmente l’excrétion fécale de cholestérol de façon similaire chez les souris sauvages et les souris invalidées pour le transporteur ABCA1, chez lesquelles on observe une quasi absence de HDL circulants [
12]. De même, les agonistes LXR, des stimulateurs reconnus du TICE (voir plus loin [6, 9]), réduisent dans les mêmes conditions expérimentales l’accumulation intestinale d’éther de cholestérol (cholestérol non métabolisable) provenant d’HDL, faisant douter de l’importance fonctionnelle des HDL dans le TICE [
13]. Deux études récentes ont mesuré de façon directe le TICE après une injection intraveineuse d’HDL marqués au cholestérol radioactif. La première suggère que les HDL ont un rôle négligeable dans le TICE [
14]. Dans la seconde, nous avons montré que l’activité du TICE est comparable lorsque le cholestérol est apporté par des HDL ou des LDL [10]. Clairement, des études plus approfondies seront nécessaires pour valider ou invalider le rôle physiologique des HDL dans le TICE (Figure 2).
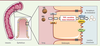 | Figure 2.
Acteurs moléculaires impliqués dans le TICE. Certains acteurs impliqués ou potentiellement impliqués dans le TICE sont représentés : les LDL et leur récepteur (LDLR), les HDL et certains transporteurs intestinaux (ABCB1a/b, ABCG5/8 et NPC1L1). |
|
Identification des transporteurs de cholestérol impliqués dans le TICE Le récepteur scavenger de classe BI (SRBI), connu pour interagir avec les LDL et HDL, est exprimé au niveau apical et basolatéral des entérocytes. Van der Velde et al. ont montré que des souris FVB, nourries avec un régime hyperlipidique ou de type western, ont un TICE significativement augmenté par rapport aux souris soumises à un régime contrôle [
15] (voir plus loin), et ces régimes induisent également l’expression intestinale de SRBI [15]. Au vu de cette corrélation, les auteurs ont suggéré que SRBI pourrait être impliqué de façon active dans le TICE. Néanmoins, chez des souris SRBI knocked-out (KO), le TICE est, soit non modifié [14], soit significativement augmenté [15]. De même, une surexpression intestinale de SRBI chez des souris présentant un défaut d’excrétion biliaire de cholestérol n’a pas d’effet notable sur l’excrétion fécale de cholestérol [
16]. Ces résultats suggèrent que SRBI ne joue pas un rôle majeur sur l’activité du TICE. De manière alternative, il est également envisageable que la déficience totale de SRBI soit compensée par d’autres protéines exprimées au pôle basolatéral. Le récepteur des LDL (LDLR) est exprimé à la membrane basolatérale des entérocytes, où il assure l’essentiel du captage entérocytaire des LDL chez les rongeurs (Figure 2) [10]. Les souris déficientes en proprotéine convertase subtilisine kexin de type 9 (souris PCSK9), un inhibiteur naturel du LDLR, se caractérisent par une quantité élevée de LDLR intestinal et un TICE significativement augmenté par rapport à celui des souris sauvages [10]. À l’inverse, l’injection de protéine PCSK9 recombinante chez ces souris déficientes dégrade le LDLR intestinal et réduit de 35 % le TICE. L’effet inhibiteur de PCSK9 sur le TICE est dépendant du LDLR, car il n’est pas observé chez des souris LDLR-KO [10]. De façon concordante, les statines, qui augmentent l’expression du LDLR, stimulent le TICE chez des souris sauvages, mais sont sans effet chez des souris LDLR-KO. Ces résultats suggèrent que le LDLR est un acteur clé du TICE, car la modulation aiguë de son expression modifie les niveaux du TICE. Néanmoins, de manière inattendue, la déficience en LDLR chez la souris ne diminue pas le TICE, mais tend à l’augmenter, ce qui suggère la mise en place de voies alternatives de compensation à long terme, qui restent à identifier [10]. À l’heure actuelle, aucune protéine intracellulaire de l’entérocyte n’a été identifiée comme impliquée dans le transport du cholestérol via le TICE. Cependant, les protéines NPC1, NPC2, MLN64 (metastatic lymph node 64 protein, anciennement STARD3), ORP1L (oxysterol-binding protein 1L), LIMP2 (lysosomal integral membrane protein 2), ACAT2 (acetyl-CoA acetyltransferase 2), Rab7 et Rab9, constituent des candidats potentiels intéressants, compte tenu de leur rôle primordial dans le transport intracellulaire de cholestérol. Par ailleurs, l’activation du récepteur nucléaire PPARδ (peroxisome proliferator-activated receptor δ), un inducteur du TICE, augmente l’expression de Rab9 et LIMP2 au niveau intestinal [
17]. Au pôle apical des entérocytes, trois complexes protéiques ont été proposés comme contribuant au TICE (Figure 2). La protéine NPC1L1 a été initialement identifiée comme étant le transporteur clé de l’absorption intestinale de cholestérol et la cible moléculaire de l’ézétimibe, un hypolipémiant utilisé en clinique [
18]. Deux études utilisant l’ézétimibe pour inhiber NPC1L1 ont présenté des résultats contradictoires sur le TICE. La première étude a montré que l’ézétimibe était sans effet sur le TICE [17], tandis que la seconde a retrouvé une forte induction du TICE [
19]. L’hétérodimère ABCG5/ABCG8, impliqué initialement dans l’absorption intestinale du cholestérol, assure une partie de l’efflux apical du TICE (Figure 2). Si la déficience en ABCG8 n’a pas de conséquence sur le TICE [8], celle-ci est réduite de 40 % chez les souris ABCG5-KO par rapport aux souris sauvages [9]. Plus récemment, le rôle du transporteur aux xénobiotiques ABCB1 (ou PGP, permeability glycoprotein) a été exploré. ABCB1 est localisé sur la membrane apicale des entérocytes et son rôle dans la résistance aux antibiotiques est bien caractérisé [
20]. Nous avons montré, chez des souris déficientes pour les deux isoformes d’ABCB1, une réduction significative de l’excrétion fécale de cholestérol et une diminution de 20 % du TICE [10]. De même, l’utilisation d’un inhibiteur pharmacologique d’ABCB1, le PSC-833, réduit significativement le TICE ex vivo sur des explants de souris sauvages, mais est sans effet sur des explants de souris déficientes pour les deux formes d’ABCB1 [10]. |
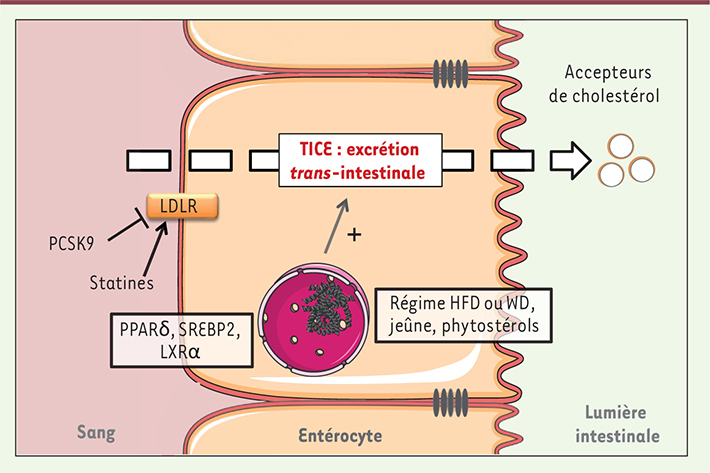
Le TICE : une voie métabolique inductible Chez la souris, le TICE est inductible et modulable par des éléments nutritionnels et pharmacologiques (Figure 3). Van der Velde et al. ont ainsi mis en évidence que la présence d’accepteurs du cholestérol dans la lumière intestinale le stimule fortement [8, 15]. En effet, in vivo, le TICE est détectable, mais faible, en l’absence d’accepteurs du cholestérol, et plus de 80 % du cholestérol présent dans les perfusats intestinaux ont alors pour origine la seule desquamation entérocytaire. Le taurocholate (TC), un acide biliaire, ou la phosphatidylcholine (PC) stimulent individuellement le TICE, mais avec une efficacité moindre que le mélange TC/PC. Ces molécules permettent la formation de micelles qui vont pouvoir solubiliser le cholestérol excrété par les cellules intestinales. De plus, chez la souris, il semble que le TICE soit peu sensible à la concentration des acides biliaires dans la lumière intestinale et au type d’acides présents [15].
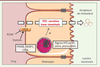 | Figure 3.
Modulateurs du TICE. Le TICE est régulé par le statut nutritionnel, les statines, les phytostérols, les agonistes des LXR, ainsi que par le PPARγ. SREBP2 : sterol regulatory element-binding protein 2 ; HFD : high fat diet ; WD : western diet. |
Le statut nutritionnel influe également sur le TICE. Celui-ci est ainsi stimulé respectivement de 50 ou 100 % par les régimes de type western ou hyperlipidique [8]. De plus, un jeûne de courte durée (12 h) réduit le TICE de 28 %, tandis qu’un jeûne prolongé (48 h) l’augmente de 50 % [
21]. En plus de leur effet inhibiteur sur l’absorption intestinale du cholestérol [
22], les phytostérols stimulent significativement le TICE (Figure 3) [
23]. Enfin, le TICE est induit par des agents pharmacologiques. L’activation de LXR le stimule fortement [6, 9]. Lorsque des souris sauvages sont nourries avec un régime contenant des agonistes des LXR, leur excrétion fécale de cholestérol est multipliée par trois et la contribution relative du TICE passe de 33 % à 63 % [9]. De même, l’activation de PPARδ [17] ou l’inhibition de NPC1L1 par l’ézétimibe chez la souris augmentent le TICE [19]. Enfin, les statines stimulent le TICE de 71 % et cette activation pourrait en partie contribuer à leur action hypocholestérolémiante (Figure 3) [10]. |
TICE et transport inverse du cholestérol Le transport inverse du cholestérol (RCT, reverse cholesterol transport) assure le retour du cholestérol des tissus périphériques vers le foie via les HDL, et son élimination par voie biliaire [
24]. L’activation de cette voie contribue à réduire le cholestérol contenu dans la plaque athéromateuse artérielle et, de ce fait, est considérée comme anti-athérogène. En 2010, une étude a remis en question le dogme faisant de la voie biliaire un élément essentiel du transport inverse du cholestérol. En effet, après l’injection de macrophages chargés en cholestérol tritié, l’excrétion fécale de cholestérol tritié était comparable chez des souris sauvages et des souris transgéniques NPC1L1 qui n’excrètent plus de cholestérol biliaire [7]. Ce résultat est extrêmement important, car il suggère qu’une stimulation thérapeutique du TICE pourrait avoir une action anti-athérogène. Toutefois, un an plus tard, une seconde équipe, à l’aide d’un autre modèle de souris présentant un défaut majeur d’excrétion biliaire (les souris ABCB4-KO), a abouti à la conclusion inverse, à savoir que l’intestin ne peut compenser le défaut hépatique [13]. Cette dernière observation a été renforcée par une autre étude reposant sur l’utilisation de souris NPC1L1-KO surexprimant ou non la protéine NPC1L1 au niveau hépatique [
25]. Chez ces souris NPC1L1-KO, caractérisées par un défaut majeur d’absorption intestinale de cholestérol, l’élimination du cholestérol macrophagique par la voie du transport inverse du cholestérol est dépendante d’une voie hépatobiliaire pleinement fonctionnelle [25]. Toutefois, une étude récente atteste de l’importance fonctionnelle du TICE dans le transport inverse du cholestérol. En effet, l’inhibition pharmacologique de la MTP (microsomal triglyceride transfer protein) stimule le transport inverse du cholestérol et l’excrétion fécale de cholestérol marqué d’origine macrophagique, sans pour autant augmenter l’excrétion biliaire de cholestérol marqué, suggérant un rôle de l’intestin [
26]. Le rôle du TICE dans le transport inverse du cholestérol demeure donc controversé. |
TICE : les données chez l’homme La preuve directe de l’existence d’une excrétion trans-intestinale de cholestérol chez l’homme doit être encore établie. La difficulté réside dans le fait que cette excrétion trans-intestinale et l’excrétion biliaire de cholestérol ont lieu dans la même région anatomique, au niveau de l’intestin proximal. Il est donc nécessaire d’avoir accès à des modèles porteurs d’une dérivation externe ou d’une obstruction complète de la voie hépatobiliaire. Néanmoins, quelques anciennes études cliniques suggèrent de manière indirecte l’existence du TICE chez l’homme. Les premières études, parues en 1959, ont mis en évidence, chez des patients présentant une obstruction de la voie biliaire (en raison d’une tumeur de la tête du pancréas), l’existence d’une excrétion intestinale de 250-400 mg/jour de cholestérol [
27,
28]. En utilisant un système de tube à triple lumière inséré dans l’intestin, Simmonds et al. ont estimé que l’intestin humain produisait 44 % de la quantité de cholestérol retrouvée au niveau des fèces [
29]. Cependant, il est impossible dans cette étude de déterminer les proportions de cholestérol provenant du TICE et de la desquamation des cellules intestinales. Récemment, nous avons apporté la première preuve que l’intestin humain cultivé ex vivo est capable d’excréter du cholestérol directement au niveau du pôle apical des entérocytes. En utilisant des biopsies jéjunales montées sur des chambres d’Ussing, nous avons pu mesurer le TICE en présence de cholestérol sous forme de LDL ou de HDL. De plus, le TICE a pu être stimulée par l’ajout, dans le compartiment apical, de milieu enrichi en phospholipides et en acides biliaires [10]. Dans une étude cinétique non publiée (International symposium on atherosclerosis 2012) utilisant des radio-isotopes stables, le groupe de A. Groen estime que le TICE serait à l’origine de plus de 30 % des pertes fécales totales des stérols neutres chez des hommes modérément hypercholestérolémiques. |
Le TICE représente une nouvelle voie d’excrétion du cholestérol qui reste à ce jour très mal caractérisée. La question de son implication dans le transport inverse du cholestérol est cruciale et la réponse déterminera si la stimulation spécifique de cette voie métabolique peut être utilisée pour réduire la cholestérolémie, ainsi que l’athérosclérose et ses conséquences cardiovasculaires. Si l’hypothèse de la stimulation pharmacologique du transport inverse du cholestérol par l’augmentation de l’excrétion biliaire de cholestérol est peu envisageable du fait des risques de développement de calculs biliaires, il n’existe pas à l’heure actuelle d’arguments suggérant que l’activation du TICE pourrait avoir des conséquences néfastes pour la santé. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1.
Catapano
AL
,
Chapman
J
,
Wiklund
O
,
Taskinen
MR
. The new joint EAS/ESC guidelines for the management of dyslipidaemias . Atherosclerosis.
2011; ; 217 : :3.–46. 2.
Costet
P
. Molecular pathways and agents for lowering LDL-cholesterol in addition to statins . Pharmacol Ther.
2010; ; 126 : :263.–278. 3.
Brufau
G
,
Groen
AK
,
Kuipers
F
. Reverse cholesterol transport revisited: contribution of biliary versus intestinal cholesterol excretion . Arterioscler Thromb Vasc Biol.
2011; ; 31 : :1726.–1733. 4.
Pertsemlidis
D
,
Kirchman
EH
,
Ahrens
EH
. Regulation of cholesterol metabolism in the dog I. Effects of complete bile diversion and of cholesterol feeding on absorption, synthesis, accumulation, and excretion rates measured during life. . J Clin Invest.
1973; ; 52 : :2353.–2367. 5.
Yu
L
,
Hammer
RE
,
Li-Hawkins
J
, et al.
Disruption of Abcg5 and Abcg8 in mice reveals their crucial role in biliary cholesterol secretion . Proc Natl Acad Sci USA.
2002; ; 99 : :16237.–16242. 6.
Kruit
JK
,
Plösch
T
,
Havinga
R
, et al.
Increased fecal neutral sterol loss upon liver X receptor activation is independent of biliary sterol secretion in mice . Gastroenterology.
2005; ; 128 : :147.–156. 7.
Temel
RE
,
Sawyer
JK
,
Yu
L
, et al.
Biliary sterol secretion is not required for macrophage reverse cholesterol transport . Cell Metab.
2010; ; 12 : :96.–102. 8.
Van der Velde
AE
,
Vrins
CL
,
Van den Oever
K
, et al.
Direct intestinal cholesterol secretion contributes significantly to total fecal neutral sterol excretion in mice . Gastroenterology.
2007; ; 133 : :967.–975. 9.
Van der Veen
JN
,
Van Dijk
TH
,
Vrins
CL
, et al.
Activation of the liver X receptor stimulates trans-intestinal excretion of plasma cholesterol . J Biol Chem.
2009; ; 284 : :19211.–19219. 10.
Le May
C
,
Berger
JM
,
Lespine
A
, et al.
Transintestinal cholesterol excretion is an active metabolic process modulated by PCSK9 and statin involving ABCB1 . Arterioscler Thromb Vasc Biol.
2013; ; 33 : :1484.–1493. 11.
Marshall
SM
,
Kelley
KL
,
Davis
MA
, et al.
Reduction of VLDL secretion decreases cholesterol excretion in Niemann-Pick C1-like 1 hepatic transgenic mice . PLoS One.
2014; ; 9 : :e84418.. 12.
Plösch
T
,
Kok
T
,
Bloks
VW
, et al.
Increased hepatobiliary and fecal cholesterol excretion upon activation of the liver X receptor is independent of ABCA1 . J Biol Chem.
2002; ; 277 : :33870.–33877. 13.
Nijstad
N
,
Gautier
T
,
Briand
F
, et al.
Biliary sterol secretion is required for functional in vivo reverse cholesterol transport in mice . Gastroenterology.
2011; ; 140 : :1043.–1051. 14.
Vrins
CL
,
Ottenhoff
R
,
Van den Oever
K
, et al.
Trans-intestinal cholesterol efflux is not mediated through high density lipoprotein . J Lipid Res.
2012; ; 53 : :2017.–2023. 15.
Van der Velde
AE
,
Vrins
CL
,
Van den Oever
K
, et al.
Regulation of direct transintestinal cholesterol excretion in mice . Am J Physiol Gastrointest Liver Physiol.
2008; ; 295 : :G203.–G208. 16.
Bura
KS
,
Lord
C
,
Marshall
S
, et al.
Intestinal SR-BI does not impact cholesterol absorption or transintestinal cholesterol efflux in mice . J Lipid Res.
2013; ; 54 : :1567.–1577. 17.
Vrins
CL
,
Van der Velde
AE
,
Van den Oever
K
, et al.
Peroxisome proliferator-activated receptor delta activation leads to increased transintestinal cholesterol efflux . J Lipid Res.
2009; ; 50 : :2046.–2054. 18.
Altmann
SW
,
Davis
HR
,
Zhu
LJ
, et al.
Niemann-Pick C1 like 1 protein is critical for intestinal cholesterol absorption . Science.
2004; ; 303 : :1201.–1204. 19.
Jakulj
L
,
Vissers
MN
,
Van Roomen
CP
, et al.
Ezetimibe stimulates faecal neutral sterol excretion depending on abcg8 function in mice . FEBS Lett.
2010; ; 584 : :3625.–3628. 20.
Thiebaut
F
,
Tsuruo
T
,
Hamada
H
, et al.
Cellular localization of the multidrug-resistance gene product P-glycoprotein in normal human tissues . Proc Natl Acad Sci USA.
1987; ; 84 : :7735.–7738. 21.
Sokolović
M
,
Sokolović
A
,
Van Roomen
CP
, et al.
Unexpected effects of fasting on murine lipid homeostasis: transcriptomic and lipid profiling . J Hepatol.
2010; ; 52 : :737.–744. 22.
Heinemann
T
,
Kullak-Ublick
GA
,
Pietruck
B
,
von Bergmann
K
. Mechanisms of action of plant sterols on inhibition of cholesterol absorption. Comparison of sitosterol, sitostanol . Eur J Clin Pharmacol.
1991; ; 40 : (suppl 1)
:S59.–S63. 23.
Brufau
G
,
Kuipers
F
,
Lin
Y
, et al.
A reappraisal of the mechanism by which plant sterols promote neutral sterol loss in mice . PLoS One.
2011; ; 6 : :e21576.. 24.
Glomset
JA
. The plasma lecithins:cholesterol acyltransferase reaction . J Lipid Res.
1968; ; 9 : :155.–167. 25.
Xie
P
,
Jia
L
,
Ma
Y
, et al.
Ezetimibe inhibits hepatic Niemann-Pick C1-Like 1 to facilitate macrophage reverse cholesterol transport in mice . Arterioscler Thromb Vasc Biol.
2013; ; 33 : :920.–925. 26.
Dikkers
A
,
Annema
W
,
de Boer
JF
, et al.
Differential impact of hepatic deficiency and total body inhibition of MTP on cholesterol metabolism and RCT in mice . J Lipid Res.
2014; ; 55 : :816.–825. 27.
Cheng
SH
,
Stanley
MM
. Secretion of cholesterol by intestinal mucosa in patients with complete common bile duct obstruction . Proc Soc Exp Biol Med.
1959; ; 101 : :223.–225. 28.
Stanley
MM
,
Pineda
EP
,
Cheng
SH
. Serum cholesterol esters and intestinal cholesterol secretion and absorption in obstructive jaundice due to cancer . N Engl J Med.
1959; ; 261 : :368.–373. 29.
Simmonds
WJ
,
Hofmann
AF
,
Theodor
E
. Absorption of cholesterol from a micellar solution: intestinal perfusion studies in man . J Clin Invest.
1967; ; 46 : :874.–890. |