| |
| Med Sci (Paris). 2014 December; 30(12): 1063–1066. Published online 2014 December 24. doi: 10.1051/medsci/20143012003.L’activité neuronale influence le développement des vaisseaux sanguins du cerveau Baptiste Lacoste1* 1Dr Chenghua Gu Laboratory, Department of Neurobiology, Harvard Medical School, 220 Longwood Avenue, MA02115, Boston, États-Unis MeSH keywords: Animaux, Vaisseaux sanguins, croissance et développement, Encéphale, vascularisation, Humains, Plasticité neuronale, Neurones, physiologie |
L’importance des interactions neurovasculaires. C’est avec une vision « neurocentrique » que la neurobiologie tente généralement de comprendre comment des neurones organisés en circuits produisent des fonctions aussi élaborées que la mémoire ou le langage. L’évolution rapide des connaissances a rendu incontournable l’étude des vaisseaux sanguins du cerveau, aussi bien dans le contexte de la physiologie que des pathologies. En effet, le cerveau, qui ne représente que 2 % de la masse corporelle, consomme 20 % de l’énergie disponible chez un individu au repos, et est fortement dépendant de l’apport en oxygène et nutriments par le flux sanguin. Ceci est d’autant plus important que la capacité du cerveau à stocker l’énergie est limitée [
1,
2]. Il est donc nécessaire que les apports énergétiques (oxygène et glucose) puissent combler de façon appropriée les besoins métaboliques (activité électrique). D’autre part, le bon fonctionnement du cerveau nécessite un environnement stable, contrôlé et non toxique, ce qui est assuré par la barrière hémato-encéphalique (BHE), filtre sélectif constitué par des cellules vasculaires cérébrales spécifiques [
3]. Ainsi, au cours du développement du cerveau, trois processus vasculaires vont être déterminants pour assurer le bon fonctionnement de l’organe mature : (1) l’établissement des réseaux vasculaires pour une bonne irrigation ; (2) la formation de la BHE pour le maintien de l’équilibre homéostatique ; et (3) la régulation du débit sanguin cérébral, ou « couplage neurovasculaire », pour un appariement efficace entre l’activité neuronale et l’apport énergétique. Les interactions neurovasculaires sont bien connues de nos jours pour leur implication dans la régulation du débit sanguin cérébral [
4,
5], que reflète l’imagerie cérébrale fonctionnelle par résonance magnétique (IRM fonctionnelle, ou IRMf). Le substrat anatomique des interactions neurovasculaires est appelé « unité neurovasculaire », un système multicellulaire complexe où neurones, astrocytes, péricytes et endothélium collaborent pour assurer le bon fonctionnement du cerveau (Figure 1A–B). Le couplage neurovasculaire est en effet à l’origine des signaux détectés en IRMf, signaux qui permettent d’observer l’activation d’une zone cérébrale lors d’une tâche particulière. C’est l’apport de sang dans cette zone activée (plus précisément un changement de composition du sang après l’apport d’oxygène) qui est détecté et enregistré localement sous forme d’images [
6]. Les interactions neurovasculaires ont aussi leur importance en pathologie : leurs altérations ont par exemple été associées à la migraine, aux accidents vasculaires cérébraux, ou encore à la maladie d’Alzheimer [
7]. Ainsi, le bon déroulement de la formation et de la maturation des vaisseaux cérébraux (ou réseaux cérébrovasculaires) est d’une importance capitale.
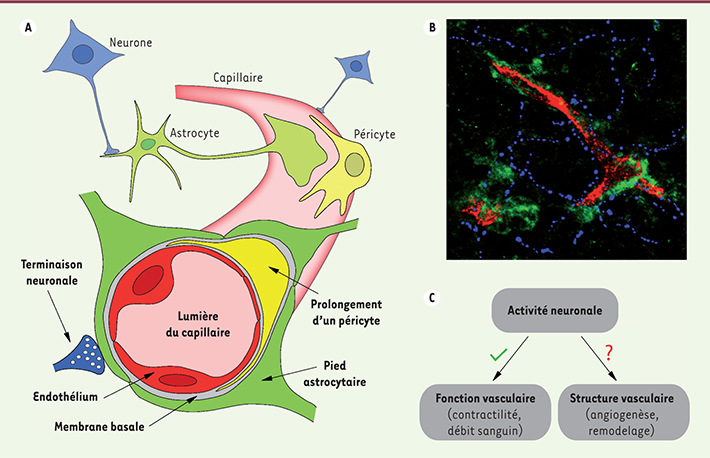
 | Figure 1.
Interactions neurovasculaires dans le cerveau. A. Le substrat anatomique des interactions neuro-vasculaires se nomme « l’unité neurovasculaire », un système multicellulaire où neurones, astrocytes, péricytes et cellules endothéliales communiquent pour assurer le bon fonctionnement du cerveau. B. Image en microscopie confocale illustrant l’unité neurovasculaire in situ. Y apparaissent les terminaisons neuronales (en bleu), les prolongements astrocytaires (en vert), organisés autour de capillaires sanguins cérébraux (en rouge). C. Le rôle de l’activité neuronale dans le contrôle de la fonction des vaisseaux cérébraux est de nos jours bien connu (contrôle du diamètre vasculaire, du débit sanguin cérébral). En revanche, le rôle de l’activité neuronale dans la formation des vaisseaux cérébraux est méconnu. |
|
Un contexte scientifique et historique pour aborder la plasticité cérébrovasculaire. Bien que le développement vasculaire débute durant l’embryogenèse, l’expansion des réseaux cérébrovasculaires se poursuit après la naissance, et leur remodelage se produit en situations normale ou pathologique. Les circuits neuronaux connaissent le même sort. Leur développement est suivi d’une plasticité dont le degré varie avec l’âge, pour se réduire - bien que persistant - chez l’adulte. Il existe en effet des périodes critiques au cours desquelles les circuits neuronaux sont plus susceptibles d’être modifiés par les expériences sensorielles et motrices, et sont plus vulnérables aux maladies ou traumatismes. Il est ainsi reconnu de nos jours que l’activité neuronale est responsable de profonds changements plastiques dans le cerveau [
8], principalement lors du développement des organes sensoriels et des premières interactions avec l’environnement. Malgré l’amoncellement de connaissances à propos de la plasticité neuronale, très peu de choses sont connues de la plasticité cérébrovasculaire. Plus précisément, le rôle de l’activité neuronale dans la formation des vaisseaux cérébraux était jusqu’à présent méconnu (Figure 1C). Les premiers travaux faisant état d’un lien entre les besoins énergétiques du cerveau et la structure des vaisseaux dans cet organe remontent à 1987, lorsque le groupe du Dr William T. Greenough suggéra que l’expérience visuelle pouvait stimuler l’angiogenèse (formation de vaisseaux sanguins) dans le cortex visuel, région du cerveau impliquée dans l’interprétation des signaux lumineux [
9]. En accord avec ce résultat, E.G. Argandonna et J.V. Lafuente démontraient dix ans plus tard que la privation d’information visuelle ralentissait le développement des vaisseaux sanguins dans cette même région [
10]. Ces études ont donné naissance au concept de plasticité cérébrovasculaire, en justifiant la formation de nouveaux vaisseaux sanguins pour répondre aux besoins énergétiques de régions cérébrales en expansion (ajout de nouvelles synapses par exemple). Bien que fondatrices, ces études sont à interpréter avec un certain recul, principalement en raison des outils de mesure utilisés pour parvenir à ces conclusions. Les auteurs se fondaient en effet sur des approches exclusivement anatomiques, à partir d’images négligeant l’aspect tridimensionnel des réseaux cérébrovasculaires, et en omettant d’élucider les mécanismes neurobiologiques fondamentaux responsables de ce phénomène. |
Rôle de l’activité neuronale dans la maturation des vaisseaux cérébraux Ce n’est que très récemment que la contribution de l’activité neuronale au développement cérébrovasculaire a été démontrée, à la suite de notre étude dans le laboratoire de Chenghua Gu à l’Université Harvard [
11]. Il est important d’évoquer la parution, quelques mois avant notre article, d’une étude rapportant l’effet néfaste de l’hyper-activité neuronale sur la maturation des vaisseaux cérébraux [
12]. En effet, l’équipe du Dr Grutzendler (Université Yale) a démontré que lors d’une période critique du développement postnatal, les crises d’épilepsie, les sons intenses et répétitifs, ou encore un exercice physique trop soutenu pouvaient réduire la formation de vaisseaux cérébraux [12]. Aussi intéressants soient ces résultats dans un contexte pathologique, ils n’élucident pas la contribution directe de l’activité neuronale dans le développement cérébrovasculaire « normal ». C’est précisément ce que notre étude a cherché à élucider. Grâce à une approche innovante combinant des outils avancés de microscopie, de génétique, d’analyse d’images, ainsi que des manipulations ciblées de l’activité neuronale, nous avons pu démontrer que durant le premier mois suivant la naissance, la complexité des réseaux cérébrovasculaires était contrôlée par l’activité neuronale. Pour ce faire, nous avons analysé les vaisseaux sanguins du cortex somatosensoriel primaire (S1) chez la souris, région cérébrale où il est aisé d’induire des modifications de l’activité neuronale par le biais de privations ou stimulations sensorielles (en supprimant ou stimulant les moustaches par exemple). En effet, l’information sensorielle provenant des moustaches est traitée dans une carte somatotopique du cortex S1. L’anatomie de cette région est bien caractérisée, particulièrement dans la couche IV du cortex S1 où des regroupements d’axones provenant du thalamus (axones thalamo-corticaux) - qui acheminent l’information sensorielle - forment des « barils » (Figure 2A). Chaque moustache est représentée par un de ces barils. De plus, pour visualiser les éléments vasculaires et neuronaux simultanément à cet endroit précis, nous avons créé une souris génétiquement modifiée dans laquelle les vaisseaux sanguins s’illuminent en vert, et les axones thalamo-corticaux en rouge (Figure 2A). Enfin, dans le but de détecter d’éventuels changements de structure vasculaire, nous avons imaginé une nouvelle méthode mathématique permettant de reconstruire les réseaux cérébrovasculaires en trois dimensions, de les représenter virtuellement et d’en extraire des données morphologiques importantes (longueur, densité, diamètre, nombres de points de branchement) permettant d’évaluer la complexité structurale vasculaire. Grâce à cette combinaison de méthodes à haute résolution, nous avons pu mesurer une réduction de la complexité vasculaire après privation sensorielle, et une augmentation de cette complexité après stimulation sensorielle, dans la couche IV du cortex S1 (Figure 2B). Dans cette même étude, nous démontrons aussi le rôle crucial de la transmission d’information entre le thalamus et le cortex dans la stimulation de l’angiogenèse cérébrale, ainsi que le contrôle - en temps normal - par l’activité neuronale de la division des cellules endothéliales (qui constituent la paroi des vaisseaux). En effet, une double mutation qui rend les axones thalamo-corticaux « silencieux » (en les empêchant de libérer des neurotransmetteurs dans le cortex) a aussi induit une réduction de la complexité vasculaire dans le cortex S1 ; de plus, la suppression des moustaches après la naissance a conduit à une diminution de la division des cellules endothéliales dans le cortex.
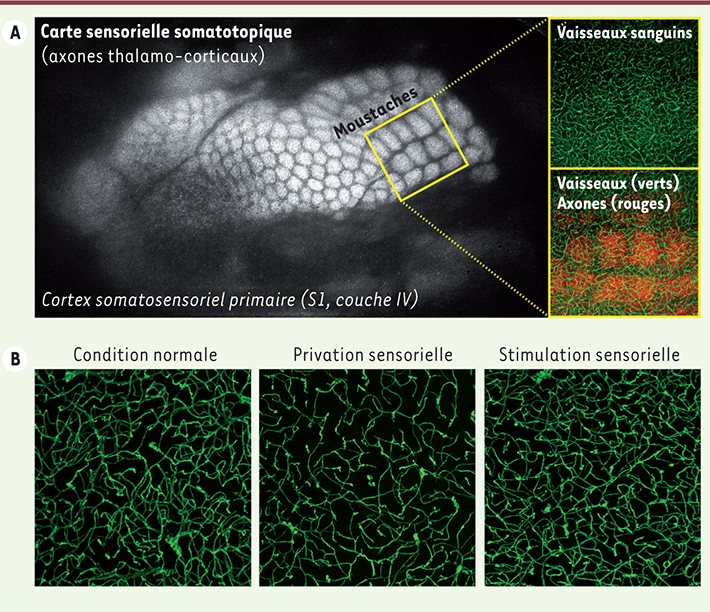
 | Figure 2.
Influence de l’activité neuronale sur la vascularisation du cortex cérébral. A. Le cortex somatosensoriel primaire « S1 » et sa couche IV représentent un système idéal pour étudier les interactions neurovasculaires, particulièrement chez une souris génétiquement modifiée pour que les vaisseaux sanguins s’illuminent en vert et les axones en rouge. B. Par comparaison à une situation normale chez l’animal témoin (image de gauche), la privation sensorielle conduit à une réduction de la complexité structurale vasculaire dans le cortex S1 (image du centre), alors que la stimulation sensorielle conduit à une augmentation de cette complexité (à droite). |
|
Nos résultats sont d’une grande importance en neurobiologie. D’un point de vue fondamental, ils démontrent que le développement cérébrovasculaire n’est pas exclusivement dicté par les programmes génétiques. Il semble en effet que la maturation des vaisseaux sanguins de notre cerveau soit influencée par l’activité des circuits de neurones, par exemple grâce aux stimulus que nous recevons de notre environnement. D’un point de vue médical, on peut aussi imaginer que la stimulation de l’activité neuronale pourrait être bénéfique lors de la prise en charge de maladies ou traumatismes affectant la circulation sanguine cérébrale en début de vie, lésions qui conduisent souvent à des déficits irréversibles (paralysie cérébrale par exemple). ‡ |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Attwell
D
,
Laughlin
SB
. An energy budget for signaling in the grey matter of the brain . J Cereb Blood Flow Metab.
2001; ; 21 : :1133.–1145. 2.
Peters
A
,
Schweiger
U
,
Pellerin
L
, et al.
The selfish brain: competition for energy resources . Neurosci Biobehav Rev.
2004; ; 28 : :143.–180. 3.
Zlokovic
BV
. The blood-brain barrier in health and chronic neurodegenerative disorders . Neuron.
2008; ; 57 : :178.–201. 4.
Hamel
E
. Perivascular nerves and the regulation of cerebrovascular tone . J Appl Physiol (1985).
2006; ; 100 : :1059.–1064. 5.
Drake
CT
,
Ladecola
C
. The role of neuronal signaling in controlling cerebral blood flow . Brain Lang.
2007; ; 102 : :141.–152. 6.
Harris
JJ
,
Reynell
C
,
Attwell
D
. The physiology of developmental changes in BOLD functional imaging signals . Dev Cogn Neurosci.
2011; ; 1 : :199.–216. 7.
Nicolakakis
N
,
Hamel
E
. Neurovascular function in Alzheimer’s disease patients and experimental models . J Cereb Blood Flow Metab.
2011; ; 31 : :1354.–1370. 8.
Katz
LC
,
Shatz
CJ
. Synaptic activity and the construction of cortical circuits . Science.
1996; ; 274 : :1133.–1138. 9.
Black
JE
,
Sirevaag
AM
,
Greenough
WT
. Complex experience promotes capillary formation in young rat visual cortex . Neurosci Lett.
1987; ; 83 : :351.–355. 10.
Argandona
EG
,
Lafuente
JV
. Effects of dark-rearing on the vascularization of the developmental rat visual cortex . Brain Res.
1996; ; 732 : :43.–51. 11.
Lacoste
B
,
Comin
CH
,
Ben-Zvi
A
, et al.
Sensory-related neural activity regulates the structure of vascular networks in the cerebral cortex . Neuron.
2014; ; 83 : :1117.–1130. 12.
Whiteus
C
,
Freitas
C
,
Grutzendler
J
. Perturbed neural activity disrupts cerebral angiogenesis during a postnatal critical period . Nature.
2014; ; 505 : :407.–411. |