| |
| Med Sci (Paris). 2014 December; 30(12): 1073–1075. Published online 2014 December 24. doi: 10.1051/medsci/20143012006.La susceptibilité à l’infection par le virus de l’hépatite C et la réponse antivirale sont modulées par le polymorphisme associé à l’interféron lambda Sonia Assil1 and Marlène Dreux1* 1Centre international de recherche en infectiologie ; université de Lyon ; Inserm U1111 ; École normale supérieure de Lyon, 46, allée d’Italie, 69007Lyonuniversité Lyon 1 ; CNRS, UMR5308 ; LabEx Ecofect ; université de Lyon, Lyon, F-69007, France MeSH keywords: Antiviraux, Prédisposition génétique à une maladie, génétique, Hépatite C, immunologie, Humains, Interférons, Polymorphisme génétique |
Variabilités génétiques touchant les gènes codant les interférons lambda et susceptibilité à l’infection par le virus de l’hépatite C (VHC) La détection de l’infection virale active une réponse de défense de l’hôte, caractérisée par la production de molécules antivirales et une inflammation contribuant à limiter la propagation virale et à potentialiser la réponse immunitaire adaptative. Notamment, les interférons (IFN) induisent l’expression d’un grand nombre de gènes appelés ISG (interferon stimulated gene). Des variabilités génétiques interindividuelles touchant les facteurs de cette réponse innée peuvent influencer l’évolution de l’infection virale vers la chronicité ou l’élimination du virus. À cet égard, dans le contexte de l’infection par le VHC, des polymorphismes génétiques dans des régions avoisinant les gènes codant pour IFNλ3 et IFNλ4 sont associés à la clairance spontanée du virus et la réponse des patients aux traitements à base d’IFNα. Les polymorphismes nucléotidiques sont définis alors comme favorables - appelés ici poly-F (variants C pour IFNλ3-rs12979860 et TT pour IFNλ4-rs368234815) -, ou non favorables - nommés poly-NF (variants T et ∆G, respectivement) [
1]. Dans une élégante publication dans Cell Host Microbe [
2], Sheahan et al. analysent la permissivité au VHC et le profil transcriptomique d’hépatocytes primaires humains issus d’individus présentant différents polymorphismes pour les IFNλ3 et 4. De façon intéressante, la présence de poly-NF est corrélée à un taux d’infection plus élevé des hépatocytes primaires humains. Ce résultat représente la première mise en évidence in vitro d’une régulation différentielle de l’infection associée aux polymorphismes IFNλ. Pourtant, l’infection par le VHC d’hépatocytes primaires humains porteurs de ce poly-NF induit l’expression d’un spectre de gènes antiviraux plus large que celui qui est induit dans les hépatocytes primaires humains porteurs de poly-F, dans lesquels la réponse antivirale est plus ciblée. Bien qu’en apparence paradoxal, ce résultat est en accord avec de précédentes analyses de biopsies hépatiques de patients infectés, révélant une association entre le poly-NF et un niveau élevé d’expression hépatique d’ISG avant traitement [
3,
4]. Alors que le niveau de production d’IFNλ n’est pas lui-même clairement corrélé aux polymorphismes [1], l’augmentation de l’expression hépatique du récepteur de l’IFNλ3 (IFNλR1) chez les patients présentant le poly-NF pourrait contribuer à la suractivation des hépatocytes lors de l’infection par le VHC [
5]. Ce phénomène est interprété comme prédisposant à la faible réponse de ces patients à une stimulation supplémentaire par un traitement par l’IFNα [1,
6]. Sheahan et al. apportent un autre élément de réponse en montrant que l’infection des hépatocytes primaires humains comportant le poly-F active un nombre de gènes liés à la mort cellulaire supérieur à celui qu’active l’infection de cellules de génotype poly-NF. On peut alors spéculer que les premières seraient moins permissives au VHC que les dernières en raison de l’élimination plus précoce des cellules infectées, réduisant ainsi la propagation virale. |
Réponse antivirale et chronicité de l’infection par le VHC En accord avec des études de biopsies hépatiques de patients chroniquement infectés [1, 3, 4, 6,
7], Sheahan et al. montrent que les cellules infectées par le VHC expriment des ISG ainsi que l’IFNλ [2]. Ceci suggère que le virus met en place des mécanismes pour se répliquer malgré l’activation de facteurs antiviraux. Cette induction est démontrée au niveau transcriptionnel ; or le VHC, en activant PKR (protein kinase RNA-activated, une des principales protéines induites par l’IFN), inhibe la synthèse de protéines cellulaires, dont celles que codent les ISG, sans altérer la traduction de protéines virales [
8]. De plus, les produits de certains ISG exercent une fonction provirale qui contrebalancerait la régulation négative exercée par d’autres ISG. Par exemple, ISG15 inhibe la signalisation induite par RIG-I, un récepteur de l’immunité innée, favorisant ainsi la réplication du VHC [
9]. Les études de biopsies hépatiques de patients chroniquement infectés par le VHC révèlent que l’infection n’est pas uniforme, mais restreinte à une faible proportion d’hépatocytes groupés en clusters, suggérant que des mécanismes limitent la propagation virale [
10]. Certaines protéines codées par des ISG, telles que IFITM3 (interferon induced transmembrane protein 3), sont principalement exprimées dans les cellules non infectées adjacentes aux cellules infectées [10], indiquant que ces dernières contribueraient au contrôle de la propagation virale. Cette hypothèse a été confortée par l’analyse séparée (après microdissection laser) des hépatocytes primaires humains infectés et des hépatocytes primaires humains adjacents non infectés. Cette analyse révèle que les cellules non infectées présentent elles aussi une activation de la réponse antivirale [2]. Toutefois, le profil d’expression des ISG de ces cellules est qualitativement différent de celui des cellules infectées, traduisant une réponse antivirale distincte. De manière intéressante, la différence de permissivité des hépatocytes primaires humains au VHC est associée au profil transcriptionnel de ces cellules adjacentes, puisqu’une faible susceptibilité à l’infection est corrélée à l’activation dans les cellules adjacentes d’un plus grand nombre de gènes antiviraux. Ces observations, et la récente démonstration que le contact de cellules infectées produisant de l’ARN double brin - intermédiaire de réplication virale - induit une réponse innée dans les cellules hépatocytaires adjacentes non infectées [
11], suggèrent que ces dernières jouent un rôle clé dans la réponse antivirale contre le VHC. |
Modulation de la réponse antivirale induite par le VHC par différents types cellulaires D’autres types cellulaires sont mobilisés par l’infection par le VHC et contribuent à la réponse différentielle des patients selon le polymorphisme. Notamment, les cellules de Kupffer, macrophages résidents du foie, produisent une quantité d’IFNβ plus importante chez les patients qui ne répondent pas au traitement IFNα que chez ceux qui y répondent, ce qui contribuerait à la perte de sensibilité à l’IFNα exogène [6]. En revanche, une forte expression d’ISG dans les cellules de Kupffer est associée au poly-F pour l’IFNλ3 et à une meilleure réponse au traitement [
12]. Ces données illustrent le double rôle joué par ces cellules en fonction du polymorphisme. D’autres études montrent une corrélation positive entre le poly-F et le potentiel d’activation de certaines cellules immunitaires. Par exemple, les cellules mononucléées circulantes de patients présentant un génotype poly-F pour l’IFNλ4 expriment plus fortement certaines molécules antivirales (IFNλ3 et IP10) en réponse à un agoniste synthétique (poly I:C) que les cellules de patients exprimant un poly-NF [
13]. De même, les cellules dendritiques BDCA3+ (blood dendritic cell antigen 3), enrichies au niveau du foie, produisent plus d’IFNλ ex vivo en réponse au VHC si elles sont porteuses du polymorphisme rs8099917 dit favorable pour l’IFNλ3 [
14]. De manière intéressante, l’IFNλ produit par ces cellules BDCA3+ stimule in vitro la production d’IFNα par les cellules dendritiques plasmacytoïdes (pDC), spécialisées pour la forte production d’IFN, et réciproquement [
15]. Les pDC, activées par contact avec des hépatocytes infectés par le VHC via le transfert d’ARN immunostimulateurs par des exosomes [
16,
17], produisent notamment plus d’IFNα lorsqu’elles sont issues d’individus porteurs de poly-F pour l’IFNλ3 [
18]. De plus l’IFNα active l’expression de IFNλR1 par les hépatocytes primaires humains [1, 5] ; cette signalisation pourrait donc être aussi modulée par les polymorphismes. Ces études illustrent donc l’existence de fines régulations croisées entre les réponses IFNα et IFNλ induites par les hépatocytes, mais aussi par différentes populations cellulaires présentes dans le foie, en réponse à l’infection par le VHC. Il semble donc que les polymorphismes associés à l’IFNλ imposeraient des variations d’intensité de plusieurs réponses : (1) la susceptibilité des hépatocytes à l’infection, ce que démontre la publication de Sheahan et al. [2], (2) la réponse antivirale des cellules infectées [2], et (3) la réponse d’autres populations cellulaires ; l’ensemble contribuant à l’élimination du virus et/ou la réponse aux traitements par l’apport d’IFNα exogène (Figure 1). ‡
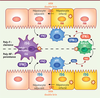 | Figure 1.
Modèle des régulations croisées de la réponse antivirale modulée par le polymorphisme pour l’IFNλ et leur impact sur l’infection par le VHC. Le polymorphisme favorable (poly-F) pour l’IFNl est associé à la clairance du virus et à une réponse efficace au traitement par l’IFNα (partie supérieure), tandis que le poly-NF (non favorable) est corrélé à la persistance virale (partie inférieure). Notamment, en association avec le poly-F sont observés : (1) des expressions plus élevées d’ISG par les cellules de Kupffer (violet), d’IFNα par les cellules dendritiques plasmacytoïdes (pDC en bleu) et d’IFNλ par les cellules dendritiques exprimant BDCA3 (BDCA3+ DC, vert), dont la réponse est amplifiée par la production d’IFNα par les pDC et réciproquement ; (2) une plus faible susceptibilité à l’infection, et (3) un niveau plus faible d’expression d’ISG dans les hépatocytes. En outre, l’induction des ISG est qualitativement différente entre poly-F et NF (ISG inscrit en rouge versus bleu, respectivement). La production élevée d’IFNβ par les cellules de Kupffer est associée à une faible réponse des patients au traitement, et à un risque accru de persistance virale. Les cellules non infectées adjacentes aux cellules infectées produisent des facteurs antiviraux (par exemple IFNβ, produits d’ISG) au contact des cellules infectées via le transfert et la reconnaissance d’ARN viral double brin, intermédiaire de réplication. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
O’Brien
TR
,
Prokunina-Olsson
L
,
Donnelly
RP
. IFNλ4: The paradoxical new member of the interferon lambda family . J Interferon Cytokine Res.
2014 ; 140430092028009.
2.
Sheahan
T
,
Imanaka
N
,
Marukian
S
, et al.
Interferon lambda alleles predict innate antiviral immune responses and hepatitis C virus permissiveness . Cell Host Microbe.
2014; ; 15 : :190.–202. 3.
Urban
TJ
,
Thompson
AJ
,
Bradrick
SS
, et al.
IL28B genotype is associated with differential expression of intrahepatic interferon-stimulated genes in patients with chronic hepatitis C . Hepatology.
2010; ; 52 : :1888.–1896. 4.
Honda
M
,
Sakai
A
,
Yamashita
T
, et al.
Hepatic ISG expression is associated with genetic variation in interleukin 28b and the outcome of IFN therapy for chronic hepatitis C . Gastroenterology.
2010; ; 139 : :499.–509. 5.
Duong
FHT
,
Trincucci
G
,
Boldanova
T
, et al.
IFN- receptor 1 expression is induced in chronic hepatitis C and correlates with the IFNl3 genotype and with nonresponsiveness to IFN- therapies . J Exp Med.
2014; ; 211 : :857.–868. 6.
Lau
DTY
,
Negash
A
,
Chen
J
, et al.
Innate immune tolerance and the role of kupffer cells in differential responses to interferon therapy among patients with HCV genotype 1 infection . Gastroenterology.
2013; ; 144 : :402.–413. 7.
Wieland
S
,
Makowska
Z
,
Campana
B
, et al.
Simultaneous detection of hepatitis C virus and interferon stimulated gene expression in infected human liver . Hepatology.
2014; ; 59 : :2121.–2130. 8.
Garaigorta
U
,
Chisari
FV
. Hepatitis C virus blocks interferon effector function by inducing protein kinase r phosphorylation . Cell Host Microbe.
2009; ; 6 : :513.–522. 9.
Arnaud
N
,
Dabo
S
,
Akazawa
D
, et al.
Hepatitis C virus reveals a novel early control in acute immune response . PLoS Pathog.
2011; ; 7 : :e1002289.. 10.
Kandathil
AJ
,
Graw
F
,
Quinn
J
, et al.
Use of laser capture microdissection to map hepatitis c virus–positive hepatocytes in human liver . Gastroenterology.
2013; ; 145 : :1404.–1413. 11.
Dansako
H
,
Yamane
D
,
Welsch
C
, et al.
Class A scavenger receptor 1 (msr1) restricts hepatitis c virus replication by mediating toll-like receptor 3 recognition of viral RNAs produced in neighboring cells . PLoS Pathog.
2013; ; 9 : :e1003345.. 12.
McGilvray
I
,
Feld
JJ
,
Chen
L
, et al.
Hepatic cell–type specific gene expression better predicts HCV treatment outcome than IL28b genotype . Gastroenterology.
2012; ; 142 : :1122.–1131. 13.
Bibert
S
,
Roger
T
,
Calandra
T
, et al.
IL28B expression depends on a novel TT/-G polymorphism which improves HCV clearance prediction . J Exp Med.
2013; ; 210 : :1109.–1116. 14.
Yoshio
S
,
Kanto
T
,
Kuroda
S
, et al.
Human blood dendritic cell antigen 3 (BDCA3) + dendritic cells are a potent producer of interferon-λ in response to hepatitis C virus . Hepatology.
2013; ; 57 : :1705.–1715. 15.
Zhang
S
,
Kodys
K
,
Li
K
, et al.
Human type 2 myeloid dendritic cells produce interferon-λ and amplify interferon-α in response to hepatitis c virus infection . Gastroenterology.
2013; ; 144 : :414.–425. 16.
Takahashi
K
,
Asabe
S
,
Wieland
S
, et al.
Plasmacytoid dendritic cells sense hepatitis C virus-infected cells, produce interferon, and inhibit infection . Proc Natl Acad Sci USA.
2010; ; 107 : :7431.–7436. 17.
Dreux
M
,
Garaigorta
U
,
Boyd
B
, et al.
Short-range exosomal transfer of viral RNA from infected cells to plasmacytoid dendritic cells triggers innate immunity . Cell Host Microbe.
2012; ; 12 : :558.–570. 18.
Stone
AEL
,
Giugliano
S
,
Schnell
G
, et al.
Hepatitis C virus pathogen associated molecular pattern (pamp) triggers production of lambda-interferons by human plasmacytoid dendritic cells . PLoS Pathog.
2013; ; 9 : :e1003316.. |