Le néocortex, formé de circonvolutions, constitue une partie importante du système nerveux central et présente une architecture laminaire complexe, qui résulte de processus développementaux embryonnaires finement orchestrés [ 1]. En effet, les neurones du néocortex sont tout d’abord générés par la prolifération de progéniteurs neuronaux qui bordent le ventricule, et ils migrent ensuite vers les zones superficielles (Figure 1) [ 2]. Finalement, les neurones vont migrer et atteindre la plaque corticale pour constituer les différentes couches du néocortex suivant un modèle inside-out, c’est-à-dire que les premiers neurones générés forment les couches profondes, alors que les derniers neurones traversent les couches précédentes pour atteindre les couches plus superficielles.
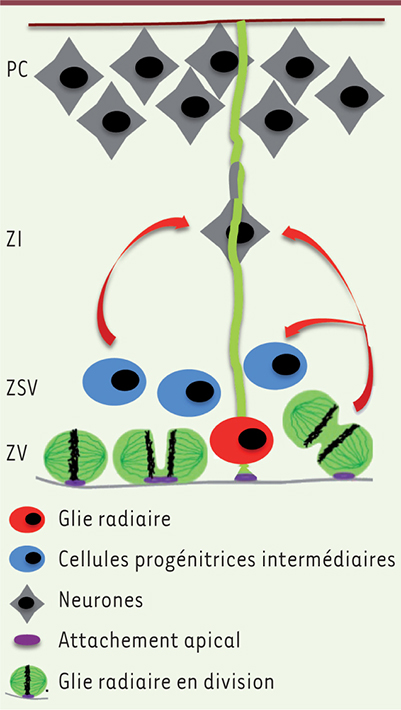
| Figure 1.
Schéma d’une section de la paroi corticale embryonnaire. Les progéniteurs neuronaux (rouges, verts et bleus) se trouvent dans les zones ventriculaire (ZV) et sous-ventriculaire (ZSV) et produisent des neurones (gris) qui migrent à travers la zone intermédiaire (ZI) afin d’atteindre la plaque corticale (PC). Les cellules gliales radiaires se divisent à la surface ventriculaire d’une manière symétrique, en donnant naissance à deux cellules filles identiques, ou asymétrique, en donnant naissance à deux cellules différentes [
15]. Une ou deux cellules filles bénéficient de la membrane apicale (violet) qui borde le ventricule. Les cellules gliales radiaires ont un prolongement apical attaché à la surface ventriculaire et un long prolongement basal attaché à la surface piale du cortex. Ce dernier sert de guide aux neurones pour atteindre la PC. |
Ces processus sont soumis à deux contraintes majeures :
1. Permettre l’expansion régulée d’un compartiment de cellules progénitrices, afin de produire juste le nombre suffisant de cellules nerveuses.
2. Contrôler finement le nombre final des trois types cellulaires principaux issus des progéniteurs : les neurones, les astrocytes et les oligodendrocytes.
Ces deux évènements résultent d’une régulation très précise de la division des cellules gliales radiaires, qui constituent la source majeure de progéniteurs du cortex en développement [ 3]. En effet, la glie radiaire donne naissance, par division asymétrique, à des cellules progénitrices intermédiaires, qui, à leur tour, par vagues successives, engendrent des neurones par division symétrique. La glie radiaire a une morphologie particulière, arborant des prolongements, apicaux et basaux, attachés respectivement aux surfaces ventriculaires et piales. Ces prolongements sont importants pour le positionnement et le fonctionnement cellulaires. Le prolongement basal sert notamment de support à des neurones postmitotiques lors de leur migration [ 4].
Des anomalies de la prolifération des progéniteurs neuronaux, de la migration neuronale, de la croissance axonale et dendritique, et de la synaptogenèse peuvent entraîner des malformations corticales sévères, telles que la lissencéphalie de type 1 ou l’hétérotopie laminaire sous-corticale, qui sont associées à des déficits intellectuels et une épilepsie pharmaco-résistante [ 5]. Les mécanismes, moléculaires et cellulaires, ainsi que la physiopathologie de l’hétérotopie sous-corticale sont peu connus [ 6]. Même si des mutations ont été identifiées chez les patients dans les gènes DCX (doublecortin), LIS1 (lissencephaly) et TUBA1A (tubulin, alpha 1a), dans un certain nombre de cas le gène muté n’est toujours pas connu.
La mutation HeCo (heterotopic cortex) est apparue spontanément dans une colonie de souris à l’Université de Lausanne [ 7]. Les souris mutantes possèdent des agrégats de neurones hétérotopiques dans la substance blanche (Figure 2), et souffrent d’épilepsie et de déficits cognitifs subtils, un phénotype semblable à celui qui est observé chez les patients atteints d’hétérotopie sous-corticale [ 8]. Ce phénotype étant transmis de façon autosomique récessive chez la souris, nous avons réalisé des criblages génétiques en collaboration avec le centre national de génotypage (CNG, Evry, R. Olaso). Grâce à la technique des single nucleotide polymorphisms (SNP) qui couvrent le génome entier, nous avons localisé la région chromosomique contenant le gène muté. Nous avons également comparé le transcriptome de cerveaux d’embryons mutants à celui de cerveaux d’embryons de type sauvage. Nous avons ainsi identifié le gène Eml1 (Echinoderm microtubule associated protein-like 1), présent dans la région candidate, dont l’expression est fortement réduite dans les cerveaux mutants [ 9]. De plus, une analyse de l’ADN génomique HeCo a montré l’insertion d’un rétrotransposon [ 10] qui perturbe la transcription du gène Eml1. Parallèlement, en collaboration avec les groupes de J. Chelly et N. Bahi-Buisson (Paris) et A-G Le Moing et P. Berquin (Amiens), nous avons analysé le gène humain, EML1, en cherchant des mutations de ce gène dans un panel de patients atteints de malformations corticales, mais dont les gènes DCX, LIS1 et TUBA1A n’étaient pas mutés. Des mutations ont été d’abord identifiées dans une famille présentant une hétérotopie « géante » sévère (Figure 2) [ 11] avec une polymicrogyrie (caractérisée par des petites girations fusionnées), associées à des anomalies du corps calleux. Une deuxième famille avec un phénotype similaire a été par la suite identifiée en collaboration avec le groupe de G. Mancini (Pays-Bas). Les enfants atteints présentent tous un retard développemental et mental, et une épilepsie, parfois pharmaco-résistante, se développe souvent pendant la première décennie.
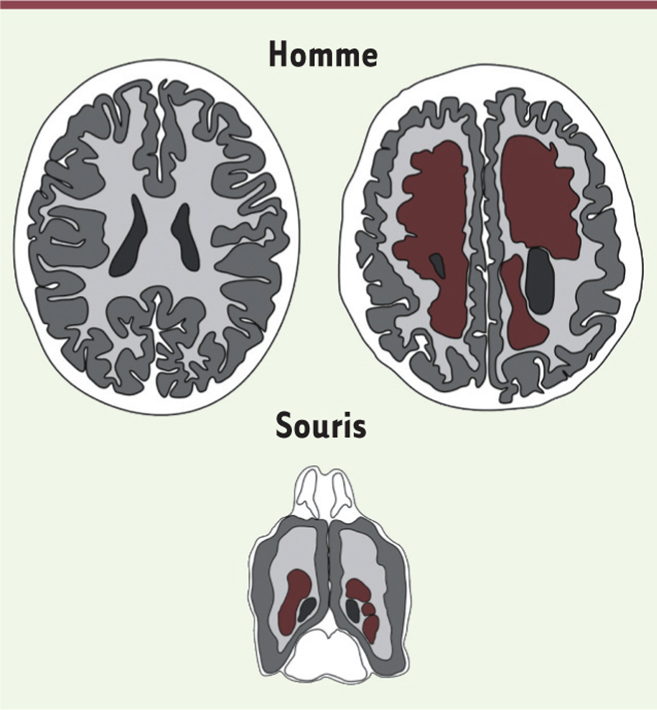
| Figure 2.
Schéma de coupes horizontales de cerveaux adultes humains (haut) et murin (bas). Les patients qui portent des mutations dans EML1 (droite) présentent une hétérotopie neuronale (marron ; localisation anormale de neurones organisés en agrégats) localisée dans la substance blanche (gris clair), par comparaison aux sujets contrôles (gauche). Les ventricules latéraux sont en noir et la substance grise en gris foncé. Les patients peuvent aussi présenter une macrocéphalie, une hydrocéphalie et/ou une polymicrogyrie. Le phénotype d’hétérotopie est également observé dans le cerveau de souris mutantes. |
Le gène Eml1 appartient à une famille codant pour des protéines qui se lient aux microtubules [ 12, 13] et qui sont peu étudiées dans les neurones. Ceci renforce l’idée selon laquelle un fonctionnement anormal du cytosquelette est une cause majeure de la formation de l’hétérotopie [ 14]. D’une manière intéressante, l’expression du gène Eml1 a été localisée par hybridation in situ dans les neurones postmitotiques de la plaque corticale, ainsi que dans les cellules en prolifération de la zone ventriculaire. L’étude des cerveaux HeCo a, par ailleurs, révélé la présence de progéniteurs ectopiques et une prolifération perturbée durant l’embryogenèse. Grâce à la vidéo-microscopie et à des expériences de greffe de cellules neuronales (réalisées respectivement avec l’aide des groupes de C. Lebrand, Lausanne, et de V. Borrell, Alicante), nous avons pu montrer que, dans un environnement de type sauvage, les cellules mutées migrent aussi bien que les cellules de type sauvage. L’hétérotopie est donc vraisemblablement due à des anomalies plus précoces du développement cérébral, notamment au niveau de la localisation et de la prolifération des progéniteurs neuronaux, résultant en une production locale et ectopique de neurones dans la région de l’hétérotopie, avec une perturbation du substrat de migration (Figure 3).
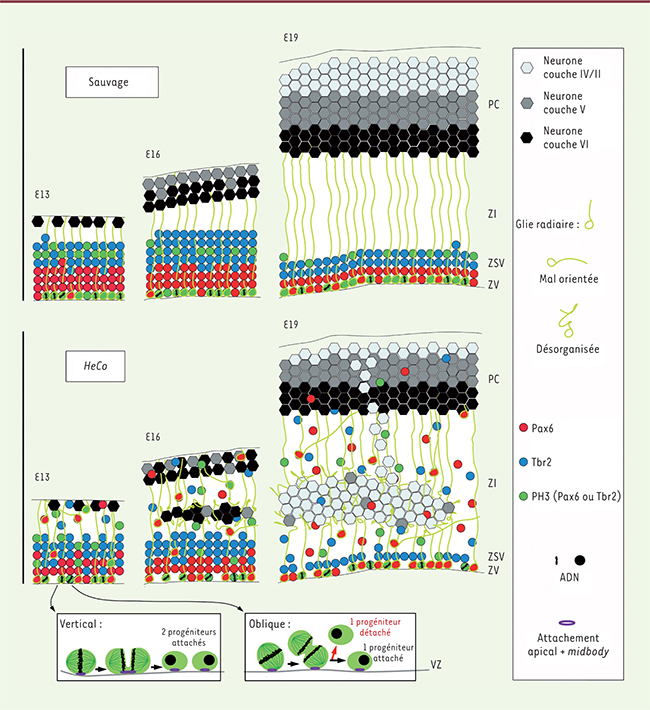
| Figure 3.
Schéma de la formation d’hétérotopie dans les cerveaux de souris mutantes HeCo. Le schéma compare le développement cortical à E13, E16 et E19 (E, nombre de jours embryonnaires) de souris mutantes (bas) et de souris sauvages (haut). Dans les cerveaux de type sauvage, les progéniteurs (positifs pour Pax6 ou Tbr2, respectivement en rouge et bleu, ou parfois en mitose et exprimant PH3, en vert) sont restreints à la ZV (zone ventriculaire) et la ZSV (zone sous-ventriculaire), tandis que dans les cerveaux HeCo, dès E13, une proportion de progéniteurs est distribuée anormalement dans la ZI (zone intermédiaire) et la PC (plaque corticale). À E16, une accumulation de cellules est visible dans la ZI, et les prolongements de cellules gliales radiaires sont perturbés. Des colonnes de neurones sont présentes entre l’hétérotopie et la PC aux stades plus tardifs, quand l’hétérotopie ne contient que des neurones des couches superficielles. En bas de la figure, une illustration de clivages mitotiques verticaux et obliques à la surface ventriculaire est détaillée. Les progéniteurs HeCo, mutés pour Eml1, montrent une augmentation relative des clivages obliques, qui vont vraisemblablement modifier la présence de la membrane apicale reçue par la cellule et mener à un nombre plus important de progéniteurs détachés qui continuent à se diviser dans des zones ectopiques [
16]. |
En résumé, nous avons identifié EML1/Eml1, une protéine au rôle insoupçonné dans la corticogenèse, et dont la fonction exacte est inconnue. La mutation du gène est clairement responsable d’anomalies des progéniteurs neuronaux, susceptibles d’avoir des conséquences secondaires sur la migration neuronale. Finalement, en cherchant les partenaires protéiques de Eml1, et grâce aux techniques d’imagerie sur des cerveaux en développement, nous essayons maintenant de comprendre le rôle de cette protéine et de savoir comment son inactivation conduit à l’hétérotopie. ‡