| |
| Med Sci (Paris). 2014 December; 30(12): 1136–1143. Published online 2014 December 24. doi: 10.1051/medsci/20143012017.La narcolepsie avec cataplexie : une maladie auto-immune ? Louis Jacob1* and Yves Dauvilliers2 1Master biosciences, École normale supérieure de Lyon, 46, allée d’Italie, 69007Lyon, France 2Centre de référence national maladie rare-narcolepsie et hypersomnie idiopathique, service de neurologie, hôpital Gui-de-Chauliac, Inserm U1061, Montpellier, France |
La narcolepsie est un trouble du sommeil qui a été décrit pour la première fois par un neurologue allemand, Westphal, en 1877 [
1]. Trois ans plus tard, en 1880, un médecin militaire français, Jean-Baptiste Gélineau, en fait une description détaillée dans la Gazette des Hôpitaux, après avoir étudié son voisin atteint d’endormissements soudains et répétés, et introduit le terme de « narcolepsie » (narcos : engourdissement, lepticos : prendre subitement) [
2]. La narcolepsie est caractérisée par cinq symptômes [
3–
5] : hypersomnolence diurne, cataplexie (perte brusque du tonus musculaire déclenchée par des émotions), paralysies du sommeil, hallucinations hypnagogiques (qui surviennent lors de l’endormissement) et dérégulation du sommeil nocturne. Néanmoins, seule la cataplexie est spécifique de la narcolepsie [
6]. La plupart des symptômes de cette maladie s’apparentent au sommeil paradoxal, pendant lequel des sujets normaux rêvent tout en étant paralysés [
7]. C’est pourquoi la cataplexie, les paralysies du sommeil et les hallucinations hypnagogiques associées à la narcolepsie sont considérées comme des fragments anormaux dissociés du sommeil paradoxal qui interrompent l’état d’éveil normal (Figure 1). Selon l’International sleep disorder classification, 3e édition (ICSD3), la narcolepsie doit être classée en deux sous-types différents : la narcolepsie de type 1, associée à une perte des neurones à hypocrétine, et la narcolepsie de type 2, qui regroupe les hypersomnies non associées à une perte de ces neurones mais avec une dysrégulation du sommeil paradoxal [
8]. Cette classification complète celle proposée par le Diagnostic and statistical manual of mental disorders, 5e édition (DSM5), qui distingue également la narcolepsie associée à une perte des neurones à hypocrétine des autres hypersomnies [
9]. La prévalence de la narcolepsie-cataplexie est estimée à 0,02-0,05 %. Mais il existe quelques hétérogénéités entre les populations : la prévalence serait multipliée par huit dans la population japonaise (0,16 %), et elle est très faible dans la population israélienne [
10–
13]. La narcolepsie apparaît généralement pendant l’enfance, au moment de la puberté, ou pendant l’adolescence [3,
14,
15]. Quand les cataplexies sont typiques et fréquentes, le diagnostic de narcolepsie est aisé, il peut ainsi être uniquement clinique. Si les cataplexies sont absentes ou atypiques, une polysomnographie suivie d’un test itératif de latence d’endormissement (TILE) sont requis [10,
16]. La polysomnographie est un test nocturne qui mesure en continu les activités cérébrale (EEG, électroencéphalogramme), oculaire (EOG, électro-oculographie), musculaire (EMG, électromyogramme), cardiaque (ECG, électrocardiogramme), et respiratoire. Elle permet d’exclure des diagnostics autres que la narcolepsie (en l’absence de cataplexie) - tels que le syndrome d’apnées du sommeil - et de révéler des anomalies dans le sommeil paradoxal, telles qu’une diminution de sa latence et la perte de l’atonie musculaire en sommeil paradoxal (sommeil paradoxal dissocié) [7,
17]. La polysomnographie permet notamment d’avoir accès à l’hypnogramme qui rapporte les différentes phases de sommeil au cours de la nuit (Figure 1). Le TILE mesure la latence d’endormissement des patients lors de siestes répétées (cinq siestes espacées de deux heures) et l’apparition du sommeil paradoxal pendant ces siestes. Un sujet est considéré comme narcoleptique lorsque le temps moyen d’endormissement lors de cinq siestes est inférieur à huit minutes et que le sommeil paradoxal est atteint en moins de quinze minutes au cours d’au moins deux siestes [7]. Une ponction lombaire pour doser les taux d’hypocrétine dans le liquide céphalorachidien et un typage HLA-DQB1*06:02 peuvent s’avérer nécessaires pour établir le diagnostic final.
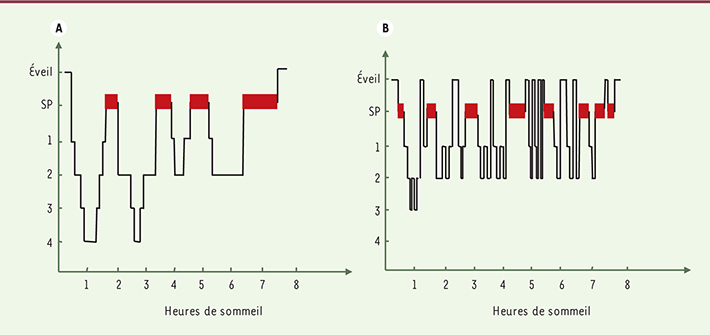
 | Figure 1.
A. Comparaison de l’hypnogramme d’un adulte sain (A) avec celui d’un patient narcoleptique (B). SP (en rouge) : sommeil paradoxal, 1 : phase d’endormissement, 2 : phase de sommeil léger, 3 et 4 : phases de sommeil profond (actuellement ces deux phases sont fusionnées). Le sommeil paradoxal apparaît plus rapidement chez le patient narcoleptique. |
|
La narcolepsie de type 1 est associée à la perte des neurones à hypocrétine La narcolepsie de type 1 est liée à la perte de 70 000 à 90 000 neurones à hypocrétine, ce qui représente plus de 90 % de cette population neuronale [10, 16]. Le premier argument en faveur d’un lien entre la narcolepsie de type 1 et le système hypocrétinergique vient des modèles que représentent les chiens porteurs d’une mutation pour le récepteur 2 de l’hypocrétine (labradors et dobermans narcoleptiques) ; plusieurs modèles de souris dont les gènes codant pour la prépro-hypocrétine ou ses récepteurs 1 et 2 sont mutés développent aussi un phénotype narcoleptique [
18,
19]. Les neurones à hypocrétine sont situés au niveau de l’hypothalamus postérolatéral et synthétisent l’hypocrétine (aussi appelée orexine), un neurotransmetteur impliqué dans la régulation de l’éveil, du métabolisme et de l’excitation [
20]. L’hypocrétine est un précurseur clivé en deux peptides biologiquement actifs, les hypocrétines 1 et 2 (aussi appelés Hcrt1 et Hcrt2). Bien que ces neurones soient spécifiques de l’hypothalamus, ils se projettent sur de nombreuses structures cérébrales, et notamment sur le système monoaminergique impliqué dans l’éveil. Hcrt1 et Hcrt2 se fixent avec des affinités différentes sur deux récepteurs couplés aux protéines G différents (OX1R et OX2R), conduisant successivement à l’activation d’une protéine Gq, l’ouverture de canaux calciques, et l’activation des neurones cibles [
21]. Ainsi, une perte des neurones à hypocrétine conduit à une diminution de l’activation du système monoaminergique et, in fine, à une dérégulation du sommeil, du métabolisme et du comportement. Des injections intracérébrales de Hcrt1 stimulent l’éveil, alors que l’utilisation d’antagonistes des récepteurs de l’hypocrétine favorise le sommeil, expliquant que ces derniers soient développés comme agents hypnotiques chez l’homme. Récemment, la mesure du taux de Hcrt1 s’est avérée être un excellent marqueur diagnostique, plus précis que le TILE et la polysomnographie puisque ciblant directement la cause biochimique du désordre [
22,
23]. |
La narcolepsie est associée à des gènes impliqués dans la réponse immune La perte des neurones à hypocrétine serait liée à une activation du système immunitaire qui ciblerait ces cellules et les détruirait. Il est naturel de se demander s’il existe un lien entre une telle pathologie et des gènes impliqués dans la réponse immune. Un tel lien est connu depuis la découverte de l’association génétique de la maladie avec le complexe majeur d’histocompatibilité (CMH, HLA [human leukocyte antigen] en anglais) et particulièrement avec HLA-DQB1*06:02, un allèle du CMH de classe II [
24]. Près de 98 % des patients narcoleptiques de type 1, quelle que soit leur origine ethnique, sont porteurs de cet allèle, mais seulement 20-25 % des individus en population générale. Les individus porteurs du HLA-DQB1*06:02 ont un risque beaucoup plus grand que les individus non porteurs de développer la maladie (odds ratio de 251) [
25]. Ce lien génétique est si fort qu’initialement, la narcolepsie avait été associée artificiellement dans la population japonaise à un allèle d’un autre gène du CMH de classe II, HLA-DRB1*15:01, localisé à proximité de HLA-DQB1 [
26,
27]. La très forte association de la narcolepsie avec HLA-DQB1*06:02 explique également que la maladie soit liée au HLA-DQA1*01:02, en fort déséquilibre de liaison avec HLA-DQB1*06:02. D’autres gènes impliqués dans l’activation de la réponse immune, et notamment celle des lymphocytes T CD4+, ont également été associés à la narcolepsie (
Figure 2
et Tableau I). Ces associations (odds ratios) restent toutefois faibles en comparaison de l’association narcolepsie-HLA-DQB1*06:02. C’est le cas notamment du gène codant pour la chaîne alpha du récepteur des cellules T (TCRa), dont la séquence contient trois polymorphismes qui ont été associés à la narcolepsie [
28]. Deux de ces polymorphismes sont dans la région du gène de jonction tandis que le troisième est situé entre les deux premiers exons codant pour la région constante de la protéine. Ces polymorphismes pourraient modifier la recombinaison somatique des gènes codant pour le récepteur1 et conduire à la formation d’un TCRα très affin pour le dimère HLA-DQB1*06:02/HLA-DQA1*01:02. Parmi les autres associations génétiques avec la narcolepsie, citons les gènes codant pour la cathepsine H, le TCRβ et OX40L [
29,
30], également impliqués dans l’activation CD4+, ou encore ceux qui interviennent dans la fonction immunomodulatrice des lymphocytes T régulateurs. C’est le cas de DNMT1 (DNA [cytosine-5]-methyltransferase 1), une ADN méthylase qui intervient dans le processus de différenciation des lymphocytes T CD4+ en T régulateurs, sur laquelle trois mutations non silencieuses ont été découvertes (Ala570Val, Gly605Ala et Val606Phe) [
31]. Cette association a été trouvée chez cinq patients atteints d’une forme autosomique dominante d’une narcolepsie symptomatique associée à une surdité et un syndrome cérébelleux, différente de la forme sporadique classique (ADCA-DN pour autosomal dominant cerebellar ataxia, deafness and narcolepsy). L’hypothèse est que ces mutations altéreraient la liaison de DNMT1 à l’ADN et, in fine, la différenciation en lymphocytes T régulateurs. La chaîne β du récepteur de l’IL10, une interleukine aux fonctions immunosuppressives, est aussi associée à la narcolepsie [30]. Enfin, le gène codant pour un récepteur de faible affinité de l’ATP, P2RY11, appartenant à la famille des récepteurs purinergiques et exprimé dans un grand nombre de cellules immunes (surtout lymphocytes T CD8+ et lymphocytes natural killer), est lié à la narcolepsie [
53]. Ce gène intervient dans la protection cellulaire des effets cytotoxiques de l’ATP relayés par les autres récepteurs purinergiques, sans rôle direct a priori dans l’activation des lymphocytes CD4+. En conclusion, la narcolepsie entretient une association très forte avec HLA-DQB1*06:02 et des associations plus faibles avec d’autres gènes impliqués dans la réponse immunitaire (odds ratios inférieurs à 2). Les effets de ces polymorphismes associés à la narcolepsie sur la réponse immune restent, quant à eux, hypothétiques.
Tableau I.
| Gènes |
Allèle/polymorphismes/mutations |
Localisation des polymorphismes/mutations |
Odds ratios associés au polymorphisme/allèle |
Valeur de p |
Référence |
| HLA-DQB1 |
HLA-DQB1*06:02 |
Région interagissant avec l’antigène |
251 |
1,04 x 10-120
|
[25] |
|
| TCRα |
rs1154155 |
Région de jonction |
1,72 |
8,87 x 10-30
|
[29] |
| Cathepsine H |
rs34593439 |
Peptide signal |
1,34 |
1,78 x 10-8
|
[29] |
| OX40L |
rs7553711 |
Enhancer
|
1,33 |
4,08 x 10-8
|
[29] |
|
| TCRβ |
rs2854536 |
Région variable |
0,78 |
3,87 x 10-8
|
[30] |
| IL10Rβ |
rs2834188 |
Région 5’ |
0,77 |
1,95 x 10-8
|
[30] |
|
| P2RY11 |
rs2305795 |
3’ UTR |
1,28 |
6,14 × 10-10
|
[53] |
|
| DNMT1 |
Ala570Val |
Domaine RFTS (inhibant l’interaction DNMT1-ADN) |
Non disponible |
|
[31] |
|
Gly605Ala |
|
|
|
|
|
Val606Phe |
|
|
|
|
Principaux gènes retrouvés associés à la narcolepsie avec cataplexie. HLA-DQB1 est en rose foncé, les polymorphismes dont l’odds ratio est supérieur à 1 en rose clair et les polymorphismes avec un odds ratio inférieur à 1 en orange. |
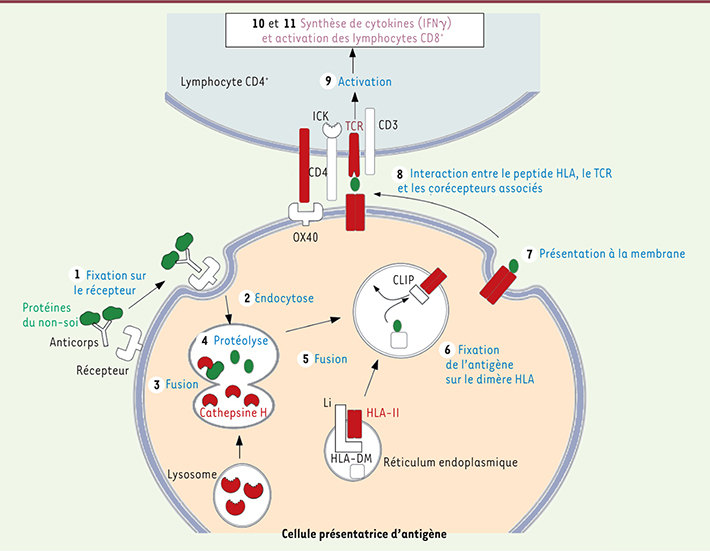
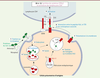 | Figure 2.
La narcolepsie avec cataplexie est liée avec des gènes impliqués dans l’activation des lymphocytes T CD4+. Les produits des gènes sont figurés en rouge. Les différentes étapes conduisant à l’activation des lymphocytes CD4 sont indiquées en bleu, les étapes ultérieures conduisant à l’activation des CD8+ en violet. Une protéine du non-soi est représentée en vert. |
|
Narcolepsie et infections du tractus respiratoire supérieur La narcolepsie n’est pas une maladie purement génétique. Seulement 30 % des paires de jumeaux monozygotes (6 paires sur les 19 référencées) sont concordantes pour la narcolepsie, et les formes familiales de narcolepsie avec cataplexie ne concernent que 1 à 2 % des cas. L’environnement joue ainsi un rôle majeur dans le développement de la narcolepsie de type 1 [6]. En effet, cette maladie est associée aux infections du tractus respiratoire supérieur telles que les infections à virus influenza de type A et, de façon plus hypothétique, à Streptococcus pyogenes. Une étude chinoise conduite sur 629 patients (principalement des enfants) a notamment montré une forte association entre le développement de la narcolepsie et les infections grippales [
32]. Selon cette étude, l’incidence de la maladie augmente entre avril et juillet chaque année. La même publication rapporte une multiplication par 3 de l’incidence de la narcolepsie lors de la pandémie de grippe H1N1 de 2009, augmentation transitoire, l’incidence retrouvant son niveau habituel deux ans après cette épidémie [
33]. L’hypothèse actuelle émise pour expliquer l’association entre narcolepsie et virus H1N1, est que les protéines de ce virus partageraient une certaine homologie de séquence avec les protéines exprimées dans les neurones à hypocrétine. Dans un contexte génétique particulier, c’est-à-dire en présence de l’allèle HLA-DQB1*06:02 et potentiellement des autres polymorphismes décrits précédemment, ces protéines conduiraient à l’activation de cellules autoréactives. Les virus influenza de type A sont déjà connus pour être associés à des maladies auto-immunes comme notamment l’encephalitis lethargica décrite par Von Economo après la grippe espagnole de 1918 et le syndrome de Guillain-Barré observé après la vaccination contre la grippe porcine de 1977 [
34,
35]. Néanmoins, cette association entre la narcolepsie et la grippe en Chine n’a pas été retrouvée en France où une étude (NarcoFlu-VF) incluant 59 patients narcoleptiques a été menée en comparaison à 135 individus contrôles appariés sur la base de l’âge, du sexe et d’antécédents médicaux [
36]. En effet, si une association a bien été retrouvée entre la narcolepsie de type 1 et le vaccin H1N1, aucune association n’a été mise en évidence entre la narcolepsie et les autres vaccinations, ni avec les épisodes infectieux grippaux ou non survenus depuis le 1er janvier 2005. Outre les différences d’effectifs dans les deux études, il est probable que les populations française et chinoise ne soient pas identiques en termes de susceptibilité vis-à-vis de la narcolepsie, car la maladie se révèle à un plus jeune âge en Chine [
37]. Dans le cas de l’infection à Streptococcus pyogenes, les marqueurs spécifiques de cette infection, anticorps anti-streptolysine 0 et anti-Dnase B, sont significativement plus élevés chez les patients narcoleptiques que chez les contrôles, et ce d’autant plus que le diagnostic de narcolepsie est récent [
38]. Il est possible que cet agent infectieux ne soit qu’un simple co-infectant des virus à influenza ou d’autres pathogènes associés au développement de la narcolepsie. |
Narcolepsie et vaccination contre la grippe H1N1 de 2009 Une augmentation de l’incidence de la narcolepsie a été signalée en Suède et en Finlande après le début de la vaccination contre la grippe pandémique de 2009 [10,
39,
40]. Quatre vaccins ont été administrés en Europe : Pandemrix (GlaxoSmithKline, Allemagne), Panenza (Aventis, France), Focetria (Novartis, Italie), et Celvapan (Baxter, États-Unis) [
41]. Pandemrix a conduit à une augmentation d’un facteur 12,7 de l’incidence de la narcolepsie chez les enfants et les jeunes adultes ayant reçu le vaccin en Finlande (incidences de 9 et 0,7/100 000 personnes chez les vaccinés et non vaccinés respectivement) [
42,
43]. Cette association entre la narcolepsie et Pandemrix a été très vite confirmée dans d’autres pays utilisant également le vaccin, comme l’Irlande, le Royaume-Uni et la France [42,
44–
46]. Curieusement, une telle augmentation de l’incidence de la narcolepsie n’a pas été observée en Amérique du Nord ou dans certains pays d’Amérique du Sud où Arepanrix (GSK, Canada), un vaccin très similaire à Pandemrix, a été utilisé [
47–
49]. Pandemrix et Arepanrix contiennent tous deux la même souche virale, NYMC X-179A, obtenue par recombinaison entre le virus sauvage de 2009 (A/California/07/2009 [H1N1]) et une souche dérivée de la souche H1N1 de 1934 (PR8). Pendant la pandémie de 2009, cette souche a été très rapidement délaissée pour NYMC X-181, une souche issue de X-179A dont le taux de production était plus élevé. Ainsi, la plupart des vaccins utilisés, comme Focetria, contiennent X-181 et non 179A. Les deux souches sont identiques excepté pour l’acide aminé 129 de l’hémagglutinine (N pour la souche 179A et le virus sauvage de 2009 et D pour la souche 181) [
50,
51]. Ainsi, la position de Pandemrix et Arepanrix est bien singulière parmi les vaccins utilisés à cette époque (combinaison de AS03, un adjuvant très fort, avec une souche très peu utilisée par la suite) [
52]. Mais Pandemrix se démarque également d’Arepanrix, car son protocole d’obtention est un peu différent. Pandemrix a été développé en suivant le procédé Fluarix tandis qu’Arepanrix a été conçu en utilisant le procédé Flulaval. Ces deux méthodes, Fluarix et Flulaval (les noms sont tirés de vaccins saisonniers antérieurs à la pandémie H1N1 de 2009), reposent sur quatre étapes communes (propagation, purification, splitting et inactivation), mais apparaissant dans un ordre différent. Ainsi, il est possible que Pandemrix et Arepanrix ne présentent pas les mêmes quantités de protéines virales. Par ailleurs, comme la propagation est réalisée dans des œufs de poulet et que du déoxycholate de sodium (détergent issu de bile bovine) est utilisé au moment des dernières étapes de la préparation vaccinale, il est probable que ces vaccins contiennent un certain nombre de protéines de poulet et de protéines bovines. Il est difficile de mesurer l’importance de la présence de telles protéines dans le développement de la narcolepsie, car il est probable que si on les retrouve dans Pandemrix ou Arepanrix, elles soient également présentes dans Fluarix et Flulaval qui n’ont pas été associés à la narcolepsie. Une autre hypothèse est que ces différences de protocole entraînent des modifications post-traductionnelles des protéines virales. Les protéines virales adopteraient alors des conformations tridimensionnelles différentes et auraient des effets immunogènes différents de ceux de leurs conformations initiales. Pour comprendre pourquoi Pandemrix a conduit à une telle augmentation des cas de narcolepsie, il est crucial de comparer ce vaccin avec Arepanrix et également avec d’autres vaccins mis sur le marché au même moment (dont Focetria ou Panenza). Il est également important de se rappeler que les populations vaccinées en Europe et en Amérique du Nord sont probablement différentes en termes de susceptibilité immunologique et d’exposition antérieure à des facteurs environnementaux. Enfin, toujours dans le contexte de la narcolepsie de type 1, une étude vient de mettre en évidence, chez 27 % des patients narcoleptiques, la présence d’anticorps ciblant des régions diverses comme l’hypothalamus (dirigés contre les neurones à MCH [melanin concentrating hormone] et non à hypocrétine, étonnamment), mais aussi le cortex et les ganglions de la base [
54]. L’épitope reconnu par les anticorps dirigés contre les neurones à MCH (7 % des patients narcoleptiques dans cette étude) a été identifié : la partie carboxy-terminale du peptide NEI (neuropeptide glutamic acid-isoleucine) commun avec l’a-melanocyte stimulating hormone (αMSH). Toutefois, ces anticorps, bien que potentiellement impliqués dans la régulation du sommeil, sont aussi retrouvés dans d’autres populations de sujets non narcoleptiques, sans lien direct avec le contexte de vaccination H1N1, s’avérant ainsi non spécifiques. Cette découverte vient complexifier les hypothèses physiopathologiques actuelles sur la narcolepsie de type 1 et son lien avec le H1N1 en impliquant, outre l’immunité cellulaire lymphocytaire T CD4+ et CD8+, l’immunité humorale et ainsi les lymphocytes B, comme le suggérait la récente étude sur les cytokines chez ces patients [
55]. |
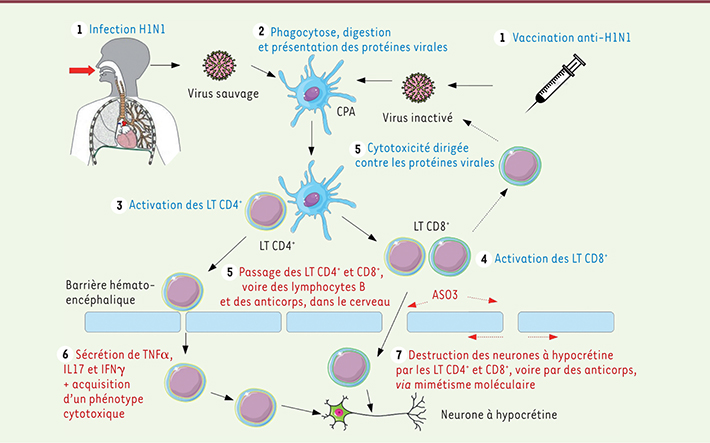
La narcolepsie de type 1 est un trouble du sommeil rare caractérisé par la destruction des neurones à hypocrétine dans un contexte génétique particulier : présence du HLA-DQB1*06:02 et, dans une moindre mesure, d’autres polymorphismes présents dans des gènes impliqués dans la réponse immunitaire. La narcolepsie n’est toutefois pas une maladie purement génétique ; elle fait intervenir des facteurs de l’environnement, notamment les infections à influenza, saisonnières ou pandémiques, et la vaccination antigrippale de 2009. Plusieurs études indépendantes ont montré le lien qu’entretient la narcolepsie avec le virus H1N1 et la vaccination associée, et soulèvent la question de l’étiologie de cette intrication, et plus globalement de la pathogénie de la narcolepsie elle-même. L’hypothèse actuelle – qui n’est pas encore démontrée avec certitude - repose sur la destruction des neurones à hypocrétine via l’activation du système immunitaire induite par un mimétisme moléculaire et survenant sur un terrain génétique prédisposé (Figure 3). Un épisode infectieux ou une vaccination activeraient les lymphocytes CD4+ qui activeraient eux-mêmes les lymphocytes CD8+. Ces cellules immunes spécifiques d’un antigène donné migreraient dans le cerveau via la barrière hémato-encéphalique, reconnaîtraient puis détruiraient les neurones à hypocrétine exprimant une protéine partageant une certaine homologie avec un antigène viral. ‡
 | Figure 3.
Destruction des neurones à hypocrétine par le système immunitaire après infection ou vaccination H1N1. CPA : cellule présentatrice d’antigène ; LT : lymphocyte T ; AS03 : molécule augmentant la perméabilité de la barrière hémato-encéphalique et contenue dans l’adjuvant de Pandemrix. Les étapes en bleu et rouge sont associées respectivement aux connaissances et hypothèses actuelles. Les acteurs moléculaires des interactions entre cellules n’ont pas été représentés pour plus de clarté (voir
Figure 2
). |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Schenck
CH
,
Bassetti
CL
,
Arnulf
I
,
Mignot
E
. English translations of the first clinical reports on narcolepsy and cataplexy by Westphal and Gélineau in the late 19th century, with commentary . J Clin Sleep Med.
2007; ; 3 : :301.–1. 2.
Gélineau
JB
. De la narcolepsie . Gazette des Hôpitaux Civils et Militaires.
1880; ; 53 : :626.–8
et 1881; 54 : 635-7.. 3.
Billiard
M
. Narcolepsy. Clinical features and aetiology . Ann Clin Res.
1985; ; 17 : :220.–6. 4.
Parkes
JD
,
Fenton
G
,
Struthers
G
, et al. Record C: narcolepsy and cataplexy. Clinical features, treatment and cerebrospinal fluid findings . QJM.
1974; ; 43 : :525.–36. 5.
Murray
TJ
,
Foley
A
. Narcolepsy . Can Med Assoc J.
1974; ; 110 : :63.–6. 6.
Dauvilliers
Y
,
Arnulf
I
,
Mignot
E
. Narcolepsy with cataplexy . Lancet.
2007; ; 369 : :499.–511. 7.
Okun
ML
,
Lin
L
,
Pelin
Z
, et al. Clinical aspects of narcolepsy-cataplexy across ethnic groups . Sleep.
2002; ; 25 : :27.–35. 8.
International Classification of Sleep Disorders, third edition (ICSD-3). American Academy of Sleep Medicine, 2014. http://www.aasmnet.org
.
9.
DSM-5 Development.. In : DSM-5. The future of psychiatric diagnosis . American Psychiatric Association; , 2013. 10.
Mahlios
J
,
De la Herrán-Arita
AK
,
Mignot
E
. The autoimmune basis of narcolepsy . Curr Opin Neurobiol.
2013; ; 23 : :767.–73. 11.
Honda
Y.
. Census of narcolepsy, cataplexy, sleep life among teenagers in Fujisawa city . Sleep Res.
1979; ; 8 : :191.. 12.
Tashiro
T
,
Kanbayashi
T
,
Hishikawa
Y.
. An epidemiological study on prevalence of narcolepsy in Japanese . Sleep Res.
1992; ; 1 ((suppl)) : :228.. 13.
Lavie
P
,
Peled
R
. Narcolepsy is a rare disease in Israel . Sleep.
1987; ; 10 : :608.–9. 14.
Wise
MS
. Childhood narcolepsy . Neurology.
1998; ; 50 : :S37.–42. 15.
Mignot
E
. Genetic and familial aspects of narcolepsy . Neurology.
1998; ; 50 : :S16.–22. 16.
Overeem
S
,
Black
JL
,
Lammers
GJ
. Narcolepsy: immunological aspects . Sleep Med Rev.
2008; ; 12 : :95.–107. 17.
Pizza
F
,
Franceschini
C
,
Peltola
H
, et al. Clinical and polysomnographic course of childhood narcolepsy with cataplexy . Brain J Neurol.
2013; ; 136 : :3787.–95. 18.
Lin
L
,
Faraco
J
,
Li
R
, et al. The sleep disorder canine narcolepsy is caused by a mutation in the hypocretin (orexin) receptor 2 gene . Cell.
1999; ; 98 : :365.–76. 19.
Chemelli
RM
,
Willie
JT
,
Sinton
CM
, et al. Narcolepsy in orexin knockout mice: molecular genetics of sleep regulation . Cell.
1999; ; 98 : :437.–51. 20.
Tsujino
N
,
Sakurai
T
. Orexin/hypocretin: A neuropeptide at the interface of sleep, energy homeostasis, and reward system . Pharmacol Rev.
2009; ; 61 : :162.–76. 21.
Nishino
S
,
Takeshi
S
(eds). The orexin/hypocretin system, Physiology and pathophysiology. , Humana press; , 2005 : :416. p. 22.
Heier
MS
,
Jansson
TS
,
Gautvik
KM
. Cerebrospinal fluid hypocretin 1 deficiency, overweight, and metabolic dysregulation in patients with narcolepsy . J Clin Sleep Med.
2011; , 7 : :653.–8. 23.
Andlauer
O
,
Moore
H
,
Hong
SC
, et al. Predictors of hypocretin (orexin) deficiency in narcolepsy without cataplexy . Sleep.
2012; ; 35 : :1247.–55. 24.
Mignot
E
,
Hayduk
R
,
Black
J
, et al. HLA DQB1*0602 is associated with cataplexy in 509 narcoleptic patients . Sleep.
1997; ; 20 : :1012.–20. 25.
Tafti
M
,
Hor
H
,
Dauvilliers
Y
, et al. DQB1 locus alone explains most of the risk and protection in narcolepsy with cataplexy in Europe . Sleep.
2014; ; 37 : :19.–25. 26.
Honda
Y
,
Juji
T
(eds). HLA in narcolepsy. , Springer; , 1988 : :210. p. 27.
Juji
T
,
Satake
M
,
Honda
Y
,
Doi
Y
. HLA antigens in Japanese patients with narcolepsy. All the patients were DR2 positive . Tissue Antigens.
1984; ; 24 : :316.–9. 28.
Hallmayer
J
. Narcolepsy is strongly associated with the T-cell receptor alpha locus . Nat Genet.
2009; ; 41 : :708.–11. 29.
Faraco
J
,
Lin
L
,
Kornum
BR
, et al. ImmunoChip study implicates antigen presentation to T cells in narcolepsy . PLoS Genet.
2013; ; 9 : :e1003270.. 30.
Han
F
,
Faraco
J
,
Dong
XS
, et al. Genome wide analysis of narcolepsy in China implicates novel immune loci and reveals changes in association prior to versus after the 2009 H1N1 influenza pandemic . PLoS Genet.
2013; ; 9 : :e1003880.. 31.
Winkelmann
J
,
Lin
L
,
Schormair
B
, et al. Mutations in DNMT1 cause autosomal dominant cerebellar ataxia, deafness and narcolepsy . Hum Mol Genet.
2012; ; 21 : :2205.–10. 32.
Han
F
,
Lin
L
,
Warby
SC
, et al. Narcolepsy onset is seasonal and increased following the 2009 H1N1 pandemic in china . Ann Neurol.
2011; ; 70 : :410.–7. 33.
Han
F
,
Lin
L
,
Li
J
, et al. Decreased incidence of childhood narcolepsy 2 years after the 2009 H1N1 winter flu pandemic . Ann Neurol.
2013; ; 73 : :560.. 34.
Vincent
A
. Encephalitis lethargica: part of a spectrum of post-streptococcal autoimmune diseases?
Brain J Neurol.
2004; ; 127 : :2.–3. 35.
Lehmann
HC
,
Hartung
HP
,
Kieseier
BC
,
Hughes
RAC
. Guillain-Barré syndrome after exposure to influenza virus . Lancet Infect Dis.
2010; ; 10 : :643.–51. 36.
Dauvilliers
Y
,
Arnulf
I
,
Lecendreux
M
, et al. Increased risk of narcolepsy in children and adults after pandemic H1N1 vaccination in France . Brain J Neurol.
2013; ; 136 : :2486.–96. 37.
Han
F
,
Lin
L
,
Li
J
, et al. Presentations of primary hypersomnia in Chinese children . Sleep.
2011; ; 34 : :627.–32. 38.
Aran
A
,
Lin
L
,
Nevsimalova
S
, et al. Elevated anti-streptococcal antibodies in patients with recent narcolepsy onset . Sleep.
2009; ; 32 : :979.–83. 39.
Wijnans
L
,
Lecomte
C
,
de Vries
C
, et al. The incidence of narcolepsy in Europe: before, during, and after the influenza A(H1N1)pdm09 pandemic and vaccination campaigns . Vaccine.
2013; ; 31 : :1246.–54. 40.
Partinen
M
,
Kornum
BR
,
Plazzi
G
, et al. Narcolepsy as an autoimmune disease: the role of H1N1 infection and vaccination . Lancet Neurol.
2014; ; 13 : :600.–13. 41.
Ahmed
SS
,
Schur
PH
,
Macdonald
NE
,
Steinman
L
. Narcolepsy, 2009 A(H1N1) pandemic influenza, and pandemic influenza vaccinations: what is known and unknown about the neurological disorder, the role for autoimmunity, and vaccine adjuvants . J Autoimmun.
2014; ; 50C : :1.–11. 42.
Nohynek
H
,
Jokinen
J
,
Partinen
M
, et al. AS03 adjuvanted AH1N1 vaccine associated with an abrupt increase in the incidence of childhood narcolepsy in Finland . PloS One.
2012; ; 7 : :e33536.. 43.
Partinen
M
,
Saarenpaa-Heikkila
O
,
Ilveskoski
I
, et al. Increased incidence and clinical picture of childhood narcolepsy following the 2009 H1N1 pandemic vaccination campaign in Finland . PLoS One.
2012; ; 7 : :e33723.. 44.
O’Flanagan
D
,
Barret
AS
,
Foley
M
, et al. Investigation of an association between onset of narcolepsy and vaccination with pandemic influenza vaccine, Ireland, April 2009-December 2010 . Euro Surveill.
2014; ; 19 : :15.–25. 45.
Dauvilliers
Y
,
Montplaisir
J
,
Cochen
V
, et al. Post-H1N1 narcolepsy-cataplexy . Sleep.
2010; ; 33 : :1428.–30. 46.
Winstone
AM
,
Stellitano
L
,
Verity
C
, et al. Clinical features of narcolepsy in children vaccinated with AS03 adjuvanted pandemic A/H1N1 2009 influenza vaccine in England . Dev Med Child Neurol.
2014 ; doi : 10.1111/dmcn.12522
.
47.
Mendes
MFSG
,
de Campos Valladares Neto
D
,
de Azevedo
RA
,
Caramelli
P
. Narcolepsy after A/H1N1 vaccination . Clinics.
2012; ; 67 : :77.–8. 48.
Montplaisir
J
,
Petit
D
,
Quinn
MJ
, et al. Risk of narcolepsy associated with inactivated adjuvanted (AS03) A/H1N1 (2009) pandemic influenza vaccine in Quebec . PloS One.
2014; ; 9 : :e108489.. 49.
Duffy
J
,
Weintraub
E
,
Vellozzi
C
,
DeStefano
F
. on behalf of the vaccine safety datalink. Narcolepsy and influenza A(H1N1) pandemic 2009 vaccination in the United States . Neurology.
2014 ; doi : 10.1212/WNL.0000000000000987
.
50.
Nicolson
C
,
Harvey
R
,
Johnson
R
, et al. An additional oligosaccharide moiety in the HA of a pandemic influenza H1N1 candidate vaccine virus confers increased antigen yield in eggs . Vaccine.
2012; ; 30 : :745.–51. 51.
Robertson
JS
,
Nicolson
C
,
Harvey
R
, et al. The development of vaccine viruses against pandemic A(H1N1) influenza . Vaccine.
2011; ; 29 : :1836.–43. 52.
Leroux-Roels
I
,
Roman
F
,
Forgus
S
, et al. Priming with AS03 A-adjuvanted H5N1 influenza vaccine improves the kinetics, magnitude and durability of the immune response after a heterologous booster vaccination: an open non-randomised extension of a double-blind randomised primary study . Vaccine.
2010; ; 28 : :849.–57. 53.
Kornum
BR
,
Kawashima
M
,
Faraco
J
, et al. Common variants in P2RY11 are associated with narcolepsy . Nat Genet.
2011; ; 43 : :66.–71. 54.
Bergman
P
,
Adori
C
,
Vas
S
, et al. Narcolepsy patients have antibodies that stain distinct cell populations in rat brain and influence sleep patterns . Proc Natl Acad Sci USA.
2014; ; 111 : :E3735.–44. 55.
Dauvilliers
Y
,
Jaussent
I
,
Lecendreux
M
, et al. Cerebrospinal fluid and serum cytokine profiles in narcolepsy with cataplexy: a case-control study . Brain Behav Immun.
2014; ; 37 : :260.–6. |