| |
| Med Sci (Paris). 2015 January; 31(1): 9–11. Published online 2015 February 6. doi: 10.1051/medsci/20153101002.Rôle d’HSP70 dans l’érythropoïèse inefficace des β-thalassémies majeures Jean-Benoît Arlet,1,2,3* Jean-Antoine Ribeil,2,3,4 Flavia Guillem,3 Olivier Hermine,3,5 and Geneviève Courtois3 1Service de médecine interne, faculté de médecine Paris Descartes, Sorbonne Paris-Cité et Assistance publique-hôpitaux de Paris, hôpital européen Georges Pompidou, 20, rue Leblanc, 75015Paris, France 2Centre national de référence des syndromes drépanocytaires majeurs 3laboratoire Inserm UMR 1163, CNRS ERL 8254, institut Imagine, hôpital Necker, laboratoire d’excellence sur le globule rouge (GR-Ex) 4département de biothérapie, faculté de médecine Paris Descartes, Sorbonne Paris-Cité et Assistance publique-hôpitaux de Paris, hôpital Necker, Paris, France 5service d’hématologie adulte, faculté de médecine Paris Descartes, Sorbonne Paris-Cité et Assistance publique-hôpitaux de Paris, hôpital Necker, Paris, France MeSH keywords: Animaux, Érythropoïèse, Protéines du choc thermique HSP70, Humains, Transport de protéines, Globines alpha, bêta-Thalassémie, physiologie, métabolisme, sang |
β-thalassémies et érythropoïèse inefficace Les β-thalassémies font partie, avec la drépanocytose, des hémoglobinopathies, maladies génétiques de l’hémoglobine. Ce sont les maladies génétiques les plus fréquentes au monde [1]. Les thalassémies correspondent à un défaut quantitatif total ou partiel de production des chaînes de globine. En cas de déficit en chaîne b, on parle de β-thalassémies ; si les chaînes a sont déficientes, d’a-thalassémies, sachant qu’il est nécessaire d’avoir deux chaînes a et deux chaînes b pour former un tétramètre d’hémoglobine. La conséquence de ce déficit est l’accumulation cytoplasmique de la chaîne partenaire (α pour les β-thalassémies), très toxique car très instable et source d’une cascade oxydative délétère. Cela va conduire à un défaut de production des précurseurs des globules rouges (GR) dans la moelle osseuse, phénomène appelé dysérythropoïèse, et à une destruction précoce des GR en périphérie (hémolyse). La présentation clinique est celle d’une anémie, potentiellement sévère, s’installant dans l’enfance et nécessitant souvent des transfusions régulières (mensuelles pour les β-thalassémies majeures), et, pour lutter contre la surcharge en fer des organes qui en découle, des médicaments chélateurs. Des modifications osseuses (déformations, ostéoporose) sont aussi décrites, ainsi que de véritables tumeurs bénignes liées à une érythropoïèse extramédullaire [1]. Environ 600 patients β-thalassémiques vivent en France, mais c’est une maladie beaucoup plus fréquente dans d’autres régions du monde comme l’Asie du Sud-Est et le pourtour méditerranéen. L’érythropoïèse inefficace joue un rôle central dans la physiopathologie de l’anémie des β-thalassémies majeures (β-TM). Ses caractéristiques sont triple : accélération de la différenciation érythroïde, arrêt de maturation au stade d’érythroblaste polychromatophile et mort par apoptose à ce stade de différenciation déjà avancé [2]. Les mécanismes précis de cette apoptose et de l’arrêt de la maturation n’avaient, jusqu’à présent, jamais été élucidés. |
Rôle d’HSP70 dans l’érythropoïèse physiologique Dans un travail précédent de notre laboratoire, nous avons montré, au cours de l’érythropoïèse physiologique, que la protéine chaperon HSP70 (heat shock protein 70), en s’accumulant dans le noyau des érythroblastes en cours de différenciation, protège GATA-1 (facteur de transcription érythroïde majeur) du clivage par la caspase-3 [3, 4]. Cette enzyme clé de l’apoptose a, dans l’érythropoïèse, une action ambivalente. D’une part, elle est indispensable à la différenciation érythroïde terminale en clivant sélectivement certaines cibles, ce qui entraîne par exemple la condensation du noyau des érythroblastes et des modifications morphologiques qui précèdent l’énucléation permettant la formation du réticulocyte [5]. Elle peut, d’autre part, avoir une fonction délétère. En effet, le sevrage en érythropoïétine (EPO) favorise la sortie nucléaire d’HSP70, ce qui permet à la caspase-3 de cliver GATA-1 (qui n’est plus alors protégé) et bloque la maturation érythroblastique [3]. La localisation nucléaire d’HSP70 représente ainsi un mécanisme fin de régulation de l’érythropoïèse, bien nécessaire car ce processus représente un système de prolifération extraordinaire. La moelle osseuse produisant 200 milliards de GR chaque jour, il convient de contrôler très rapidement l’excès de production, qui peut aboutir à une polyglobulie, ou compenser un défaut, qui se traduirait rapidement par une anémie. La suite naturelle de ce travail était de s’intéresser aux conséquences pathologiques éventuelles de ce système protéique de régulation. |
Rôle physiologique d’HSP70 dans le monde animal. Le rôle ubiquitaire d’HSP70 dans le monde animal est triple [6] :
-
aide à la synthèse peptidique et au transport transmembranaire de protéines. HSP70 permet à des protéines nouvellement formées de se replier correctement, dès leur sortie du ribosome, afin de se présenter dans une conformation structurelle tridimensionnelle (forme native) leur permettant d’assurer leur fonction, la liaison à d’autres protéines ou le transport transmembranaire ;
-
fonctions anti-apoptotiques ;
-
cytoprotection cellulaire vis-à-vis de protéines malformées ou dénaturées (misfolded proteins). HSP70 prend en charge des protéines mal formées, dénaturées, afin de tenter de les remettre dans une conformation physiologique, native, pour éviter qu’elles ne forment des agrégats potentiellement toxiques pour la cellule. HSP70 participe aussi à l’élimination d’agrégats dont la formation n’aurait pas pu être prévenue, dans la phase précédente, par la voie du protéasome.
|
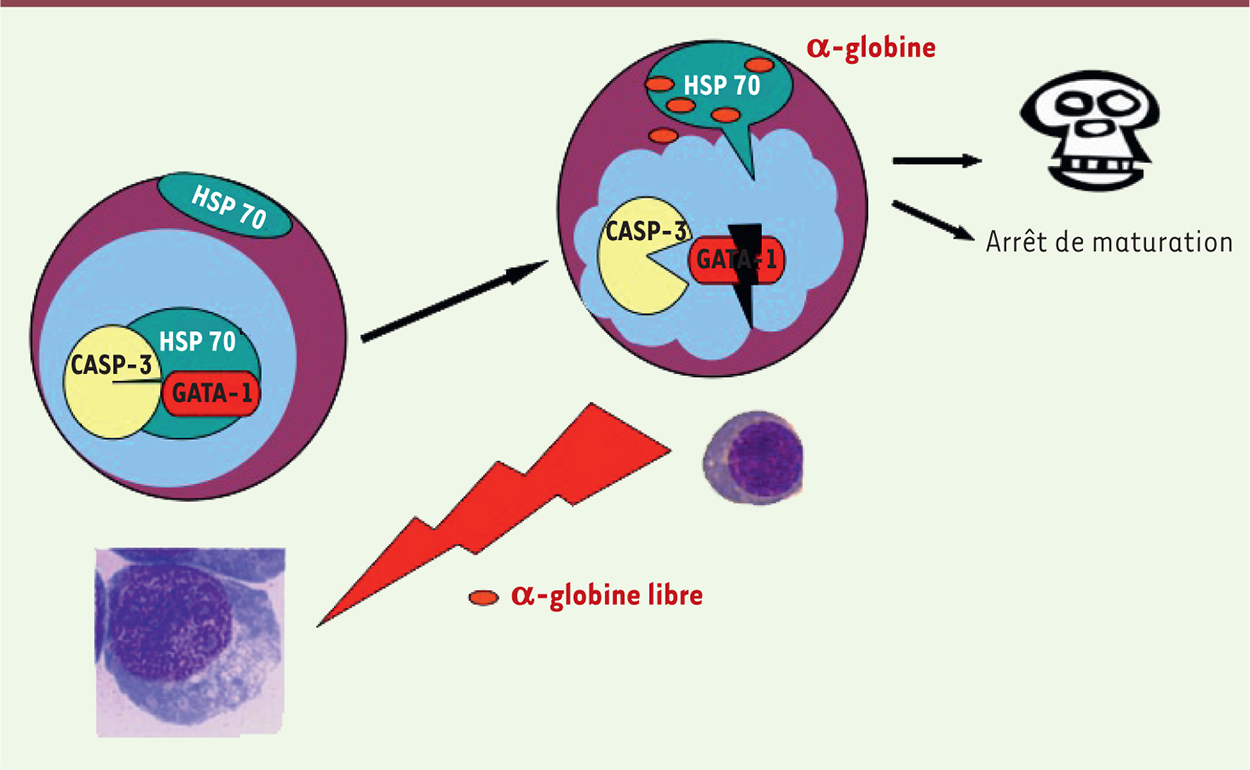
HSP70 dans les β-thalassémies majeures Notre travail, publié récemment dans la revue Nature [7], repose sur l’hypothèse suivante : HSP70 pourrait, au cours de l’érythropoïèse des β-TM, être séquestrée dans le cytoplasme des érythroblastes matures (stade d’une intense hémoglobinisation) afin d’exercer sa fonction naturelle de chaperon des chaînes d’α-globine libres, excessivement toxiques et qui forment des agrégats dans ces cellules. Il en résulterait une absence de localisation nucléaire d’HSP70 et, en conséquence, la destruction de GATA-1, à l’origine de l’arrêt de maturation et de la mort cellulaire (Figure 1).
 | Figure 1.
Hypothèse physiopathologique de l’arrêt de maturation érythroïde dans les β-thalassémies majeures. Au cours de la différenciation, la concentration en chaînes d’α-globine augmente et atteint un taux maximal au stade d’érythroblaste polychromatophile. Ces chaînes libres (non appariées aux chaînes bêta), très toxiques, séquestreraient le chaperon HSP70 dans le cytoplasme. HSP70 ne pourrait alors plus protéger le facteur de transcription nucléaire GATA-1, ce qui entraînerait la mort cellulaire par apoptose et l’arrêt de la maturation. |
Nous avons d’abord montré, par immunocytochimie sur de la moelle osseuse de patients β0-thalassémiques (aucune production de chaînes β), que HSP70 était localisée principalement dans le cytoplasme des érythroblastes matures, et qu’existait un défaut d’expression nucléaire. Par ailleurs, GATA-1 n’était plus exprimée dans ces cellules matures, alors qu’elle l’était dans les cellules matures de moelles osseuses contrôles, ou dans des cellules plus immatures et moins hémoglobinisées (Figure 2). Nous avons confirmé ces résultats in vitro, dans un système de culture cellulaire érythroïde humaine en milieu liquide reproduisant les étapes de la différenciation érythroïde terminale. Nous avons précisé ainsi des données d’autres équipes en montrant que les érythroblastes de β-TM expriment fortement l’annexine V (marqueur d’apoptose) en fin de différenciation, et qu’il existe un blocage de maturation terminale au stade d’érythroblaste polychromatophile (stade tardif de la différenciation érythroïde). Nous avons ensuite démontré qu’il existait une interaction physique directe entre HSP70 et les chaînes d’α-globine libres par différentes techniques : imagerie confocale (colocalisation cytoplasmique), immunoprécipitation, double hybride, interaction biomoléculaire sans marquage. Ainsi, HSP70 apparaît comme un chaperon aussi important que l’AHSP (α-haemoglobin stabilisating protein), seul chaperon spécifique des chaînes α connu à ce jour [8].
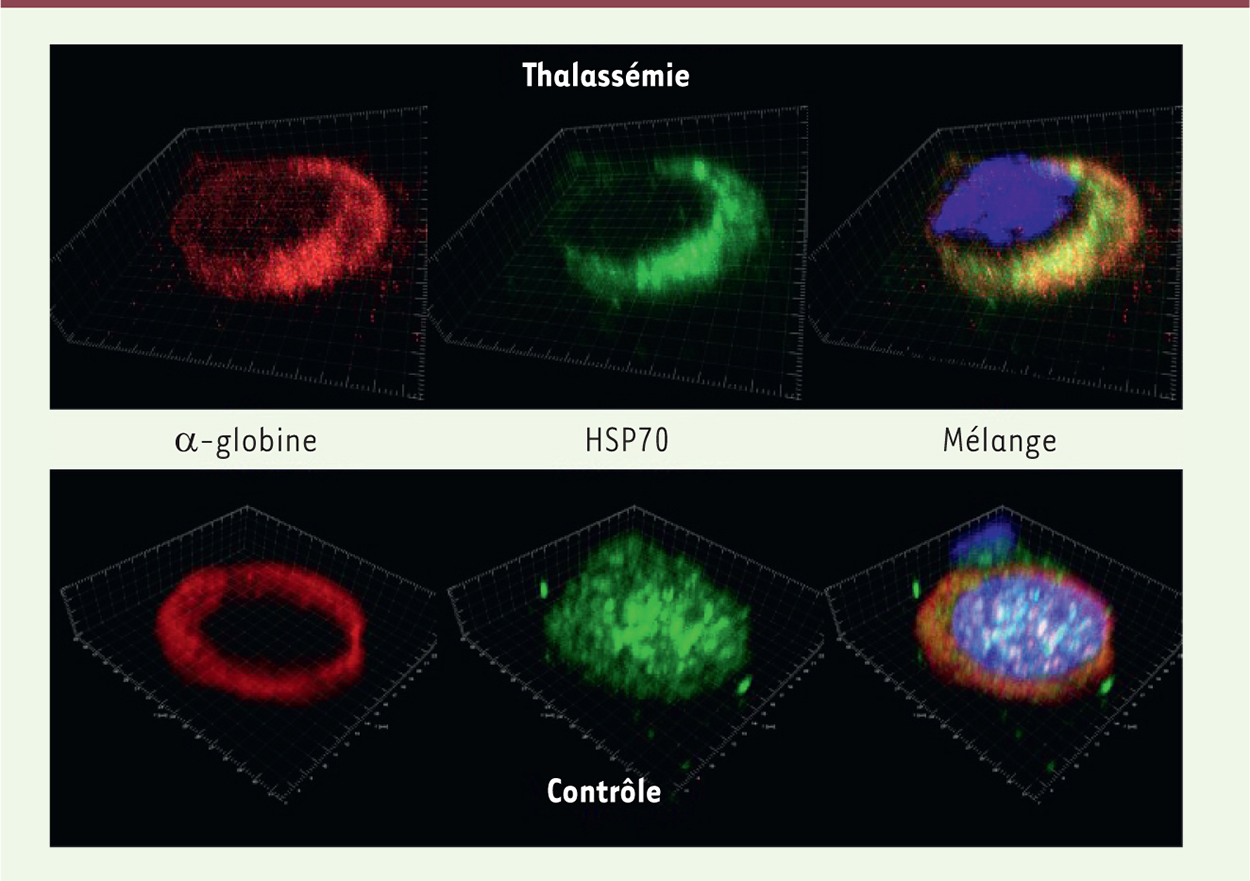
 | Figure 2.
Absence d’expression nucléaire d’HSP70 dans les érythroblastes de patients atteints de β-thalassémie majeure (β-TM). Imagerie par microscopie confocale d’erythroblastes polychromatophiles humains issus d’un patient β-TM et d’un controle adulte sain. L’image en 3D montre l’absence d’HSP70 (vert) dans le noyau (bleu) des erythroblastes β-TM et la colocalisation d’HSP70 avec les chaines d’α-globine (rouge). |
Afin de démontrer que l’arrêt de maturation était lié à l’absence de localisation nucléaire d’HSP70, nous avons transduit des érythroblastes de patients β-TM en culture par un mutant d’HSP70 qui se localise constitutivement dans le noyau (HSP70-S400A). Ce mutant restaure la localisation nucléaire d’HSP70, restitue l’expression de GATA-1, améliore significativement la maturation érythroïde terminale des β-TM en levant le blocage de maturation et diminue l’apoptose tout en augmentant le pourcentage de cellules F (contenant une forte concentration en hémoglobine fœtale, tétramère d’hémoglobine constitué de 2 chaînes α et 2 chaînes γ). La transduction d’un mutant de GATA-1 non clivable par la caspase-3 corrige également la maturation érythroïde terminale, confirmant que le point final physiopathologique des β-TM passe par la destruction de GATA-1. L’infection par un lentivirus restituant la chaîne de β-globine permettait également de relocaliser HSP70 dans le noyau, protéger GATA-1 et améliorer la différenciation terminale. Une modélisation mathématique du complexe HSP70/α-globine nous a enfin permis de préciser les domaines impliqués dans l’interaction, ce qui ouvre la voie à un possible criblage de petites molécules permettant la rupture de ce complexe afin de relocaliser HSP70 dans le noyau, ce qui offrirait ainsi un espoir thérapeutique pour améliorer l’érythropoïèse inefficace des β-TM. Nos résultats démontrent que l’érythropoïèse inefficace des β-TM est, au moins en partie, liée à la séquestration cytoplasmique d’HSP70 par les chaînes α-globine libres, ce qui empêche ainsi son rôle de protecteur nucléaire de GATA-1. Le blocage de cette interaction pourrait être une stratégie thérapeutique innovante pour restaurer la localisation nucléaire de HSP70 et ainsi améliorer l’érythropoïèse, et donc l’anémie, des patients thalassémiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Higgs DR, Engel JD, Stamatoyannopoulos G Thalassaemia . Lancet. 2012; ; 379 : :373.–383. 2.
Ribeil JA, Arlet JB, Dussiot M, et al. Ineffective erythropoiesis in β-thalassemia . Scientific World Journal. 2013; :394295.. 3.
Ribeil JA, Zermati Y, Vandekerckhove J et al. Hsp70 regulates erythropoiesis by preventing caspase-3-mediated cleavage of GATA-1 . Nature. 2007; ; 445 : :102.–105. 4.
Vandekerckhove J, Ribeil JA, Zermati Y, et al. Hsp70, l’ange gardien de GATA-1 lors de la différenciation des globules rouges . Med Sci (Paris). 2008; ; 1 : :37.–40. 5.
Zermati Y, Garrido C, Amsellem S, et al. Caspase activation is required for terminal erythroid differentiation . J Exp Med. 2001; ; 193 : :247.–254. 6.
Hartl FU, Bracher A, Hayer-Hartl M. Molecular chaperones in protein folding and proteostasis . Nature. 2011; ; 475 : :324.–332. 7.
Arlet JB, Ribeil JA, Guillem F et al. HSP70 sequestration by free a-globin promotes ineffective erythropoiesis in beta-thalassaemia . Nature. 2014; ; 514 : :242.–246. 8.
Kihm AJ, Kong Y, Hong W et al. An abundant erythroid protein that stabilizes free alpha-haemoglobin . Nature. 2002; ; 417 : :758.–763. |