| |
| Med Sci (Paris). 2015 January; 31(1): 25–27. Published online 2015 February 6. doi: 10.1051/medsci/20153101008.Le somite : l’organe central de l’hématopoïèse aortique Claire Pouget1* and Isao Kobayashi1 1University of California, San Diego, 9500 Gilman Drive, Natural Sciences Building, 92093-0380La Jolla, États-Unis MeSH keywords: Animaux, Embryon non mammalien, Hématopoïèse, Cellules souches hématopoïétiques, Somites, Niche de cellules souches, Danio zébré, physiologie, cytologie, embryologie |
Chaque jour, plusieurs milliards de cellules sanguines sont remplacées grâce aux cellules souches hématopoïétiques (CSH). En raison de ce potentiel unique d’autorenouvellement et de différenciation, les CSH sont couramment utilisées dans le traitement de maladies hématologiques. Cependant, le manque de donneurs, ainsi que le risque de rejet des cellules greffées, ont poussé la communauté scientifique à développer des sources alternatives de CSH. L’utilisation de cellules embryonnaires souches ou de cellules adultes reprogrammées (induced pluripotent stem cells), dont la différenciation vers un programme hématopoïétique peut être induite à volonté au laboratoire, constitue depuis plusieurs années l’Eldorado de la médecine régénérative. Cependant, malgré des progrès considérables, l’obtention de CSH fonctionnelles ex vivo à partir de ces cellules souches pluripotentes se heurte à des difficultés pour le moment infranchissables. Pour comprendre comment les CSH se forment, il est important de retracer les différentes étapes cellulaires et moléculaires empruntées par ces cellules, depuis leur spécification jusqu’à leur formation. |
Spécification hématopoïétique des précurseurs de l’endothélium hémogénique Il est largement admis que chez l’ensemble des vertébrés, l’aorte embryonnaire est un des sites majeurs d’émergence des CSH [1, 2, 10, 11] (→). Ces dernières apparaissent dans la partie ventrale de l’aorte, à partir de l’endothélium hémogénique (EH), seul capable de produire des CSH multipotentes [3]. Le modèle moléculaire établi chez le poisson zèbre et qui rend compte de la spécification des CSH, repose sur l’interaction génétique de trois voies de signalisation : Sonic Hedgehog, sécrété par le plancher du tube neural et la notochorde, active la voie de signalisation du VEGF-A (vascular endothelial growth factor) dans les somites. Puis, VEGF-A induit la transcription des gènes codant pour les récepteurs Notch dans l’endothélium aortique. Enfin, l’activation de la voie Notch induit l’expression du facteur de transcription runx1, essentiel à la formation des CSH dans le plancher de l’aorte [4]. L’inconvénient majeur de ce modèle est qu’il ne permet pas de discriminer, au sein des cellules endothéliales, la composante hémogénique du contingent artériel avant l’initiation de l’expression de runx1.
(→) Voir la Nouvelle de P. Charbord et al., page 12 de ce numéro
Plusieurs études publiées récemment ont apporté un éclairage nouveau sur les mécanismes cellulaires et moléculaires aboutissant à la spécification des précurseurs de l’endothélium hémogénique. On sait depuis peu que l’identité artérielle est induite dès le stade 5 somites, soit bien avant la formation de l’aorte. Ce processus est contrôlé par la voie Notch [5] qui agit directement sur les précurseurs endothéliaux. La modulation précoce de la voie Notch affecte la formation de l’aorte, mais aussi celle des CSH. En revanche, lorsque l’activité de la voie Notch est altérée suite à la perte de fonction du ligand Wnt16, le développement artériel se déroule normalement, mais l’aorte ne produit pas de CSH [6], indiquant un défaut de spécification de l’endothélium hémogénique. Ces résultats révèlent que, contrairement à ce qui était admis jusqu’alors, les précurseurs artériels et hémogéniques sont spécifies séparément très tôt au cours du développement embryonnaire. Selon les auteurs, le défaut d’instruction de l’endothélium hémogénique résulte de l’altération de l’expression des ligands de Notch, DeltaC et DeltaD, exprimés dans le sclérotome qui forme le compartiment ventral du somite. |
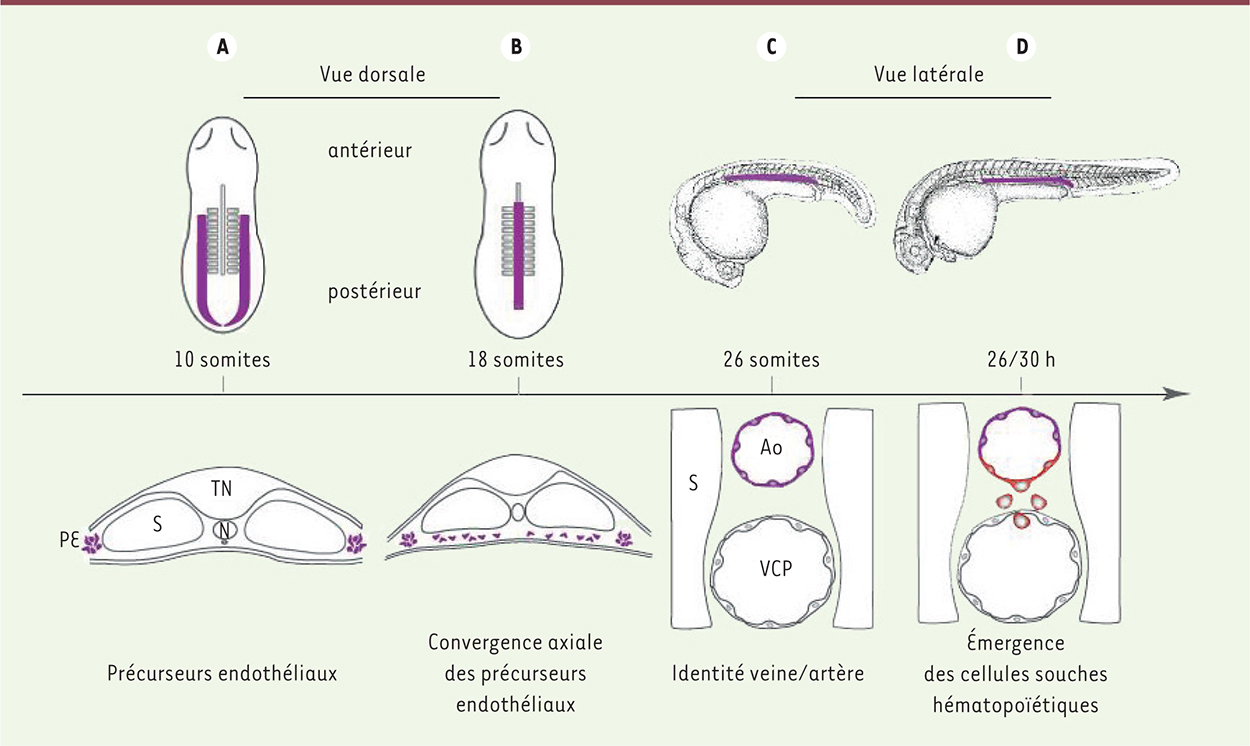
Rôle clé des molécules Jam dans les contacts entre le sclérotome et les précurseurs endothéliaux Quel rôle joue le somite dans la spécification de l’endothélium hémogénique ? Existe-t-il un relais moléculaire entre le sclérotome exprimant DeltaC/DeltaD et les précurseurs des CSH ? Pour répondre à ces questions, il est important de comprendre comment se différencie l’aorte chez le poisson zèbre (Figure 1). Les précurseurs endothéliaux se forment à partir du mésoderme postérieur latéral situé de part et d’autre des somites. À partir du stade 12 somites, les précurseurs endothéliaux contenant l’endothélium hémogénique convergent vers la ligne médiane. Au stade 18 somites, la migration prend fin et les précurseurs endothéliaux forment un cordon vasculaire entre les somites et la notochorde. L’aorte et la veine cardinale s’individualisent vers le stade 26 somites et l’hématopoïèse définitive, marquée par l’expression de runx1, commence peu après.
 | Figure 1.
Formation du système vasculaire dans l’embryon de poisson zèbre. A. Les précurseurs endothéliaux (PE) se différencient à partir du mésoderme postérieur de la lame latérale, de part et d’autre des somites (S). B. Ces cellules migrent axialement, sous les somites, à partir du stade 12 somites. Dans les embryons au stade 18 somites, les précurseurs endothéliaux forment un cordon vasculaire primitif visible dans la partie médiane de l’embryon, sous le tube neural (TN) et la notochorde (N). C. L’aorte (Ao) et la veine cardinale postérieure (VCP) s’individualisent. À ce stade, l’identité veine/artère est établie au niveau moléculaire. D. Les cellules souches hématopoïétiques et les progéniteurs émergent exclusivement dans la partie ventrale de l’aorte. Ces cellules se détachent du plancher du vaisseau et rejoignent la circulation en s’insérant entre les cellules endothéliales formant le toit de la veine cardinale. |
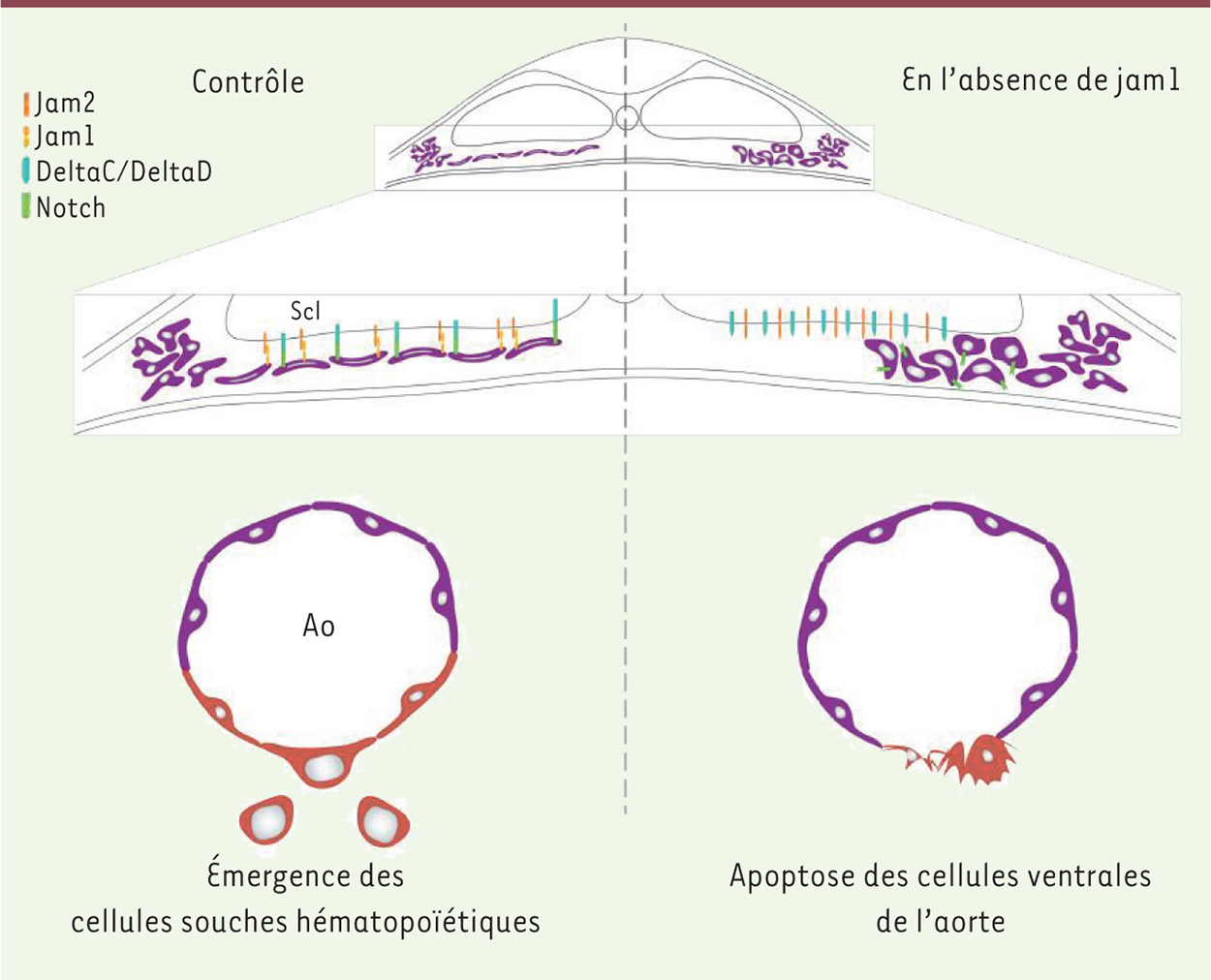
Au cours du processus de migration, les précurseurs endothéliaux entrent en étroit contact avec le sclérotome. Cette observation a incité Kobayashi et ses collègues à émettre l’hypothèse selon laquelle les contacts cellule-cellule entre le sclérotome et les précurseurs endothéliaux pourraient jouer un rôle dans la spécification de l’endothélium hémogénique et des CSH [7]. Les CSH expriment un large répertoire de molécules d’adhésion cellulaire. Parmi celles-ci, Jam1 apparaît comme un candidat de choix. Dans l’embryon de poisson zèbre, Jam1 est exprimée entre les stades 10 et 18 somites par les précurseurs endothéliaux, alors que Jam2, un des partenaires d’interaction de Jam1, est exclusivement localisée dans les somites. Lorsque la fonction de Jam1 ou Jam2 est affectée chez l’embryon, les précurseurs endothéliaux des embryons présentent un retard de migration. De plus, leur morphologie arrondie et compactée entraîne une réduction de leur surface d’interaction avec les cellules du sclérotome. Ce phénotype s’accompagne d’un défaut d’apparition des CSH, bien que l’artère se différencie normalement. La voie Notch est une voie de signalisation juxtacrine dont l’activité repose sur des contacts cellule-cellule. La similitude de fonctionnement des voies Notch et Jam1/Jam2 a incité les auteurs à vérifier si la modulation des propriétés d’adhésion cellulaire pouvait affecter l’activité de la voie Notch. Pour ce faire, ils ont utilisé la lignée transgénique Tp1:GFP, dont l’intensité de fluorescence témoigne de l‘activité de la voie Notch. Chez les embryons contrôles, le signal GFP est visible dans les précurseurs endothéliaux au stade 18 somites. En revanche, il est absent dans les embryons déficients pour Jam1 au stade équivalent, démontrant que l’établissement de contacts forts entre les cellules du sclérotome et des précurseurs endothéliaux est nécessaire à l’activation de la voie Notch. Plus surprenant, en l’absence d’activation de la voie Notch, le nombre de cellules apoptotiques visibles dans l’aorte est significativement plus élevé, particulièrement dans la partie ventrale de l’artère. La conclusion de cette étude est que la robustesse de l’interaction entre les cellules exprimant Jam1 et celles exprimant Jam2 renforce l’intensité de l’activation de la voie Notch dans les précurseurs endothéliaux, déclenchant ainsi la spécification de l’endothélium hémogénique (Figure 2). Ce processus se déroule lors de la migration axiale des précurseurs endothéliaux, entre les stades 10 et 18 somites, devançant de près de 5 heures l’initiation de l’expression aortique de runx1.
 | Figure 2.
Modèle d’action de la voie Notch sur les précurseurs des CSH. Les précurseurs endothéliaux jam1+ convergent vers la ligne médiane. En chemin, ils interagissent avec le sclérotome (Scl) jam2+. Cette interaction accroît la surface d’interaction des précurseurs endothéliaux avec les cellules du sclérotome, augmentant l’activité de la voie DeltaC/DeltaD/Notch. Ces interactions conditionnent la spécification de l’endothélium hémogénique et des CSH. En absence de Jam1, la converge nce des précurseurs endothéliaux est plus lente. La faible interaction entre les précurseurs endothéliaux et le sclérotome aboutit à une réduction de l’activité de la voie Notch et finalement à l’apoptose des précurseurs des CSH. |
|
Un nouveau rôle du somite dans le support hématopoïétique Cette étude pose de nombreuses questions : comment identifier les précurseurs de l’endothélium hémogénique au sein des précurseurs endothéliaux ? Pourquoi les CSH apparaissent-elles vers 26/30 h de développement [4, 8] alors que l’endothélium hémogénique est spécifié dès le stade 18 somites ? Quels sont les événements moléculaires contrôlant l’hématopoïèse en aval de la voie Jam/Notch ? L’un de ces signaux pourrait, une fois encore, provenir des somites. D’élégantes expériences de traçage cellulaire ont montré que des cellules d’origine somitique, provenant de l’endotome, s’intercalent dans l’endothélium aortique peu avant le déclenchement de l’hématopoïèse [9]. Ces cellules ne contribuent pas directement au contingent de CSH, mais promeuvent leur formation en sécrétant une chémokine, Cxcl12, connue pour stimuler l’hématopoïèse [11]. Bien que cela ne soit pas analysé en détail, les auteurs ont aussi constaté que l’endotome fournit, outre les cellules endothéliales, un petit contingent de cellules périvasculaires. Les travaux futurs détermineront si ces dernières jouent un rôle dans le déclenchement de l’hématopoïèse définitive, notamment en contribuant à la formation de la niche aortique, dont l’origine embryonnaire n’a pas encore été identifiée chez le poisson zèbre. L’ensemble des résultats apportés par ces études soulignent le rôle majeur, et souvent sous-estimé dans les approches in vitro, des interactions cellulaires et des facteurs environnementaux dans la spécification et le déclenchement de l’hématopoïèse définitive. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Ciau-Uitz A, Monteiro R, Kirmizitas A, Patient R. Developmental hematopoiesis: ontogeny, genetic programming and conservation . Exp Hematol. 2014; ; 42 : :669.–683. 2.
Dzierzak E, Speck NA. Of lineage and legacy: the development of mammalian hematopoietic stem cells . Nat Immunol. 2008; ; 9 : :129.–136. 3.
Taoudi S, Medvinsky A. Functional identification of the hematopoietic stem cell niche in the ventral domain of the embryonic dorsal aorta . Proc Natl Acad Sci USA. 2007; ; 104 : :9399.–9403. 4.
Kissa K, Herbomel P. Blood stem cells emerge from aortic endothelium by a novel type of cell transition . Nature. 2010; ; 464 : :112.–115. 5.
Quillien A, Moore JC, Shin M, et al. Distinct Notch signaling outputs pattern the developing arterial system . Development. 2014; ; 141 : :1544.–1552. 6.
Clements WK, Kim AD, Ong KG, et al. A somitic Wnt16/Notch pathway specifies haematopoietic stem cells . Nature. 2011; ; 474 : :220.–224. 7.
Kobayashi I, Kobayashi-Sun J, Kim AD, et al. Jam1a-Jam2a interactions regulate haematopoietic stem cell fate through Notch signalling . Nature. 2014; ; 512 : :319.–323. 8.
Bertrand JY, Chi NC, Santoso B, et al. Haematopoietic stem cells derive directly from aortic endothelium during development . Nature. 2010; ; 464 : :108.–111. 9.
Nguyen PD, Hollway GE, Sonntag C, et al. Haematopoietic stem cell induction by somite-derived endothelial cells controlled by meox1 . Nature. 2014; ; 512 : :314.–318. 10.
Boisset JC, Robin C. Origine endothéliale des cellules souches hématopoïétiques : la preuve en image . Med Sci (Paris). 2011; ; 27 : :875.–881. 11.
Charbord P, Jaffredo T, Durand C. Le cœur moléculaire de la fonction de la niche des cellules souches hématopoïétiques . Med Sci (Paris). 2015; ; 31 : :12.–14. |