| |
| Med Sci (Paris). 2015 January; 31(1): 31–34. Published online 2015 February 6. doi: 10.1051/medsci/20153101010.APOO, une protéine mitochondriale impliquée dans la cardiomyopathie diabétique Philippe Rouet,1* Romain Harmancey,1 Annie Turkieh,1 Céline Caubère,1 Manon Barutaut,1 François Koukoui,1 Camille Dambrin,1 Michel Galinier,1 and Fatima Smih1* 1Inserm U1048, équipe 7, obésité et insuffisance cardiaque : approches moléculaires et cliniques, BP 84225, 1, avenue Jean Poulhès, 31432Toulouse Cedex 4, France MeSH keywords: Apolipoprotéines, Cardiomyopathies diabétiques, Humains, Métabolisme des lipides, Troubles du métabolisme lipidique, Mitochondries du myocarde, physiologie, génétique, métabolisme |
Environ 2,9 millions de personnes souffrent de diabète en France [1]. Ce nombre a doublé en 10 ans. Le diabète non insulinodépendant, plus communément appelé diabète de type 2, représente près de 92 % des cas de diabète et sa prévalence ne cesse d’augmenter, dopée par la généralisation de l’inactivité physique, d’une alimentation hypercalorique et de l’obésité. Les maladies cardiovasculaires sont responsables de près de 65 % des décès liés au diabète [2]. En plus d’accroître le risque de maladie des artères coronaires et de neuropathie autonome cardiaque, le diabète peut directement affecter la fonction de la pompe cardiaque. Cette cardiomyopathie diabétique se caractérise par un dysfonctionnement ventriculaire gauche qui se développe en l’absence d’athérosclérose, d’hypertension ou de maladie valvulaire. Elle touche initialement la fonction diastolique, avec altération du remplissage ventriculaire précoce, prolongation de la relaxation isovolumétrique et augmentation du remplissage tardif sous la dépendance de la contraction auriculaire, et évolue souvent vers un affaiblissement de la contraction du muscle cardiaque (dysfonctionnement systolique) [3, 4]. Bien que la pathogenèse de la cardiomyopathie diabétique ne soit pas clairement établie chez l’homme, les études menées chez l’animal suggèrent un rôle prépondérant de la dérégulation du métabolisme cardiaque et un dysfonctionnement mitochondrial [5]. |
Diabète et perte de la flexibilité métabolique cardiaque Afin d’assurer le transport de l’oxygène et de nutriments dans l’organisme, le cœur d’un homme adulte doit pomper plus de 7 000 litres de sang par jour. Le fonctionnement ininterrompu de la pompe cardiaque requiert une quantité phénoménale d’énergie produite sous la forme d’ATP [6]. La production d’ATP est assurée par un nombre très élevé de mitochondries qui occupent 40 % du volume des cardiomyocytes (Figure 1A). Le cœur compense ses faibles réserves énergétiques par sa capacité à capter et à oxyder dans ses mitochondries une large variété de nutriments incluant à la fois lipides, carbohydrates, acides aminés et corps cétoniques [6]. En temps normal, le cœur dérive 60 à 70 % de ses besoins en énergie des lipides (acides gras libres circulants et triglycérides liés aux lipoprotéines), le reste provenant essentiellement de la consommation de carbohydrates (glucose et lactate). Le métabolisme cardiaque n’est cependant pas figé. Ainsi, le cœur peut augmenter la part relative des carbohydrates oxydés pour faire face à une augmentation de sa charge de travail. En contrepartie, une augmentation de l’utilisation des acides gras conduit à une diminution réciproque de l’oxydation des carbohydrates par un jeu d’inhibition allostérique d’enzymes clés de la glycolyse et du catabolisme du pyruvate [7, 8].
 | Figure 1.
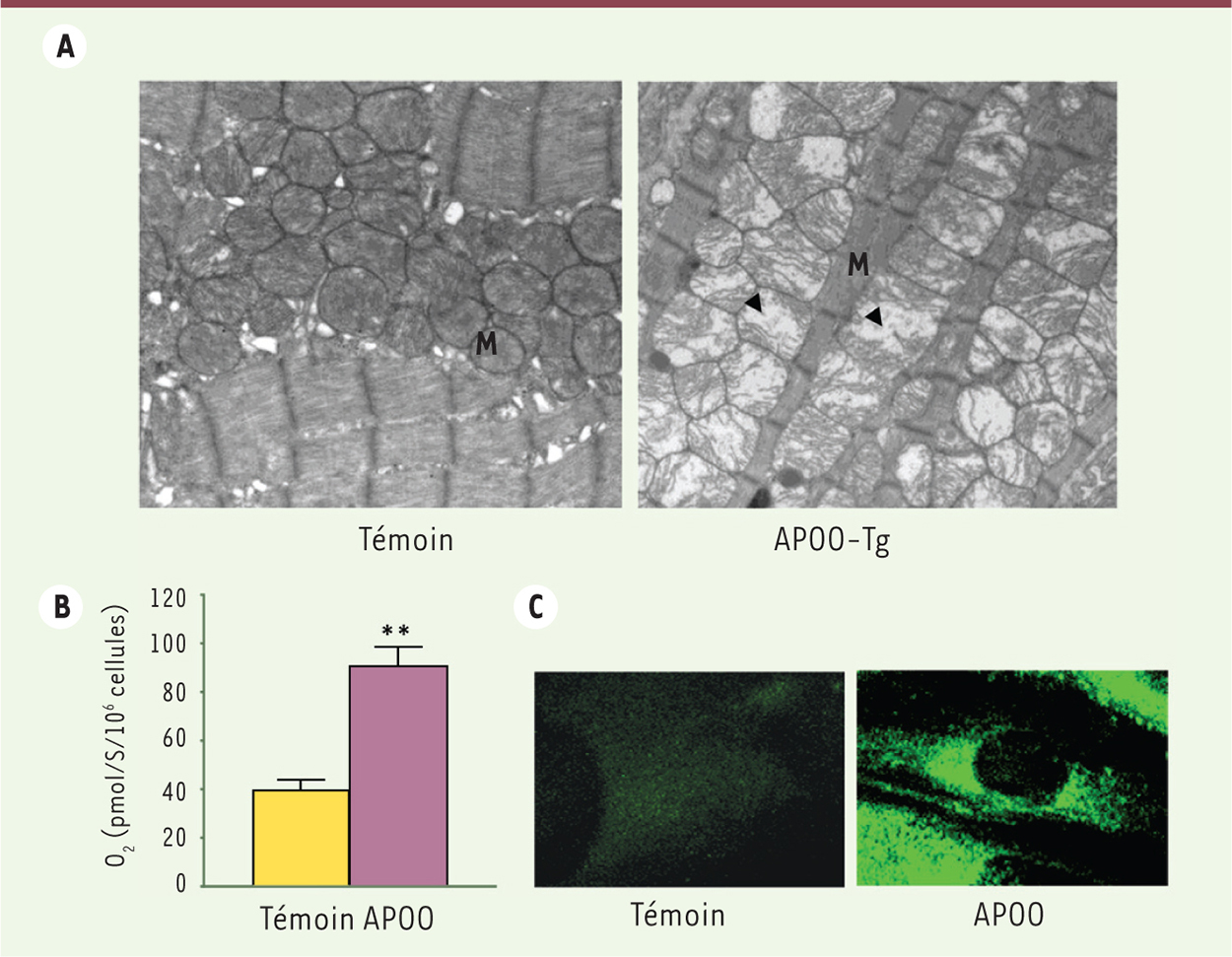
La surexpression de l’APOO altère la fonction mitochondriale et active la captation des lipides par le cardiomyocyte. A. Images en microscopie électronique à transmission de coupes longitudinales du myocarde de souris témoins et transgéniques (APOO-Tg). B. Consommation d’oxygène par des cardiomyocytes témoins ou surexprimant l’APOO (APOO). C. Images en microscopie confocale de ces cellules traitées pendant 2 min par un lipide fluorescent (BODIPY-palmitate). M : mitochondrie. Les flèches noires indiquent des mitochondries déstructurées. |
L’obésité et le diabète se caractérisent par une augmentation des taux circulants d’acides gras. La captation de cet excès de lipides par le cœur est facilitée par une augmentation de l’expression des trois transporteurs membranaires d’acides gras au niveau des cardiomyocytes : CD36 (appartenant à la famille des scavenger receptors, connu aussi sous le nom de FAT, fatty acid translocase), FATP (fatty acid transport protein) et FABPm (fatty acid-binding protein, muscle). En raison de cet apport continu d’acides gras, la quasi-totalité de l’énergie dont le cœur a besoin provient automatiquement des lipides, ce qui provoque une perte de la flexibilité métabolique cardiaque. De plus, l’oxydation excessive d’acides gras est néfaste pour le fonctionnement de la pompe cardiaque, car elle conduit à une augmentation de la consommation d’oxygène par molécule d’ATP produite. Cette perte d’efficacité cardiaque est liée à un phénomène stœchiométrique et au découplage des mitochondries1, causé par une augmentation de la production d’espèces réactives de l’oxygène (ROS) au niveau de la chaîne respiratoire. L’hyperlipidémie des diabétiques conduit ainsi à une diminution des réserves énergétiques cardiaques [8]. |
Une accumulation de « substances grasses » à l’intérieur même du tissu cardiaque était déjà décrite il y a plus de 300 ans. Bien que négligé pendant longtemps par la médecine moderne, ce phénomène pathologique est redevenu d’actualité du fait de l’explosion des cas d’obésité et de diabètes, et de l’avancée des méthodes d’imagerie cardiaque [9]. L’accumulation de lipides dans le cœur des diabétiques est due à une augmentation de la captation d’acides gras surpassant la capacité oxydative des mitochondries. Ceci entraîne un re-routage des acides gras en excès dans des voies métaboliques non oxydatives, avec pour conséquence directe l’augmentation de la synthèse d’espèces lipidiques telles que les triglycérides, diglycérides et céramides. Alors que les triglycérides semblent constituer un réservoir d’acides gras relativement inerte, les diglycérides, céramides et acyl-CoA en excès peuvent provoquer des effets néfastes regroupés sous le terme de lipotoxicité [10]. Par exemple, diglycérides et acyl-CoA peuvent agir en tant que seconds messagers intracellulaires dans l’induction d’une insulinorésistance au niveau des myocytes, qui aggrave l’inhibition de la capacité de ces cellules à utiliser le glucose et renforce la perte de flexibilité métabolique [10]. Diglycérides et céramides peuvent également activer les voies de mort cellulaire programmée. De plus, en altérant la composition des lipides membranaires, ces espèces lipidiques contribuent à l’inhibition de la fonction mitochondriale, provoquent l’activation des voies du stress du réticulum endoplasmique et contribuent à la perte de l’homéostasie du calcium entre ces deux compartiments intracellulaires [5, 11]. Bien que les cardiomyocytes semblent réagir à ce dysfonctionnement mitochondrial par une activation du programme de biogenèse mitochondriale [14] via des mécanismes à la fois dépendants et indépendants du cofacteur de transcription PGC-1α (peroxisome proliferator-activated receptor gamma coactivator 1-alpha), la capacité respiratoire du cœur diabétique demeure diminuée. En résumé, la lipotoxicité contribue à la diminution de la flexibilité métabolique, à la réduction des réserves énergétiques et à l’aggravation des troubles de relaxation-contraction dans le cœur des patients diabétiques. |
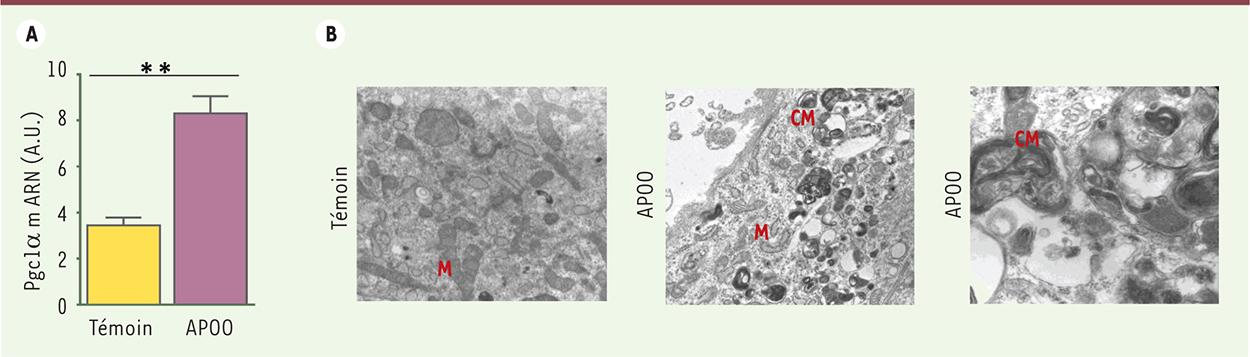
Rôle de l’apolipoprotéine O dans la cardiomyopathie diabétique Nous avons précédemment identifié une nouvelle protéine cardiaque dont l’expression augmente avec l’obésité et le diabète [12]. Nous avons initialement montré que cette protéine abonde dans plusieurs types de lipoprotéines, ce qui lui a valu son nom d’apolipoprotéine O. Nos derniers travaux montrent que l’APOO est également présente dans la mitochondrie du cardiomyocyte et joue un rôle important dans le métabolisme des lipides [13]. Nous avons créé un modèle de souris surexprimant l’APOO spécifiquement au niveau cardiaque. Quand elles sont alimentées avec un régime riche en lipides, ces souris souffrent d’un affaiblissement de la pompe cardiaque caractérisé au niveau cellulaire par un gonflement des mitochondries et une désorganisation des myofibrilles (Figure 1A). De plus, la surexpression de l’APOO dans le cardiomyocyte en culture induit une augmentation de la respiration cellulaire (Figure 1B) en lien avec une augmentation de la génération de ROS et un renforcement du découplage mitochondrial. L’APOO induit donc un gaspillage d’oxygène par les mitochondries. Comme nous le mentionnons ci-dessus, ces signes de dysfonctionnement mitochondrial ont été associés à une augmentation de l’utilisation des lipides par les mitochondries au cours du diabète et de l’obésité. En effet, nous confirmons, à la fois dans les cardiomyocytes en culture, dans le cœur de nos souris transgéniques et également dans le cœur humain, qu’une augmentation de l’expression d’APOO est liée à une activation excessive du métabolisme des lipides, caractérisée par une augmentation de l’expression des transporteurs d’acides gras et une augmentation de la captation des acides gras circulants (Figure 1C). Nous avons aussi observé, dans chacun des modèles étudiés, que cette suractivation du métabolisme lipidique est responsable d’une lipotoxicité cardiaque révélée par une accumulation de diglycérides et une activation des voies de mort cellulaire programmée et d’autophagie. Comme cela a été rapporté dans d’autres modèles animaux de cardiomyopathie diabétique, ces altérations moléculaires sont accompagnées par l’activation du programme de biogenèse mitochondriale [14], qui peut être considéré comme un phénomène compensateur visant à accélérer le remplacement des mitochondries endommagées (Figure 2).
 | Figure 2.
L’APOO induit l’expression de Pgc1α et l’autophagie. A. Expression de Pgc1α dans les cardiomyocytes témoin ou surexprimant l’APOO (APOO). B. Images de microscopie électronique à transmission de ces cellules traitées pendant 8 h avec 100 μm de palmitate. La formation de corps multilamellaires est caractéristique de l’activation d’un processus autophagique visant à dégrader les mitochondries endommagées. M : mitochondrie ; CM : corps multilamellaires. |
|
Conclusions et perspectives Nos résultats démontrent qu’une augmentation de l’expression cardiaque d’APOO à des niveaux comparables à ceux qui sont observés chez les individus diabétiques, suffit à induire un dysfonctionnement mitochondrial, une dérégulation métabolique et un affaiblissement de la fonction contractile [13]. Les mécanismes moléculaires impliqués reproduisent les altérations liées à l’augmentation du métabolisme lipidique et à la lipotoxicité cardiaque observées dans nombre de modèles animaux de cardiomyopathie diabétique. Nous proposons que l’APOO puisse faire partie du système de découplage mitochondrial cardiaque visant à limiter la production délétère de ROS dans un environnement hyperlipidique. Si l’APOO s’intègre ainsi dans un mécanisme visant à adapter le cœur en cas de perte temporaire de l’homéostasie métabolique, il nous reste à établir les raisons pour lesquelles ce mécanisme pourrait ne plus être adapté en cas de stress métabolique prolongé comme c’est le cas dans le diabète. ‡ |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Fagot-Campagna A, Romon I, Fosse S, Roudier C Prévalence et incidence du diabète, et mortalité liée au diabète en France . Synthèse épidémiologique. Saint-Maurice: : InVS; , 2010. 2.
Grundy SM, Benjamin IJ, Burke GL, et al. Diabetes and cardiovascular disease: a statement for healthcare professionals from the American heart association . Circulation. 1999; ; 100 : :1134.–1146. 3.
Bell DS. Diabetic cardiomyopathy . Diabetes Care. 2003; ; 26 : :2949.–2951. 4.
Miki T, Yuda S, Kouzu H, Miura T. Diabetic cardiomyopathy: pathophysiology and clinical features . Heart Fail Rev. 2013; ; 18 : :149.–166. 5.
Duncan JG. Mitochondrial dysfunction in diabetic cardiomyopathy . Biochim Biophys Acta. 2011; ; 1813 : :1351.–1359. 6.
Opie LH. Heart physiology. From cell to circulation . Philadelphia, PA, USA: : Lippincott Williams and Wilkins; , 2004 : :648. p. 7.
Hue L, Taegtmeyer H. The Randle cycle revisited: a new head for an old hat . Am J Physiol Endocrinol Metab. 2009; ; 297 : :E578.–E591. 8.
Lopaschuk GD, Ussher JR, Folmes CD, et al. Myocardial fatty acid metabolism in health and disease . Physiol Rev. 2010; ; 90 : :207.–258. 9.
Szczepaniak LS, Victor RG, Orci L, Unger RH. Forgotten but not gone: the rediscovery of fatty heart, the most common unrecognized disease in America . Circ Res. 2007; ; 101 : :759.–767. 10.
Harmancey R, Wilson CR, Taegtmeyer H. Adaptation and maladaptation of the heart in obesity . Hypertension. 2008; ; 52 : :181.–187. 11.
Fu S, Yang L, Li P, et al. Aberrant lipid metabolism disrupts calcium homeostasis causing liver endoplasmic reticulum stress in obesity . Nature. 2011; ; 473 : :528.–531. 12.
Lamant M, Smih F, Harmancey R, et al. ApoO, a novel apolipoprotein, is an original glycoprotein up-regulated by diabetes in human heart . J Biol Chem. 2006; ; 281 : :36289.–36302. 13.
Turkieh A, Caubere C, Barutaut M, et al. Apolipoprotein O is mitochondrial and promotes lipotoxicity in heart . J Clin Invest. 2014; ; 124 : :2277.–2286. 14.
Sauvanet C, Arnauné-Pelloquin L, David C, et al. Dynamique et morphologie mitochondriales : acteurs, mécanismes et pertinence fonctionnelle . Med Sci (Paris). 2010; ; 26 : :823.–829. |