| |
| Med Sci (Paris). 2015 January; 31(1): 68–74. Published online 2015 February 6. doi: 10.1051/medsci/20153101015.La transition épithélio-mésenchymateuse et la fibrose du transplant rénal Imen Mezni,1,2* Pierre Galichon,1,3 Mohamed Mongi Bacha,2,5 Imen Sfar,2 Alexandre Hertig,1,3 Rim Goucha,2,5 Yi-Chun Xu-Dubois,1 Ezzedine Abderrahim,5 Yousr Gorgi,2 Eric Rondeau,1,3 and Taieb Ben Abdallah2,5 1Inserm UMR_S 1155, des maladies rénales rares aux maladies fréquentes, remodelage et réparation, hôpital Tenon, bâtiment recherche, 4, rue la Chine, 75020Paris, France 2laboratoire de recherche d’immunologie de la transplantation rénale et d’immunopathologie (LR03SP01), EPS Charles Nicolle, Tunis, Tunisie 3urgences néphrologiques et transplantation rénale, APHP, hôpital Tenon, Paris, France 4Anatomo-pathologie, APHP, hôpital Tenon, Paris, France 5service de médecine interne A, EPS Charles Nicolle, Tunis, Tunisie |
Le dysfonctionnement chronique du greffon demeure une cause majeure de retour en dialyse après transplantation rénale. Dans la majorité des cas, ce dysfonctionnement est corrélé à des signes histologiques de rejet cellulaire et/ou humoral, à la néphrotoxicité des inhibiteurs de la calcineurine, ou à des lésions non spécifiques de fibrose interstitielle (FI) [43] et d’atrophie tubulaire (AT) [1]. Sur le plan morphologique, les lésions histologiques non spécifiques de fibrose conduisent à une destruction de la structure du greffon rénal avec une raréfaction cellulaire associée à une augmentation des dépôts de matrice extracellulaire (MEC), aboutissant à la perte de la fonction rénale. Ce processus de progression irréversible de la fibrose est associé à une morbidité et une mortalité importantes [2]. Les causes primitives des atteintes rénales sont multiples. Cependant, quelle que soit l’atteinte initiale, la majorité des néphropathies évoluent vers le développement d’une fibrose rénale. En général, à la suite d’une lésion, le rein engage, comme n’importe quel tissu, une succession d’évènements ayant pour but de permettre sa régénération. Si la cicatrisation est un processus de réparation finement régulé, aboutissant à la formation d’un tissu cicatriciel minime et permettant le maintien structurel et fonctionnel du tissu, en revanche, lors du processus de fibrogenèse, malgré la résolution du stress initial, le processus s’autoperpétue. En effet, la désintégration du tissu rénal et les changements de la MEC exposent les cellules à un environnement mécanique bouleversé. De plus, celles-ci sont également exposées à différentes cytokines, provenant de cellules endommagées et de cellules inflammatoires. Ce sont les myofibroblastes qui assurent la réparation des tissus via leur production de collagène et autres protéines de la MEC [3]. Une accumulation de MEC mène à la formation de cicatrices fibreuses, à la perte de l’architecture tissulaire et, finalement, à la perte de fonction de l’organe [4]. Les myofibroblastes activés pourraient, en partie, dériver de cellules épithéliales tubulaires ayant acquis un phénotype mésenchymateux au cours d’un processus dénommé transition épithélio-mésenchymateuse (TEM). Dans cette revue, nous étudions le rôle de la TEM dans la fibrose rénale, en particulier du greffon rénal. Nous discutons également l’intérêt de certains marqueurs de la TEM pour la détection et le traitement de la fibrogenèse rénale. |
Transition épithélio-mésenchymateuse Alors que, pendant longtemps, l’état différencié d’une cellule épithéliale était considéré comme absolument stable chez l’adulte une fois acquis, il est apparu que certaines cellules pouvaient réactiver un programme embryonnaire, dans un contexte pathologique comme la fibrose ou la progression tumorale [5]. Il en est ainsi de la TEM, processus par lequel les cellules épithéliales tubulaires peuvent acquérir un phénotype mésenchymateux et se transforment en myofibroblastes. On distingue plusieurs étapes : perte d’adhérence cellule-cellule, réorganisation et expression des protéines du cytosquelette, puis rupture de la membrane basale, migration et invasion de la MEC et, enfin, production de collagènes de type I, III et IV, de protéoglycanes et de fibronectine [6] (Figure 1, Tableau I).
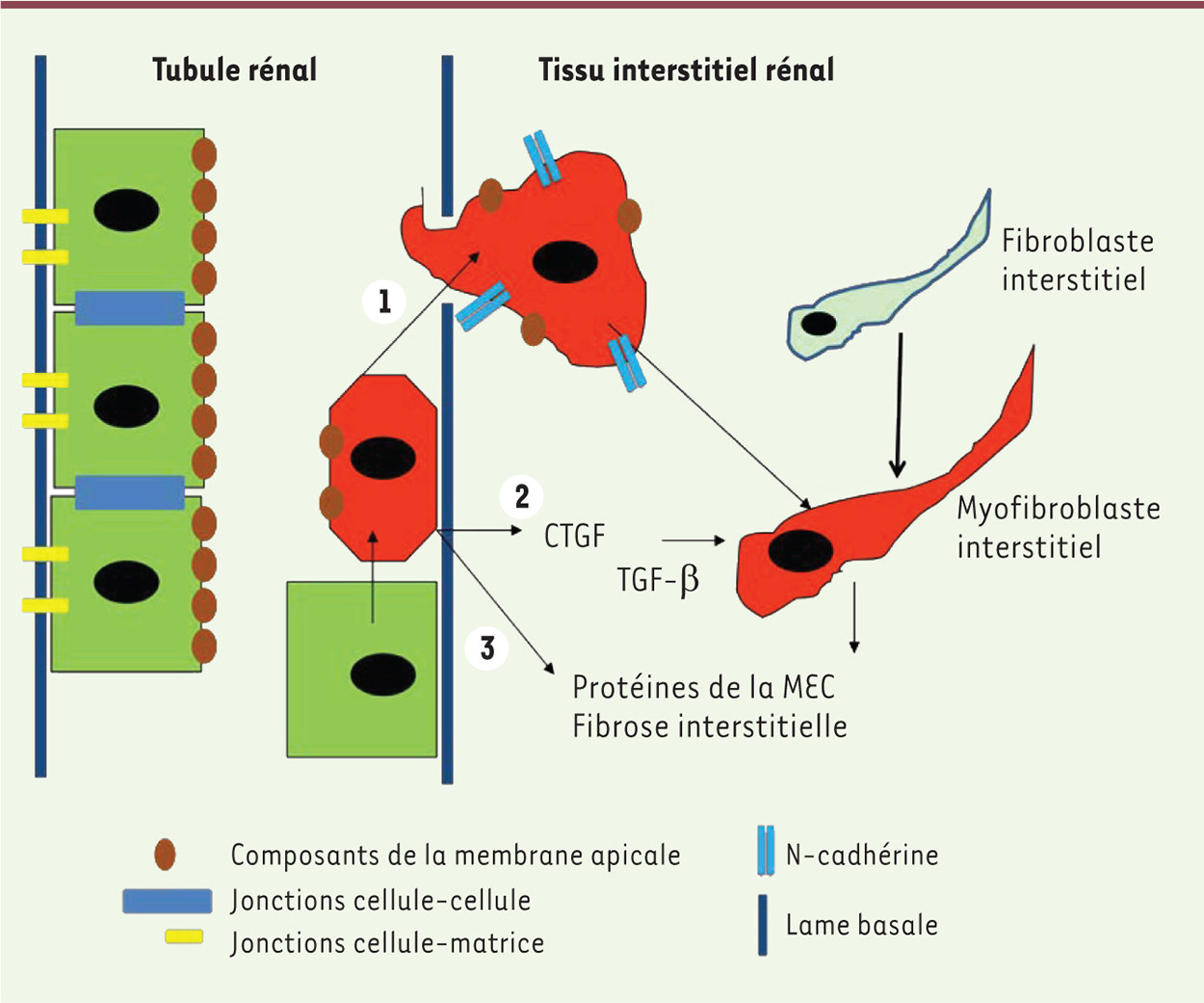
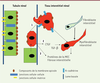 | Figure 1.
Représentation schématique de l’implication de la TEM dans la fibrose rénale. (1) Au décours d’une lésion, les cellules tubulaires subissent des changements du phénotype épithélial, migrent vers l’interstitium rénal et peuvent se transformer en myofibroblastes, contribuant ainsi à la fibrose interstitielle. (2) Le CTGF (connective tissue growth factor), en combinaison avec le TGF-β, stimule la TEM, la prolifération et la différenciation des fibroblastes en myofibroblastes, ainsi que l’accumulation de la MEC. (3) Synthèse de MEC in situ.
|
Tableau I.
| Protéines réprimées |
Protéines surexprimées |
| E-cadhérine |
α-SMA |
| Cytokératine |
Collagène type 1 |
| β-caténine |
Collagène type 3 |
| Desmoplakine |
E47 |
| Muc-1 (mucin-1) |
Fibronectine |
| ZO-1 |
N-cadhérine |
| Occludine |
FSP-1 |
| Collagène IV |
MMP-2 (matrix metalloproteinase-2) |
| Laminine 1 |
MMP-3 ; MMP-9 |
| MiR-200 (microARN-200) |
Slug |
|
Snail |
|
ZEB1 (zinc finger E-box binding homeobox 1) |
|
ZEB2 |
|
Twist1 |
|
FOXC2 (forkhead box protein C2) |
|
TGF-β |
|
β-caténine |
|
Vimentine |
Protéines régulées au cours de la TEM.
|
Jusqu’à présent, on considérait que la TEM représentait une réactivation des programmes de développement embryonnaire rénal. En effet, l’épithélium des différents segments du tubule dérive du mésenchyme embryonnaire par un processus de transition inverse, mésenchyme-épithélium (mesenchymal-to-epithelial transition, MET), à l’exception de l’épithélium du tubule collecteur qui, lui, est issu du pré-épithélium du bourgeon urétéral [5–7]. Pendant longtemps, seules les cellules épithéliales proximales et distales avaient montré une capacité à s’engager dans ce processus de TEM lors d’une stimulation par le transforming growth factor-b (TGF-β), cautionnant l’idée selon laquelle seuls les segments de néphrons issus d’une MET initiale pouvaient subir une TEM au cours de pathologies rénales [5–7]. Cette hypothèse a néanmoins été récemment infirmée par deux études qui démontrent que le TGF-β stimule aussi la TEM dans les cellules épithéliales du tube collecteur [8, 9]. La plasticité des cellules adultes différenciées serait donc un processus beaucoup plus complexe qu’une simple filiation embryonnaire [10]. |
Implication de la TEM dans la fibrose rénale L’étude cruciale qui documente l’intervention d’une TEM dans la fibrose rénale a été publiée par M. Iwano en 2002 [11]. Les auteurs ont utilisé le modèle d’obstruction urétérale unilatérale (UUO) pour induire une fibrose rénale chez des souris transgéniques exprimant le gène LacZ codant pour la β-galactosidase, sous le contrôle du promoteur du gène codant pour la γ-glutamyl transpeptidase (γGT). Ce dernier restreint l’expression de l’enzyme aux cellules épithéliales du tubule proximal. Ainsi, seules les cellules ayant une origine épithéliale tubulaire proximale exprimeront la β-galactosidase. Dans cette étude, 10 jours après la création de l’obstruction urétérale unilatérale, 36 % des fibroblastes (fibroblast specific protein-1+, FSP-1+) exprimaient la β-galactosidase, prouvant ainsi leur origine tubulaire proximale. Il a également été noté que 15 % des fibroblastes participant à cette fibrose étaient issus de cellules de la moelle osseuse. La plupart des études cherchant à comprendre le mécanisme de cette reprogrammation ont montré clairement que, lorsque les cellules épithéliales des tubules rénaux sont exposées à des cytokines profibrotiques, en particulier au TGF-β1, elles perdent leur phénotype épithélial, acquièrent des caractéristiques mésenchymateuses et expriment des marqueurs mésenchymateux (vimentine, a-smooth muscle actin [α-SMA]) [12, 13]. Cependant, l’implication de la TEM dans la progression de la fibrose rénale chez l’animal reste controversée. En effet, différents groupes, en utilisant ce même modèle d’obstruction urétérale, n’ont trouvé aucune preuve d’une contribution de la TEM dans la fibrose rénale, ou tout au moins d’une migration des cellules épithéliales tubulaires dans l’interstitium [14–17], même si des changements phénotypiques épithéliaux pouvaient être démontrés. Humphreys et al. ont utilisé trois lignées transgéniques Cre/Lox dans lesquelles des populations spécifiques de cellules rénales ont été génétiquement marquées [15]. L’une utilisait le promoteur Six2 (sine oculis-related homeobox 2), marquant toutes les cellules tubulaires proximales dérivées du mésenchyme (néphron) ; la seconde le promoteur HoxB7 (homeobox B7), identifiant ainsi spécifiquement toutes les cellules tubulaires issues du bourgeon urétéral ; la troisième, un contrôle positif, identifiait toutes les cellules dérivées du mésenchyme via l’expression du facteur de transcription FoxD1 (forkhead box D1). Une obstruction urétérale a ensuite été créée. Dans les deux premiers modèles transgéniques, aucune cellule positive pour les marqueurs épithéliaux n’a été trouvée dans l’interstitium. Dans le troisième, les myofibroblastes marqués ont été facilement détectés dans l’interstitium, ce qui prouve que les cellules mésenchymateuses résidentes peuvent se transformer en myofibroblastes. Par ailleurs, le traitement par le TGF- β1 de cultures de cellules du tubule proximal de la souris six2-GC ; Z/red conduit à l’induction de marqueurs mésenchymateux (α-SMA et FSP-1). Des résultats identiques ont été obtenus dans le modèle de lésion d’ischémie-reperfusion [44]. Ainsi, il est admis que la population de fibroblastes participant à la fibrose rénale est une population hétérogène, constituée d’une proportion variable de fibroblastes résiduels activés et de fibroblastes issus de cellules médullaires [18]. Les cellules épithéliales tubulaires peuvent acquérir des marqueurs mésenchymateux in vitro et in vivo, et participent au développement de la fibrose rénale (Figure 1). Cependant, in vivo, les cellules tubulaires ne semblent pas migrer dans l’interstitium. Cette assertion mérite cependant d’être tempérée car, à l’heure actuelle, aucune technique de détection ne permet de tracer réellement des cellules tubulaires en cours de migration chez l’homme. La seule technique actuellement disponible consiste à mesurer la présence, à un temps donné, des marqueurs de TEM dans des biopsies humaines : par exemple, l’expression de marqueurs épithéliaux comme la E-cadhérine ou zonula occludens-1 (ZO-1) dans le compartiment interstitiel ou, à l’inverse, la présence de marqueurs (myo)fibroblastiques comme l’α-SMA, la vimentine ou FSP-1 au niveau tubulaire [19–21]. Or, si ces observations sont intéressantes, elles ne prouvent pas de manière définitive l’implication réelle d’un processus de TEM dans la fibrogenèse chez l’homme. En effet, on peut se demander si des cellules interstitielles exprimant la E-cadhérine ou ZO-1 ne pourraient pas être, par exemple, des cellules épithéliales détériorées ayant perdu leur membrane basale, ou bien des cellules mésenchymateuses en cours de différenciation et destinées à réparer les tubules atrophiques (Figure 2).
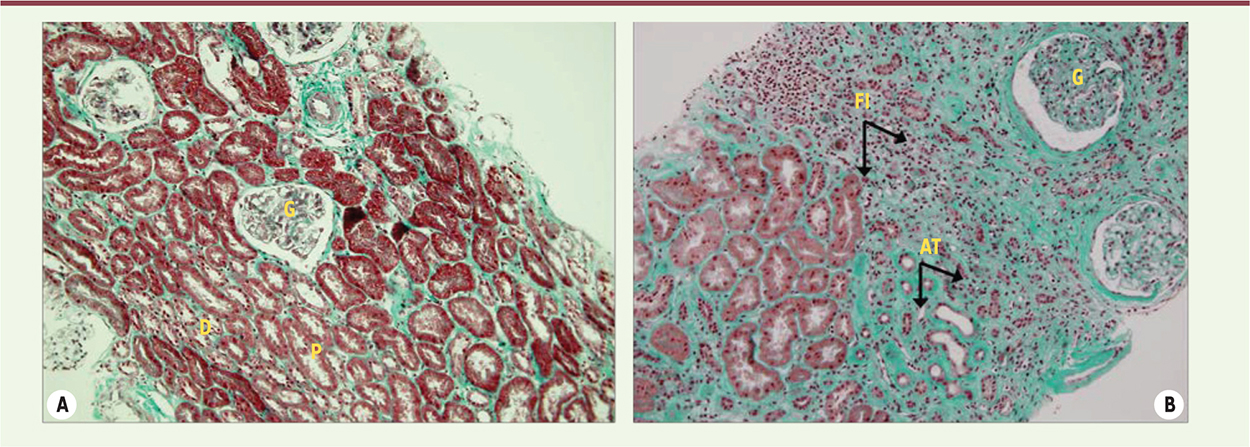
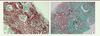 | Figure 2.
La fibrose interstitielle et l’atrophie tubulaire. A. Coupe d’un rein normal. B. Coupe d’un rein fibrosé présentant des tubules atrophiés (AT) entourés par une fibrose interstitielle (FI). Ce sont des lésions cicatricielles rénales irréversibles, conséquences des agressions immunologiques et/ou non immunologiques. G : glomérule ; P : tube proximal ; D : tube distal. |
|
TEM et développement de la fibrose du greffon rénal En Europe, dix ans après la transplantation, environ 40 % des greffons sont perdus, en raison de la progression inévitable de la fibrose interstitielle et de l’atrophie tubulaire, processus complexes impliquant de nombreuses molécules et de nombreux types cellulaires, résidents ou infiltrés. Plusieurs facteurs contribuent à cette fibrose interstitielle/atrophie tubulaire, dont certains sont liés au donneur (âge avancé, causes vasculaires de la mort cérébrale, durée de l’ischémie chaude prolongée [44]), et d’autres à la durée de l’ischémie froide, aux agressions chroniques des anti-calcineurine, aux toxiques, aux infections virales et non virales, ou encore à la survenue d’agressions inflammatoires ou immunologiques [22], telles que les épisodes de rejet aigu, à médiation cellulaire ou humorale. Ainsi, le processus de fibrose débute probablement peu de temps après la transplantation [23] (Figure 3).
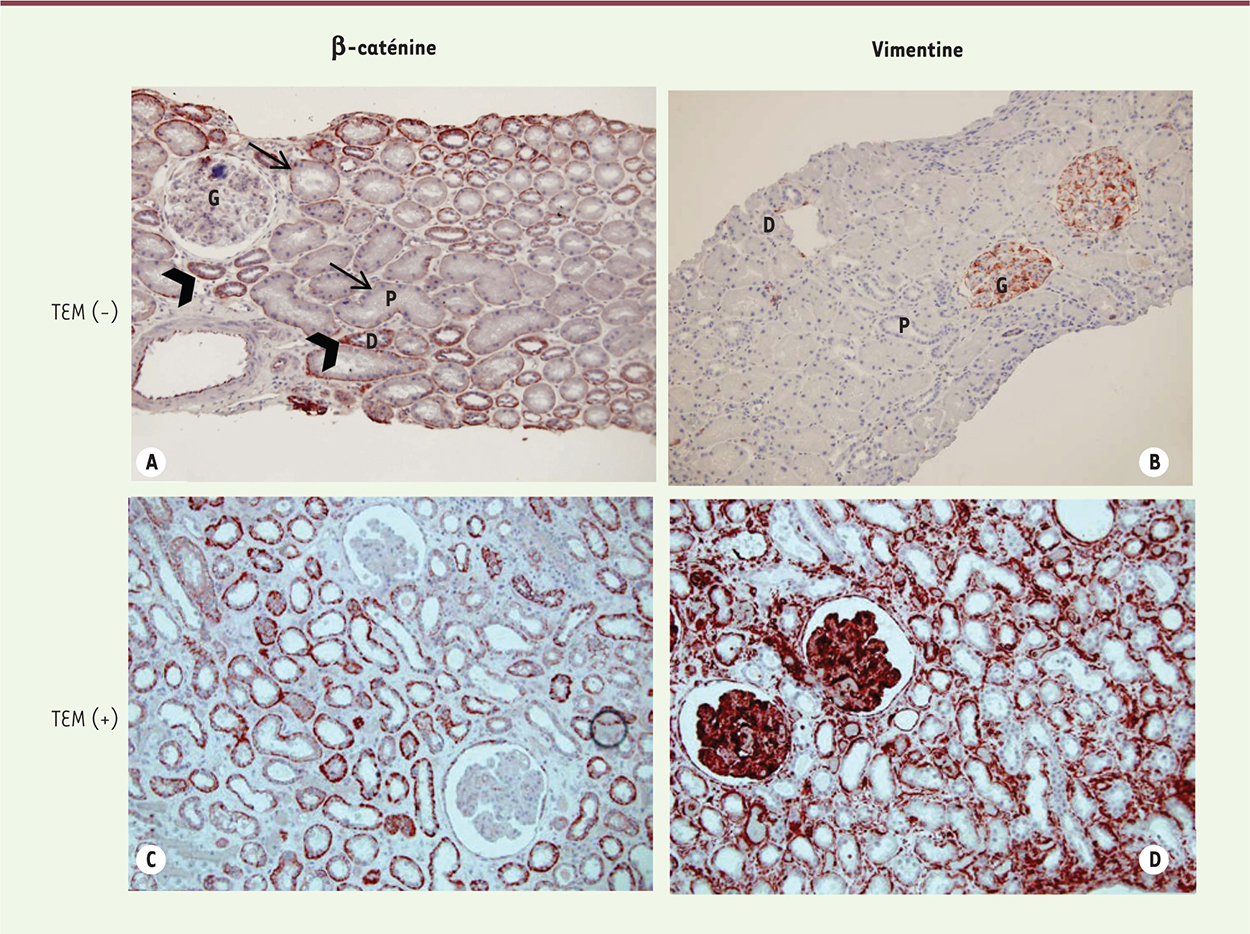
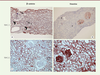 | Figure 3.
Expression de la β-caténine et de la vimentine dans le greffon. Analyse de biopsies de surveillance trois mois après l’implantation du greffon. Dans le greffon normal, on voit un marquage linéaire de la β-caténine au pôle basal des tubes proximaux (flèche) et au côté baso-latéral des tubes distaux et collecteurs (têtes de flèche), sans expression tubulaire de la vimentine (A, B) ; dans un greffon lésé, il y a une surexpression et une translocation cytoplasmique de la β-caténine, et la vimentine est exprimée de novo dans les tubules (C, D). G : glomérule ; P : tube proximal ; D : tube distal. |
L’objectif principal de la réalisation de biopsies « précoces » (dans les trois premiers mois suivant une transplantation rénale) est de détecter un rejet infraclinique, une récidive de la néphropathie initiale sur le greffon, ou une toxicité des inhibiteurs de la calcineurine. La pratique de ces biopsies protocolaires précoces a démontré que le traitement des rejets infra-cliniques qu’elle permet conduit à de meilleurs résultats histologiques et fonctionnels chez les receveurs [22]. Ces biopsies constituent une banque de données histologiques d’une très grande valeur pour étudier chez l’homme les mécanismes de la fibrogenèse et, notamment, l’expression, par l’épithélium tubulaire du greffon, des marqueurs de la TEM [24]. En outre, plusieurs études dans des modèles animaux et sur des biopsies rénales chez l’homme suggèrent la présence de TEM dans les reins fibreux ou, tout au moins, l’acquisition de marqueurs mésenchymateux par des cellules épithéliales tubulaires [3]. Certains travaux ont démontré que la TEM est associée à une fibrose interstitielle/atrophie tubulaire du greffon rénal [20, 25, 26]. Il y a une décennie, Rastaldi et al. [27] ont étudié la pertinence clinique de la détection d’une TEM en se basant sur les données d’une étude de 133 biopsies rénales de patients atteints de différentes maladies rénales. La perte des marqueurs de la cytokératine et de ZO-1 dans les cellules épithéliales tubulaires a pu être associée au gain de caractéristiques mésenchymateuses, y compris l’expression de novo de la vimentine, de l’α-SMA, de la prolyl 4-hydroxylase, de la protéine de choc thermique 47 (heat shock protein 47, HSP47), et des collagènes interstitiels de types I et III. Les auteurs ont rapporté des degrés variables de TEM dans les biopsies humaines et suggéré que des lésions suggestives d’une TEM étaient prédictives de la survenue ultérieure d’une fibrose rénale [27]. De même, A. Vongwiwatana a comparé dix biopsies de greffons rénaux dont la fonction se dégradait à des biopsies d’allogreffes dont la fonction restait stable. Les greffons fibreux se caractérisaient par une perte de marqueurs épithéliaux (E-cadhérine, cytokératine) dans les cellules épithéliales tubulaires, associée à l’expression de marqueurs mésenchymateux, comme FSP-1, vimentine, α-SMA et HSP47 [25]. Ces changements étaient presqu’absents dans les greffons dont la fonction était stable. Il y avait une corrélation entre l’expression tubulaire de ces marqueurs mésenchymateux et les valeurs de la créatinine sérique d’une part, et la régulation négative de la cytokératine, marqueur des cellules épithéliales, et la présence d’une protéinurie, d’autre part. Les résultats de notre propre étude vont dans le même sens puisque nous montrons que la TEM est un marqueur prédictif de la progression de la fibrose du greffon et de l’insuffisance rénale. Ainsi deux marqueurs, la vimentine et la β-caténine, permettent de dépister précocement le dysfonctionnement chronique d’une allogreffe rénale [20–28]. Nous avons montré aussi que l’intensité du score de TEM (basée sur l’expression de ces deux marqueurs) était significativement corrélée à la progression du score de la fibrose interstitielle une année après la greffe, ce qui suggère que les caractéristiques de la TEM pourraient servir de biomarqueurs précoces permettant de prédire, en routine, l’installation d’une fibrose interstitielle/atrophie tubulaire du greffon rénal [24]. |
La transition épithélio-mésenchymateuse : une cible thérapeutique La TEM est devenue un sujet clé dans l’étude de la fibrose d’organes, puisque l’épithélium stressé ou lésé contribue ainsi à la fibrogenèse, qu’il y ait ou non migration de ces cellules dans l’interstitium et transformation myofibroblastique. En raison de son rôle potentiel dans la pathogenèse des maladies fibreuses, et du nombre croissant de facteurs extracellulaires et intracellulaires intervenant, ce processus est une cible pour le développement de médicaments, et sa détection pourrait être utile au diagnostic précoce de fibrose [28–30]. Toutefois, ces approches thérapeutiques sont actuellement cantonnées aux modèles in vitro et chez l’animal. Les facteurs de transcription inducteurs de la TEM, qui répriment la E-cadhérine, peuvent être des cibles. Le TGF-β, molécule profibrotique, est également un inducteur de TEM. Ainsi, de nombreuses stratégies pour bloquer le TGF-β ont été testées dans des études animales [31, 32]. Les anticorps anti-TGF [33], les oligonucléotides antisens [34], les inhibiteurs [35] et la molécule de signalisation de régulation négative Smad7 (Sma- and Mad-related protein 7) [36], ont tous montré une efficacité thérapeutique. Les anticorps neutralisants de TGF-β sont ceux dont le développement est le plus avancé. Une étude a montré que l’inhibition prolongée du TGF-β chez la souris empêchait efficacement le développement d’une glomérulosclérose et d’une insuffisance rénale dans le contexte d’un diabète de type 2, sans effets secondaires néfastes [37, 38]. On peut aussi envisager l’utilisation de régulateurs endogènes qui modulent négativement la TEM, tels que la protéine morphogénique osseuse-7 (BMP-7) et le facteur de croissance des hépatocytes (hepatocyte growth factor, HGF) [3]. Le BMP-7 peut prévenir ou ralentir la progression de la fibrose rénale chez l’animal [39, 40]. En outre, les agonistes de la voie de signalisation BMP, agissant via le récepteur Alk3 (activin receptor-like kinase 3), constituent une nouvelle gamme d’agents thérapeutiques potentiellement utiles pour induire une réparation tissulaire et inverser la fibrose établie [39–41]. L’HGF est un puissant inhibiteur de TEM. Il possède aussi des propriétés antifibrosantes. Il peut efficacement bloquer la conversion phénotypique des cellules épithéliales des tubules induite par le TGF-β1 [42]. Il faut néanmoins être prudent, car la TEM est également impliquée dans la réparation des lésions vasculaires, et bloquer ce processus durant la phase aiguë des lésions pourrait avoir des conséquences dangereuses. |
Durant ces dernières années, la TEM est devenue l’un des sujets les plus fascinants dans les contextes des recherches sur le développement embryonnaire, la métastase tumorale et la fibrose d’organes. Les cellules épithéliales soumises à un stress ou une agression peuvent subir une conversion de type fibroblastique et contribuer ainsi directement à la fibrogenèse rénale. La liste des facteurs extracellulaires et intracellulaires contrôlant la TEM s’accroît et pourrait être exploitée dans le développement de futures thérapies antifibrotiques, notamment appliquées au greffon rénal. Cette liste offre aussi une source importante de biomarqueurs mesurables à un stade précoce de la fibrose. En pathologie rénale, cette détection précoce de marqueurs de TEM peut avoir un impact, important pour le patient, en termes de pronostic, de prise de décision clinique, ou d’options thérapeutiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a été soutenu par la coopération inter-universitaire franco-tunisienne, financée par le ministère tunisien de l’Enseignement supérieur et de la Recherche scientifique et le ministère français des Affaires étrangères et européennes dans le cadre du partenariat Hubert Curien-Utique (PHC-Utique) géré par le CMCU sous forme de bourse doctorale. Nous remercions Campus France pour leur collaboration.
|
1.
Solez K, Colvin RB, Racusen LC. et al. Banff 07 classification of renal allograft pathology: updates and future directions . Am J Transplant. 2008; ; 8 : :753.–760. 2.
Halloran PF, Melk A, Barth C Rethinking chronic allograft nephropathy: the concept of accelerated senescence . J Am Soc Nephrol. 1999; ; 10 : :167.–181. 3.
Hinz B. The myofibroblast: paradigm for a mechanically active cell . J Biomech. 2010; ; 3 : :146.–155. 4.
Wynn TA. Cellular and molecular mechanisms of fibrosis . J Pathol. 2008; ; 214 : :199.–210. 5.
Strutz FM. EMT and proteinuria as progression factors . Kidney Int. 2009; ; 75 : :475.–481. 6.
Bedi S, Vidyasagar A, Djamali A. Epithelial-to-mesenchymal transition and chronic allograft tubule interstitial fibrosis . Transplant Rev. 2008; ; 22 : :1.–5. 7.
Zeisberg M, Kalluri R. The role of epithelial-to-mesenchymal transition in renal fibrosis . J Mol Med. 2004; ; 82 : :175.–181. 8.
Ivanova L, Butt MJ, Matsell DG. Mesenchymal transition in kidney collecting duct epithelial cells . Am J Physiol Renal Physiol. 2008; ; 294 : :F1238.–F1248. 9.
Smith JP, Pozzi A, Dhawan P. et al. Soluble HB-EGF induces epithelial-to-mesenchymal transition in inner medullary collecting duct cells by upregulating snail-2 . Am J Physiol Renal Physiol. 2009; ; 296 : :F957.–F965. 10.
Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition . J Clin Invest. 2009; ; 119 : :1420.–1428. 11.
Iwano M, Plieth D, Danoff TM. et al. Evidence that fibroblasts derive from epithelium during tissue fibrosis . J Clin Invest. 2002; ; 110 : :341.–350. 12.
Venkov C, Link A, Jennings J. et al. A proximal activator of transcription in epithelial-mesenchymal transition . J Clin Invest. 2007; ; 117 : :482.–491. 13.
Qi W, Twigg S, Chen X. et al. Integrated actions of transforming growth factor-β1 and connective tissue growth factor in renal fibrosis . Am J Physiol Renal Physiol. 2005; ; 288 : :800.–809. 14.
Koesters R, Kaissling B, Lehir M. et al. Tubular overexpression of transforming growth factor-β1 induces autophagy and fibrosis but not mesenchymal transition of renal epithelial cells . Am J Pathol. 2010; ; 177 : :632.–643. 15.
Humphreys BD, Lin SL, Kobayashi A. et al. Fate tracing reveals the pericyte and not epithelial origin of myofibroblasts in kidney fibrosis . Am J Pathol. 2010; ; 176 : :85.–97. 16.
Li L, Zepeda-Orozco D, Black R, Lin F. Autophagy is a component of epithelial cell fate in obstructive uropathy . Am J Pathol. 2010; ; 176 : :1767.–1778. 17.
Cook T.H.. The origin of renal fibroblasts and progression of kidney disease . Am J Pathol. 2010; ; 176 : :22.–24. 18.
Pallet N, Anglicheau D. Transition épithélio-mésenchymateuse : aspects fondamentaux . Actualités Néphrologiques. 2008 ; :87.–98. 19.
Inoue T, Okada H, Takenaka T. et al. A case report suggesting the occurrence of epithelial-mesenchymal transition in obstructive nephropathy . Clin Exp Nephrol. 2009; ; 13 : :385.–388. 20.
Hertig A, Anglicheau D, Verine J. et al. Early epithelial phenotypic changes predict graft fibrosis . J Am Soc Nephrol. 2008; ; 19 : :1584.–1589. 21.
Kim M, Maeng Y, Sung WJ. et al. The differential expression of TGF-β1, ILK and wnt signaling inducing epithelial to mesenchymal transition in human renal fibrogenesis: an immunohistochemical study . Int J Clin Exp Pathol. 2013; ; 9 : :1747.–1758. 22.
Del Prete D, Ceol M, Anglani F. et al. Early activation of fibrogenesis in transplanted kidneys: a study on serial renal biopsies . Exp Mol Pathol. 2009; ; 87 : :141.–145. 23.
Schwarz A, Mengel M, Gwinner W. et al. Protocol biopsy program after renal transplantation: structure and first results . Transplant Proc. 2002; ; 34 : :2238.–2239. 24.
Hertig A, Xu-Dubois YC, Rondeau E. Transition épithélio-mésenchymateuse : un marqueur utile en transplantation rénale . Actualités Néphrologiques. 2008 ; :99.–111. 25.
Vongwiwatana A, Tasanarong A, Rayner DC. et al. Epithelial to mesenchymal transition during late deterioration of human kidney transplants: the role of tubular cells in fibrogenesis . Am J Transplant. 2005; ; 5 : :1367.–1374. 26.
Hertig A, Verine J, Mougenot B. et al. Risk factors for early epithelial to mesenchymal transition in renal grafts . Am J Transplant. 2006; ; 6 : :2937.–2946. 27.
Rastaldi MP, Ferrario F, Giardino L. Epithelial-mesenchymal transition of tubular epithelial cells in human renal biopsies . Kidney Int. 2002; ; 62 : :137.–146. 28.
Galichon P, Hertig A. Epithelial to mesenchymal transition as a biomarker in renal fibrosis: are we ready for the bedside? . Fibrog Tis Rep. 2011; ; 4 : :11.. 29.
Diaz R, Kim JW, Hui J. et al. Evidence for the epithelial to mesenchymal transition in biliary atresia fibrosis . Hum Pathol. 2008; ; 39 : :102.–115. 30.
Ghosh AK, Quaggin SE, Vaughan DE. Molecular basis of organ fibrosis: Potential therapeutic approaches . Exp Biol Med. 2013; ; 238 : :461.–481. 31.
Huang Y, Border WA, Noble NA. Perspectives on blockade of TGF-beta 1 overexpression . Kidney Int. 2006; ; 69 : :1713.–1714. 32.
Liu X, Hu H, Yin JQ. Therapeutic strategies against TGF-beta signaling pathway in hepatic fibrosis . Liver Int. 2006; ; 26 : :8.–22. 33.
Yu L, Border WA, Anderson I, McCourt, et al. Combining TGF-beta inhibition and angiotensin II blockade results in enhanced antifibrotic effect . Kidney Int. 2004; ; 66 : :1774.–1784. 34.
Isaka Y, Tsujie M, Ando Y. et al. Transforming growth factor-beta 1 antisense oligodeoxynucleotides block interstitial fibrosis in unilateral ureteral obstruction . Kidney Int. 2000; ; 58 : :1885.–1892. 35.
Border WA, Noble NA, Yamamoto T. et al. Natural inhibitor of transforming growth factor-beta protects against scarring in experimental kidney disease . Nature. 1992; ; 360 : :361.–364. 36.
Lan HY, Mu W, Tomita N. et al. Inhibition of renal fibrosis by gene transfer of inducible Smad7 using ultrasound-microbubble system in rat UUO model . J Am Soc Nephrol. 2003; ; 14 : :1535.–1548. 37.
Sharma K, Jin Y, Guo J, Ziyadeh F. Neutralization of TGF-beta by anti-TGF-beta antibody attenuates kidney hypertrophy and the enhanced extracellular matrix gene expression in STZ-induced diabetic mice . Diabetes. 1996; ; 45 : :522.–530. 38.
Ziyadeh FN, Hoffman BB, Han DC. et al. Long-term prevention of renal insufficiency, excess matrix gene expression, and glomerular mesangial matrix expansion by treatment with monoclonal antitransforming growth factor-beta antibody in db/db diabetic mice . Proc Natl Acad Sci USA. 2000; ; 97 : :8015.–8020. 39.
Sugimoto H, LeBleu VS, Bosukonda D. et al. Activin-like kinase 3 is important for kidney regeneration and reversal of fibrosis . Nat Med. 2012; ; 18 : :396.–405. 40.
Klahr S.. The bone morphogenic proteins (BMPs): their role in renal fibrosis and renal function . J Nephrol. 2003; ; 16 : :179.–185. 41.
Whitman M, Rosen V, Brivanlou AH. et al. Regarding the mechanism of action of a proposed peptide agonist of the bonmorphogenetic protein: receptor activin-like kinase 3 . Nat Med. 2013; ; 19 : :809.–810. 42.
Yang J, Liu Y. Blockage of tubular epithelial to myofibroblast transition by hepatocyte growth factor prevents renal interstitial fibrosis . J Am Soc Nephrol. 2002; ; 13 : :96.–107. 43.
Klein J, Miravete M, Buffin-Meyer B. et al. La fibrose tubulo-interstitielle rénale. Med Sci (Paris). 2011; ; 27 : :55.–61. 44.
Favreau F, Giraud S, Bon D. et al. L’ischémie-reperfusion . Med Sci (Paris). 2013; ; 29 : :183.–188. |