| |
| Med Sci (Paris). 2015 January; 31(1): 75–83. Published online 2015 February 6. doi: 10.1051/medsci/20153101016.Les protéines de la famille TSC-22D De nouveaux régulateurs de l’homéostasie cellulaire ? Aurélie Pépin,1 Armelle Biola-Vidamment,1 Perle Latré de Laté,1 Marie-Alix Espinasse,1 Véronique Godot,2 and Marc Pallardy1* 1Université Paris-Sud, Inserm UMR 996, faculté de pharmacie, 5, rue Jean-Baptiste Clément, 92290Châtenay-Malabry, France 2Inserm UMR 955, faculté de médecine, 51, avenue du Maréchal de Lattre de Tassigny, 94010Créteil, France |
Les protéines GILZ (glucocorticoid-induced leucine zipper) et TSC-22 (transforming growth factor-β [TGF-β]-stimulated clone-22), dont l’expression est induite essentiellement par les glucocorticoïdes (GC) et/ou le TGF-β, ont été particulièrement caractérisées dans les cellules hématopoïétiques [1, 2]. GILZ et TSC-22 appartiennent à la famille des protéines TSC-22D (TSC-22 domain), comprenant 16 autres membres, dont une caractéristique commune est de posséder les domaines très conservés leucine zipper (LZ) et TSC-box. Ainsi, plusieurs membres de cette famille peuvent interagir via une homo- ou une hétérodimérisation, qui se sont révélées, dans certains cas, indispensables à leur activité. GILZ apparaît comme un des acteurs majeurs de la réponse anti-inflammatoire, au moins en partie, en relayant les effets des glucocorticoïdes. TSC-22 et GILZ contrôlent aussi l’apoptose et la prolifération cellulaire. Ces fonctions, et leur expression dans les cellules hématopoïétiques, suggèrent un rôle probable de ces protéines dans les maladies inflammatoires et tumorales. |
Structure des protéines de la famille TSC-22D Chez les mammifères, les 18 protéines TSC-22D sont issues de l’épissage alternatif de quatre gènes, TSC-22D1-4, localisés sur des chromosomes différents (Tableau I) [3]. Dans la classification proposée par Fiol et al. [3], les transcrits issus de chaque gène sont numérotés selon leur taille (Tableau I). Nous avons ajouté à cette classification les transcrits décrits lors d’études plus récentes [4–6]. Pour la plupart, les isoformes protéiques, identifiées par analyse informatique ou par des expériences de double hybride, sont peu caractérisées (Tableau II) [3, 5]. Des orthologues de TSC-22, Bun/Dip/Shortsighted, ont été décrits chez la drosophile, ce qui démontre la conservation de ces protéines au cours de l’évolution [5].
Tableau I.
| Gènes |
Protéines |
Taille (nucléotides) |
Taille (acides aminés) |
Chromosome et locus |
Références |
|
TSC-22D1-1 |
4581 (s) |
1057/1056* (s) |
|
[3] |
|
|
4820* (h) |
1073 (h) |
|
|
TSC-22D1-2 ou TSC-22
|
1670/1762* (s) |
143 (s) |
Chr 14 locus D3 (s) |
[2] |
|
TSC-22D1
|
|
|
|
Chr 13 locus q14 (h) |
|
|
1749* (h) |
144 (h) |
|
[5] |
|
TSC-22D1-3 |
ND |
742 (h) |
|
[5] |
|
TSC-22D1-4 |
ND |
585 (h) |
|
|
|
|
TSC-22D2
|
TSC-22D2-1 |
2002 (s) |
167 (s) |
|
|
|
TSC-22D2-2 |
2229 (s) |
ND |
|
|
|
TSC-22D2-3 |
1364 (s) |
ND |
Chr 3 locus D (s) |
|
|
TSC-22D2-4 |
ND |
ND |
|
[3, 5] |
|
TSC-22D2-5/TSC-22D2-1**(h) |
4839* (h) |
780 (h) |
Chr 3 locus q25.1 (h) |
|
|
TSC-22D2-6 |
ND |
124 (h) |
|
|
|
TSC-22D2-7 |
ND |
87 (h) |
|
|
|
|
TSC-22D3-1 ou GILZ2*** |
1377/1552* (s) |
201 (s) |
|
[3, 5, 6] |
|
|
2266* (h) |
200 (h) |
|
|
TSC-22D3-2 ou GILZ
|
1972 (s) |
137 (s) |
|
|
ou TSC-22D3-1**ou GILZ1*** |
2027* (h) |
134 (h) |
Chr X locus F1 (s) |
[1, 6] |
|
TSC-22D3
|
|
|
|
|
|
|
TSC-22D3-3 ou GILZ3*** |
ORF : 132 (s) |
43 (s) |
|
[6] |
|
|
|
|
Chr X locus q22.3 (h) |
|
|
TSC-22D3-4 ou GILZ4*** |
ORF : 243 (s) |
80 (s) |
|
[6] |
|
L-GILZ
|
ORF : 705 (s) |
234 (s) |
|
[4] |
|
|
TSC-22D4-1 ou THG-1
|
2672/3983* (s) |
387 (s) |
|
[7] |
|
2383* (h) |
395 (h) |
|
|
|
|
|
Chr 5 locus G1 (s) |
|
|
TSC-22D4
|
TSC-22D4-2 |
ND |
310 (h) |
|
[5] |
|
|
|
|
Chr 7 locus p21-15 (h) |
|
|
TSC-22D4-3 |
ND |
195 (h) |
|
[5] |
Protéines de la famille TSC-22D identifiées chez la souris et l’homme. Sont indiqués les différents gènes de la famille TSC-22D, les transcrits, les protéines (les plus étudiées en gras), ainsi que la taille des ARNm et des protéines. Chr : chromosome; ND : non déterminé; ORF : open reading frame; s : souris; h : homme; * données répertoriées dans Ensembl; ** numérotation des isoformes différente dans Ensembl; *** numérotation des isoformes différente d’après Soundararajan et al. [ 6]. |
Tableau II.
| Gènes |
Protéines |
Types cellulaires |
Inducteurs |
Fonctions |
Références |
|
TSC-22D1
|
TSC-22D1-1 |
Cellules rénales (s) |
ND |
ND |
[3, 6] |
| Fibroblastes, mélanocytes (h) |
|
|
|
| TSC-22D1-2 ou TSC-22
|
Cellules hématopoïétiques (s, h) |
Glucocorticoïdes |
Pro-apoptotique |
[2, 27] |
| Ostéoblastes (s) |
|
Antiprolifératif |
|
| Cellules rénales (s) |
TGF-β |
|
|
| Fibroblastes, mélanocytes (h) |
Ras/Raf activé |
|
|
| TSC-22D1-3 |
ND |
ND |
ND |
[5] |
| TSC-22D1-4 |
ND |
ND |
ND |
[5] |
|
|
TSC-22D2
|
TSC-22D2-1 |
|
Aldostérone |
Tolérance au stress hyperosmotique : TSC-22D2-4 |
[3] |
| TSC-22D2-2 |
|
Hyperosmolarité |
|
|
| TSC-22D2-3 |
Cellules rénales (s) |
|
|
|
| TSC-22D2-4 |
|
|
|
|
| TSC-22D2-5/TSC-22D2-1** |
|
|
|
|
| TSC-22D2-6 |
ND |
ND |
ND |
[5] |
| TSC-22D2-7 |
|
|
|
|
|
|
TSC-22D3
|
TSC-22D3-1 ou GILZ2*** |
Cellules rénales (s) |
Aldostérone |
Interagit avec Raf |
[6] |
|
Cellules hématopoïétiques (s, h) |
Glucocorticoïdes |
Antiprolifératif |
[1, 3, 4, 8, 24, 25, 35, 38] |
|
Cellules rénales (s) |
TGF-βIL-10/ |
Anti-inflammatoire, immunosuppresseur |
| TSC-22D3-2 ou GILZ
|
Myoblastes (s) |
IL-4/IL-13 |
Régulateur de l’apoptose |
| ou TSC-22D3-1** |
Cellules épithéliales |
Déprivation en IL-2 |
Inhibiteur de la myogenèse |
| ou GILZ 1*** |
bronchiques (h) |
Aldostérone, œstrogènes |
Régulateur de la spermatogenèse et du transport du Na+ |
|
Cellules souches |
Hypoxie |
|
|
mésenchymateuses (s) |
|
|
|
| TSC-22D3-3 ou GILZ3*** |
Cellules rénales (s) |
Aldostérone |
Antiprolifératif |
[6] |
| TSC-22D3-4 ou GILZ4*** |
Cellules rénales (s) |
Aldostérone |
Inhibiteur de l’activité de NF-↗B |
[6] |
|
L-GILZ
|
Myoblastes (s) Spermatocytes (s) |
Glucocorticoïdes |
Inhibiteur de la myogenèse |
[4, 38] |
|
|
|
|
Régulateur de la spermatogenèse |
|
|
TSC-22D4
|
TSC-22D4-1 ou THG-1
|
Cellules rénales (s) |
Hyperosmolarité |
Organogenèse |
[5] |
|
Neurones primaires (s) |
Déprivation K+ |
de l’hypophyse (s) |
|
Fibroblastes, mélanocytes (h) |
|
Pro-apoptotique |
| TSC-22D4-2 |
ND |
ND |
ND |
[5] |
| TSC-22D4-3 |
ND |
ND |
ND |
Expression et fonctions des protéines de la famille TSC-22D. Sont indiqués les différents transcrits, les protéines (les plus étudiées en gras), les types cellulaires dans lesquels ces protéines sont exprimées, les inducteurs et les fonctions décrites pour ces protéines. h : homme ; ND : non déterminé ; s : souris. |
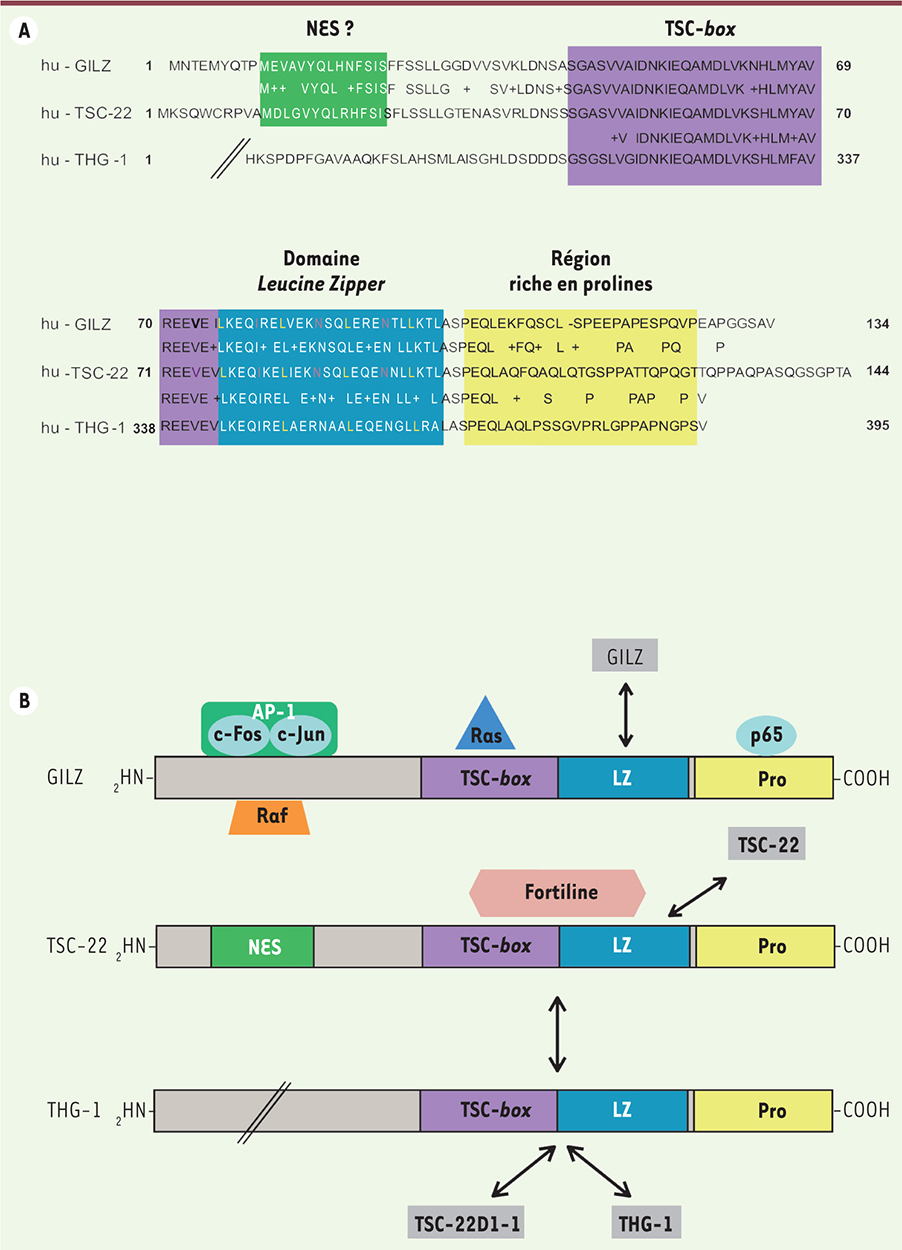
Le gène TSC-22D1, localisé sur le chromosome 13 chez l’homme, code pour la protéine TSC-22 ou TSC-22D1-2, composée de 144 acides aminés (aa), ainsi que pour une isoforme de taille supérieure, TSC-22D1-1 [3]. La protéine GILZ humaine est composée de 134 aa ; elle est codée par le gène TSC-22D3 localisé sur le chromosome X et possède 78 % d’homologie avec TSC-22D1-2 dans sa partie codante [3]. Le gène TSC-22D3 code également pour trois autres isoformes (TSC-22D3-1, TSC-22D3-3 et TSC-22D3-4) présentes dans les cellules rénales murines, ainsi que pour un transcrit de taille supérieure nommé L-GILZ (long-GILZ) (Tableau I) [3–6]. La protéine THG-1 (TSC22 homologue gene 1) humaine, produit du gène TSC-22D4, est composée de 395 aa, et sa séquence comporte 75 % d’homologie avec celle de TSC-22 et 67 % avec celle de GILZ (Figure 1A) [7].
 | Figure 1.
Structure des protéines GILZ, TSC-22 et THG-1, et leurs principales interactions protéiques. A. Séquences des protéines humaines (hu) de GILZ, TCS-22 et THG-1. Le domaine leucine zipper (LZ), le domaine TSC-box, la région riche en proline (Pro) et la séquence NES (nuclear export signal) potentielle sont encadrés en couleurs. B. Principales interactions décrites des protéines TSC-22D. Les doubles flèches représentent une dimérisation. AP-1 : activator protein-1 ; p65 : sous-unité p65 de NF-kB. |
Ces protéines, à l’exception de TSC-22D3-4 et TSC-22D4-2, possèdent toutes le domaine TSC-22, qui est composé de la TSC-box et du domaine leucine zipper, ainsi qu’une région riche en prolines et en acides glutamiques en position carboxy-terminale (Figure 1A) [5]. Ces protéines s’associent par la région LZ, sous forme d’homo- ou d’hétérodimères. Ainsi, GILZ, TSC-22 et THG-1 s’homodimérisent [7, 8]. La mutation des quatre résidus leucine en position 76, 83, 90 et 97 dans le domaine LZ de GILZ invalide sa dimérisation [8], alors que seuls les résidus leucine en position 91 et 97 dans le domaine LZ de TSC-22 sont indispensables à son homodimérisation [9]. THG-1 s’hétérodimérise avec TSC-22 [7] ou avec son isoforme TSC-22D1-1 (Figure 1B). La possibilité d’une hétérodimérisation entre d’autres protéines TSC-22D n’est pas à exclure, même si elle n’a pas encore été explorée. GILZ et TSC-22 interagissent également physiquement et fonctionnellement avec des protéines n’appartenant pas à la famille TSC-22D (Figure 1B), ce qui constitue un mode d’interférence majeur de ces protéines avec les voies de signalisation, rappelant les effets trans-répressionnels du récepteur des glucocorticoïdes (GR). Ainsi, TSC-22, via les régions LZ et TSC-box, se lie à la protéine antiapoptotique fortiline dans les cellules de carcinome ovarien humain SKOV-3 [10]. Le domaine amino-terminal de TSC-22 interagit avec le récepteur de type I du TGF-β (TGFbRI) et la protéine SMAD7 (mothers against decapentaplegic homolog 7) dans les cellules de rein embryonnaire humain HEK29 [11]. GILZ interagit, d’une part avec la petite protéine G Ras, via son domaine TSC-box et, d’autre part, avec l’effecteur Raf, via son domaine amino-terminal, pour former un complexe ternaire dans les cellules COS-7 [8]. Par ailleurs, GILZ se lie à divers facteurs de transcription, et inhibe leurs activités (Figure 1B). Ainsi, le domaine amino-terminal de GILZ interagit avec les sous-unités c-Fos et c-Jun du facteur de transcription AP-1 (activator protein-1) [12], tandis que le domaine carboxy-terminal de GILZ assure sa liaison à la sous-unité p65 du facteur de transcription NF-kB [8]. Récemment, une interaction directe entre GILZ et SMAD2 été décrite dans les lymphocytes T (LT) [13]. Enfin, une séquence fonctionnelle NES (nuclear export signal) a été identifiée dans la région amino-terminale de TSC-22, expliquant sa localisation cytoplasmique [14]. TSC-22 migre dans le noyau lors de l’apoptose ou après activation de la voie Ras/Raf [14, 15]. Notre équipe a mis en évidence la localisation cytoplasmique de GILZ dans des cellules hématopoïétiques, et identifié une séquence NES (nuclear export signal) dans sa région amino-terminale, sans toutefois que la fonctionnalité de cette séquence n’ait été formellement démontrée [16]. |
Régulation de l’expression des protéines TSC-22D Les protéines TSC-22 et GILZ sont exprimées dans de nombreux tissus humains et murins. GILZ est présente chez l’homme dans le muscle squelettique, le cerveau, le cœur, les poumons, les reins et la rate [8]. GILZ a également été détectée chez la souris dans la rate, le foie, la moelle osseuse, les poumons, les ganglions lymphatiques et le thymus [1]. L’ARNm de TSC-22 a été détecté chez l’homme dans les poumons, le cœur, le cerveau, les reins, le placenta, le thymus, la prostate, les ovaires, l’intestin grêle et le côlon, mais il est très faiblement exprimé dans le foie, le pancréas, la rate et les leucocytes du sang périphérique [17]. Les transcrits GILZ et TSC-22 sont exprimés dans les mêmes tissus humains adultes et fœtaux (A. Pépin, et al., résultats non publiés). L’expression génique de GILZ est régulée par les glucocorticoïdes, des hormones et des cytokines. La dexaméthasone induit l’expression de GILZ dans les cellules hématopoïétiques, les myoblastes, les cellules épithéliales bronchiques et les cellules souches mésenchymateuses [1, 8, 12, 18–20]. D’autres hormones régulent positivement l’expression de GILZ, comme l’aldostérone dans les cellules rénales ou les œstrogènes dans la lignée humaine d’adénocarcinome du sein MCF-7 [6, 8]. Les mécanismes régulant l’expression de GILZ lors des processus inflammatoires ne sont pas encore bien compris. Jusqu’à présent, il était admis que l’expression génique de GILZ était induite par différents signaux anti-inflammatoires, comme les glucocorticoïdes, mais aussi par les interleukines-4 (IL-4), -13 et -10 dans les monocytes et les macrophages, l’IL-10 dans les mastocytes et les cellules dendritiques (DC) humaines dérivées de monocytes (MoDC) [8, 19–21], ou par le TGF-β dans les MoDC. Inversement, il a été décrit que l’expression de GILZ était réprimée par des signaux pro-inflammatoires ou infectieux, comme dans les macrophages alvéolaires humains, en réponse à l’activation par le LPS (lipopolysaccharide) du récepteur Toll-like 4 (TLR4) [22]. Mais, les travaux de l’équipe d’Éric Morand ont suggéré que GILZ pouvait être exprimée dans des situations inflammatoires. En effet, dans un modèle murin d’arthrite induite par le collagène, ainsi que dans les synoviocytes de patients atteints de polyarthrite rhumatoïde (PR) active, l’expression de GILZ est augmentée par des doses thérapeutiques de glucocorticoïdes. Mais elle croît aussi dans le synovium des patients en absence de glucocorticoïdes exogènes [23], ce qui présente, pour la première fois, GILZ comme une molécule anti-inflammatoire endogène. Enfin, l’expression de Gilz est induite par l’hypoxie dans les macrophages murins [24]. Le promoteur murin de Gilz a été cloné par notre équipe. Il comporte des GRE (GC responsive element) et des FHRE (forkhead responsive element) qui coopèrent pour la transactivation de ce promoteur [25]. Le facteur FOXO3 (forkhead box class O3), activé lors de la déprivation en IL-2 de la lignée de lymphocytes T murins CTLL-2, participe à la transcription de Gilz [25]. En présence d’IL-2, FOXO3 est phosphorylé et donc inactif, et l’expression de Gilz est réprimée [18]. Le promoteur de Gilz comporte aussi des sites potentiels de fixation pour les facteurs de transcription STAT6 (signal transducer and activator of transcription 6), NFAT (nuclear factor of activated T cell), OCT-1 (octamer binding transcription factor-1) et c-Myc [25]. Enfin, un mécanisme de régulation post-transcriptionnelle de Gilz a été décrit dans lequel l’activation par le LPS (lipopolysaccharide) déstabilise l’ARNm de Gilz dans la région 3’UTR (untranslated region), diminuant ainsi son expression [22]. Tsc-22 est régulé positivement par la dexaméthasone dans la lignée d’ostéoblastes murins MC3T3 E1 [2], bien qu’aucune séquence GRE n’ait été identifiée à ce jour dans le promoteur de Tsc-22 [2, 26]. Le TGF-β induit l’expression de Tsc-22 dans la lignée fibroblastique MC3T3 E1, les cellules mésangiales murines primaires et la lignée de kératinocytes humains HaCat [2, 27]. La régulation positive de l’expression de Tsc-22 peut impliquer un mécanisme post-transcriptionnel, puisque le TGF-β augmente la stabilité de l’ARNm de Tsc-22, en diminuant la liaison de la protéine Ybx1 (Y box binding protein 1) responsable de sa dégradation en 3’UTR, via un mécanisme impliquant le miARN-216a [26, 27]. L’expression de TSC-22 est aussi augmentée par l’activation de la voie Ras/Raf dans les lymphocytes pré-B murins Ba/F3 ou dans les fibroblastes murins NIH-3T3 qui surexpriment H-Ras. Cette régulation positive est inhibée par la présence de STAT5 activé [14]. Enfin, une hyperméthylation du promoteur de Tsc-22 inhibant la transcription du gène a été caractérisée dans des lignées de leucémies lymphoïdes murines (EL-4, L110, TK-1 et YAC-1) et dans la lignée P1.17 dérivée d’un plasmocytome murin [28]. Cette répression de l’expression de TSC-22 dans des tumeurs humaines de glande salivaire, de la prostate, du cerveau, ou dans des leucémies lymphoïdes T ou NK (natural killer) humaines [28, 29], suggère que l’expression de TSC-22 pourrait inhiber les processus de tumorigenèse. Ces résultats montrent que l’expression des gènes codant pour les protéines GILZ et TSC-22 est régulée par de nombreux stimulus et par des mécanismes spécifiques de chaque type cellulaire, suggérant ainsi la multiplicité des fonctions de GILZ et TSC-22. |
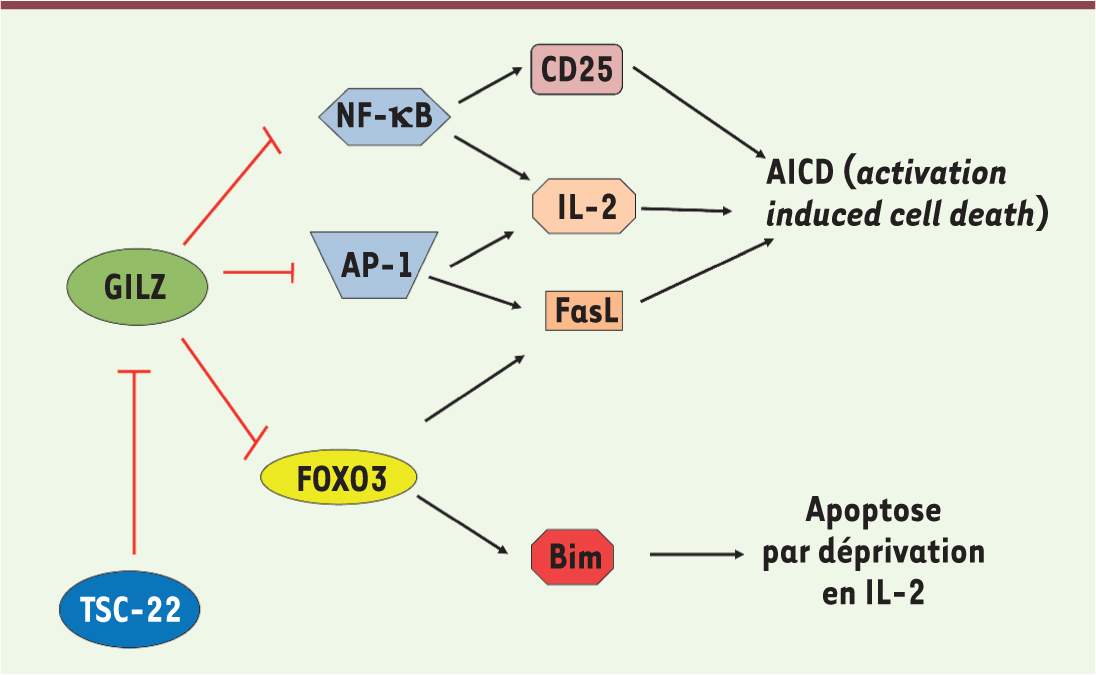
Régulation de l’homéostasie cellulaire par les protéines TSC-22D Régulation de l’apoptose GILZ et TSC-22 apparaissent comme des régulateurs majeurs de l’apoptose des cellules hématopoïétiques. Apoptose des lymphocytes T matures L’apoptose des lymphocytes T (LT) matures permet de préserver l’homéostasie en réduisant le nombre de cellules en fin de réponse immunitaire. L’apoptose « active » ( activation-induced cell death, AICD) est induite par une stimulation répétée du récepteur de l’antigène des LT [ 40]. L’activation de ces cellules induit l’expression à leur surface du ligand du récepteur de mort Fas (FasL), et l’IL-2 augmente cette expression. GILZ inhibe l’apoptose « active » (Figure 2) en régulant négativement la transcription de Fasl, de l’ IL-2 et du gène codant pour la chaîne a de son récepteur (CD25) [ 8, 12]. L’apoptose « passive » est induite par la déprivation en cytokines : en l’absence d’une nouvelle stimulation par l’antigène, l’expression de l’IL-2 et de ses récepteurs diminue. Nous avons montré que GILZ retarde l’entrée en apoptose des LT murins CTLL-2 privés d’IL-2. En effet, GILZ réprime l’activité transcriptionnelle de FOXO3, s’opposant ainsi à la transcription de BIM (membre pro-apoptotique de la famille Bcl-2) et à l’apoptose des LT [ 16, 25] (Figure 2). Inversement, TSC-22 favorise l’apoptose de ces cellules (Figure 2) : sa surexpression diminue l’expression de GILZ induite lors de la déprivation en IL-2, résultant en une augmentation de l’expression de BIM (A. Pépin et al., résultats non publiés).
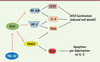 | Figure 2.
Représentation des mécanismes mis en jeu par GILZ et TSC-22 pour réguler l’apoptose des lymphocytes T. GILZ inhibe l’activité des facteurs de transcription NF-kB et AP-1, réduisant ainsi l’expression d’IL-2 et de la chaîne α de son récepteur, CD25, ainsi que l’expression de FasL, le ligand du récepteur de mort Fas ; cela conduit à une diminution de l’AICD ( activation-induced cell death) [ 8, 12]. GILZ inhibe également l’activité du facteur de transcription FOXO3 ( forkhead box class O3), responsable de l’expression de la protéine pro-apoptotique BIM, induisant ainsi une diminution de l’apoptose par la déprivation en IL-2 [ 25]. TSC-22 inhibe l’expression de GILZ induite par la déprivation en IL-2, conduisant alors à une augmentation de l’expression de BIM et, donc, de l’apoptose par déprivation en facteur de croissance (A. Pépin et al., résultats non publiés). |
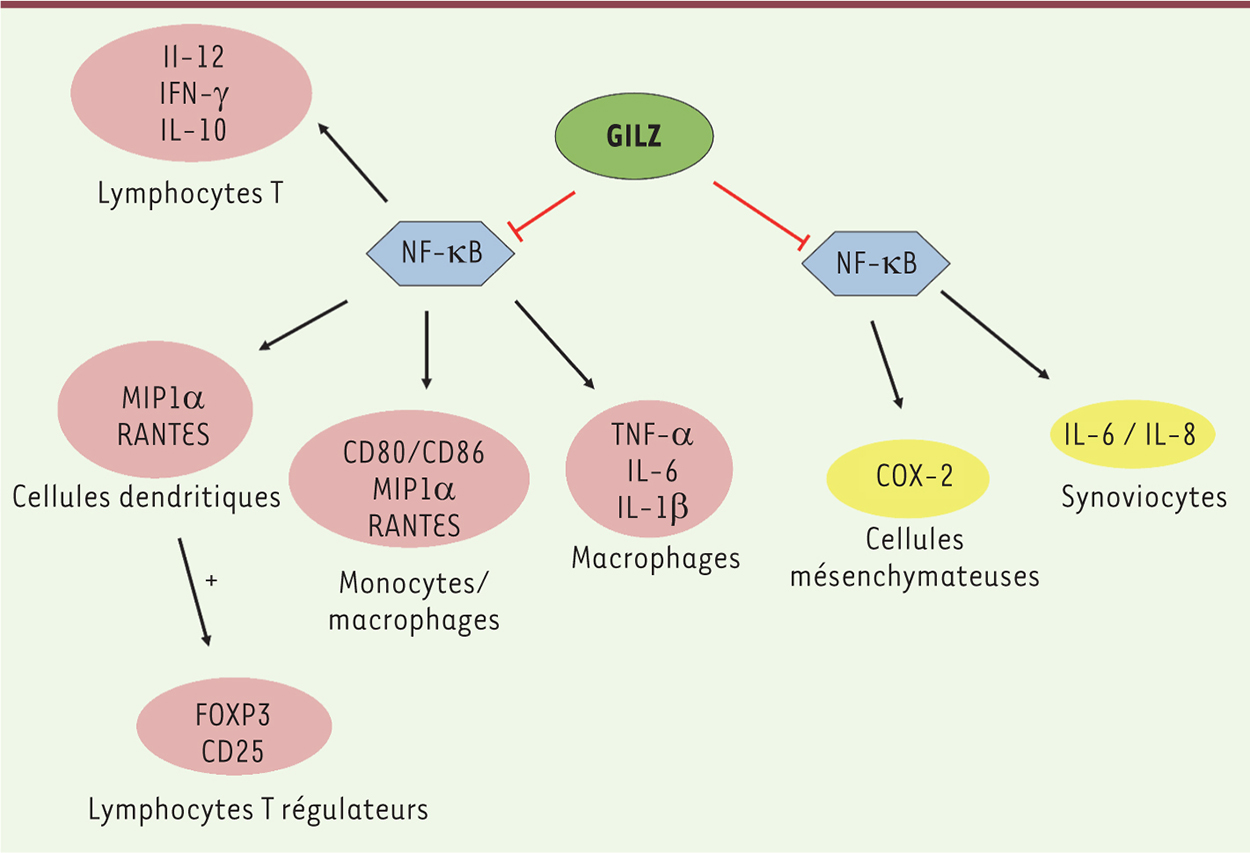
Apoptose des cellules tumorales Récemment, il a été montré que l’expression de GILZ induisait l’apoptose de cellules de leucémie myéloïde chronique [ 30, 40]. Dans ce contexte, GILZ interagit avec le complexe mTOR ( mammalian target of rapamycin)-C2, inhibant la phosphorylation de la kinase Akt (protéine kinase B, PKB) et favorisant l’activation de FOXO3 et la transcription de BIM [ 30]. TSC-22 contrôle également l’apoptose de diverses cellules cancéreuses. Il augmente en effet l’apoptose de la lignée de carcinome gastrique HSC39 [31], et la sensibilité de la lignée TYS (issue d’une tumeur de glande salivaire humaine) vis-à-vis de trois anticancéreux (5-fluoro-uracile, cisplatine, péplomycine) et de l’irradiation [15]. Par ailleurs, dans les cellules SKOV-3, l’activité pro-apoptotique de TSC-22 est régulée par la fortiline, une protéine anti-apoptotique qui interagit avec TSC-22 via son domaine amino-terminal, entraînant sa dégradation rapide [10]. En résumé, GILZ et TSC-22 sont des régulateurs de l’apoptose, dont la fonction peut être pro- ou anti-apoptotique, selon le contexte et le type cellulaire. Régulation de la prolifération cellulaire Le rôle de TSC-22 TSC-22 inhibe la prolifération cellulaire de lignées hématopoïétiques ou issues de carcinomes en bloquant la progression du cycle cellulaire [ 14, 28]. Ainsi, dans la lignée de carcinome colique Moser S, TSC-22 induit la transcription du gène codant pour p21 ( cyclin-dependent kinase inhibitor 1), bloquant ainsi les cellules en phase G0/G1 [ 9]. TSC-22 inhibe aussi la prolifération cellulaire induite par la voie de signalisation Ras/Raf, sans interagir avec Ras, comme décrit pour GILZ [ 14]. Le rôle de GILZ Plusieurs arguments expérimentaux font également de GILZ un inhibiteur de la prolifération cellulaire. D’une part, GILZ diminue la phosphorylation de la kinase Akt/PKB, réduisant ainsi l’expression de la cycline D1 et la phosphorylation de la protéine pRb (protéine du rétinoblastome), ce qui induit l’arrêt du cycle cellulaire dans les cellules NIH-3T3 ou les hybridomes T murins 3DO [ 8]. D’autre part, GILZ inhibe l’activation de la voie de signalisation ERK ( extracellular-signal regulated kinase) dans ces mêmes cellules, en interagissant avec la petite protéine G Ras et la kinase Raf [ 8]. Toutefois, l’analyse de prélèvements de carcinomes ovariens humains a mis en évidence une corrélation entre l’expression de GILZ, celle du marqueur de prolifération Ki67 et la gravité de la tumeur [32], montrant à nouveau que les effets de GILZ dépendent étroitement du modèle cellulaire utilisé. Régulation de l’inflammation par GILZ Les propriétés anti-inflammatoires de GILZ ont été étudiées dans divers modèles murins d’inflammation (colique, pulmonaire, ou du système nerveux central), dans lesquels la surexpression de GILZ diminue la sécrétion de cytokines pro-inflammatoires, dont le TNF-a ( tumor necrosis factor-a) et l’IL-1β, réduisant ainsi les dommages tissulaires [ 8, 33]. Dans ces modèles, la surexpression de GILZ est obtenue dans des souris transgéniques [ 8], par l’administration de la protéine de fusion TAT-GILZ [ 8], ou celle de glucocorticoïdes (Figure 3).
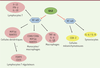 | Figure 3.
GILZ régule l’inflammation en inhibant l’activité du facteur de transcription NF-kB. Les molécules dont l’expression est régulée par GILZ et les cellules dans lesquelles GILZ exerce son activité sont présentées. Les cellules hématopoïétiques sont représentées en rose et les cellules des tissus en jaune. GILZ inhibe l’activité de NF-kB dans les lymphocytes T [ 34], ce qui conduit à une inhibition de l’expression des cytokines IL-12 et IFN-γ. Dans les cellules dendritiques, l’inhibition de l’expression de MIP1α ( macrophage inhibitory protein 1α) et de RANTES ( regulated on activation, normal T cell expressed and secreted) par GILZ conduit à une induction de la différenciation des lymphocytes T en lymphocytes T régulateurs, caractérisés par l’expression de FOXP3 et de CD25 [ 35]. GILZ inhibe également l’expression des molécules de surface CD80 et CD86, et des chimiokines MIP1α et RANTES, par les monocytes/macrophages [ 19, 21]. GILZ régule aussi l’inflammation dans un modèle murin de polyarthrite rhumatoïde en inhibant la sécrétion des cytokines IL-1β, IL-6 et TNF-α par les macrophages et, in vitro, la production des cytokines IL-6 et IL-8 par les synoviocytes [ 23]. |
Cette action anti-inflammatoire de GILZ pourrait aussi s’exercer en pathologie humaine, comme le suggèrent des travaux récents dans la polyarthrite rhumatoïde (PR). Cette maladie auto-immune inflammatoire chronique est caractérisée par une forte production de TNF-a et d’IL-1-β. L’analyse de prélèvements de synovies de patients atteints de PR et de donneurs sains montre que GILZ est exprimée en quantité plus importante chez les patients [23]. Dans un modèle murin de polyarthrite, GILZ, dont l’expression est induite par l’administration de glucocorticoïdes, diminue la gravité de l’inflammation en régulant négativement la production des cytokines IL-1, IL-6 et TNF-α [23]. In vitro, GILZ diminue la production d’IL-6 et d’IL-8 par les synoviocytes stimulés par le LPS [23]. Récemment, une étude a démontré le rôle protecteur de GILZ dans un modèle murin d’encéphalomyélite auto-immune expérimentale (EAE), très utilisé pour étudier la physiopathologie de la sclérose en plaques humaine et pour tester de nouvelles approches thérapeutiques [34]. L’injection intrapéritonéale de la protéine GILZ murine recombinante, ou d’un peptide de GILZ correspondant aux 22 aa terminaux et capable de lier la sous-unité p65 de NF-kB, diminue la gravité de la pathologie [34]. L’ensemble de ces résultats documentent l’action anti-inflammatoire de GILZ. Au-delà, la littérature suggère également une action immunomodulatrice, en particulier par l’induction de lymphocytes T régulateurs via l’orientation du phénotype des cellules dendritiques en cellules dendritiques « tolérogènes ». En effet, GILZ augmente l’expression des molécules B7-H1/CD274 et ILT3/CD85k, ainsi que la production d’IL-10 – une cytokine immunosuppressive - dans les cellules dendritiques humaines [19]. Le phénotype de ces cellules dendritiques surexprimant GILZ leur permet d’orienter la différenciation des lymphocytes T CD4+ spécifiques de l’antigène en lymphocytes T régulateurs, caractérisés par l’expression du facteur FOXP3 (forkhead box P3) et de CD25, et par la production d’IL-10 [35] (Figure 3). À l’appui de ces observations, une plus faible expression de GILZ a été mesurée dans les cellules dendritiques de patients souffrant d’allergies respiratoires, et la restauration de l’expression de GILZ par les glucocorticoïdes augmente la capacité de ces cellules à induire ex vivo la différenciation de lymphocytes T régulateurs producteurs d’IL-10 et spécifiques de l’antigène [36]. De plus, dans les cellules dendritiques humaines dérivées de monocytes ou dans la lignée monocytaire THP-1, GILZ diminue l’expression des molécules de surface CD80 et CD86, impliquées dans la costimulation de lymphocytes T effecteurs [19, 21]. Enfin, plus récemment, l’expression de GILZ dans les lymphocytes T a été impliquée dans la production périphérique de lymphocytes T régulateurs [13]. En effet, en interagissant physiquement avec SMAD2 et contribuant ainsi à l’induction de l’expression de FOXP3, GILZ apparaît comme un médiateur essentiel de la coopération entre le TGF-β et les glucocorticoïdes dans la différenciation des lymphocytes T régulateurs [13]. Autres fonctions des protéines TSC-22D Dans les cellules rénales, GILZ (dont l’expression est induite par l’aldostérone) module le transport du sodium par le canal ENaC ( epithelial Na +channel) [ 6, 8], via l’augmentation de son expression membranaire. Enfin, l’établissement de lignées de souris déficientes en GILZ a montré que son rôle est indispensable dans la spermatogenèse [37]. En effet, les souris mâles knock-out pour GILZ sont stériles et présentent une sévère dysplasie des testicules avec une forte augmentation de l’apoptose cellulaire dans les tubules séminifères observée dès le 20e jour après la naissance [37]. L’absence de GILZ et L-GILZ chez les souris conduit à un défaut de spermatogenèse associé à une prolifération excessive des spermatogonies et à une hyperactivation de la voie Ras [38]. Le contrôle de la prolifération des spermatogonies a pu être spécifiquement restauré in vitro par l’administration d’une protéine de fusion TAT-L-GILZ, impliquant dans cet effet l’interaction protéine-protéine de la région amino-terminale de L-GILZ avec Ras [39]. |
Si GILZ, TSC-22, THG-1 et L-GILZ en sont les membres les plus étudiés, la famille des protéines TSC-22D est très vaste. Le fait qu’un stimulus puisse induire l’expression de plusieurs isoformes dans un même type cellulaire, et que celles-ci exercent les mêmes propriétés suggère fortement qu’elles puissent être redondantes, comme dans le cas de GILZ et L-GILZ. Si la plupart de ces protéines possèdent des structures homologues et sont exprimées dans la grande majorité des tissus, la complexité vient de la régulation très subtile de leur expression et de leurs fonctions en fonction du contexte cellulaire et de leurs interactions. À titre d’illustration, les protéines TSC-22D peuvent moduler de manière identique une fonction cellulaire, tout comme GILZ et TSC-22 inhibent la prolifération des cellules hématopoïétiques ou, au contraire, agir de façon antagoniste sur un paramètre cellulaire, comme dans le cas des effets de GILZ et TSC-22 sur l’apoptose des LT. Sur le plan mécanistique, ces régulations peuvent s’expliquer par la dimérisation, qui permet à GILZ d’être actif, ou à TSC-22 et THG-1 de réguler leurs activités respectives dans la cellule. Par ailleurs, l’expression d’une protéine peut être contrôlée par une autre, comme dans le cas de l’inhibition de l’expression de GILZ par TSC-22 décrite dans les lymphocytes T. Le TGF-β et l’IL-10, qui sont des inducteurs de l’expression de GILZ et/ou de TSC-22, participent également à l’orientation des lymphocytes T en lymphocytes T régulateurs ou lymphocytes T mémoires. Il serait donc intéressant d’évaluer si GILZ et/ou TSC-22 sont majoritairement exprimées dans une sous-population de lymphocytes T, et si ces protéines participent à la plasticité cellulaire des lymphocytes T. Les glucocorticoïdes, souvent utilisés dans le traitement des maladies anti-inflammatoires, possèdent de nombreux effets secondaires. Leur puissant mécanisme d’action repose non seulement sur l’inhibition de NF-kB ou d’AP-1, par une interaction physique avec le récepteur des glucocorticoïdes activé, mais aussi sur l’induction de gènes cibles, tels que GILZ, permettant d’amplifier ou même de relayer le signal anti-inflammatoire. Ainsi, GILZ a été décrit comme un puissant anti-inflammatoire dans des modèles murins de sclérose en plaques ou de polyarthrite rhumatoïde. L’administration ou la régulation de GILZ pourrait donc être envisagée dans le traitement de ces maladies inflammatoires, permettant alors de s’affranchir des effets délétères des glucocorticoïdes. TSC-22, quant à lui, voit son expression régulée négativement dans de nombreuses tumeurs et pourrait donc être utilisé comme un marqueur de la tumorigenèse. La multiplicité des fonctions des protéines TSC-22D en fait donc des acteurs majeurs à ne pas négliger dans la compréhension des mécanismes impliqués dans les pathologies inflammatoires et la tumorigenèse, ainsi que dans leurs traitements. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
D’Adamio F, Zollo O, Moraca R, et al. A new dexamethasone-induced gene of the leucine zipper family protects T lymphocytes from TCR/CD3-activated cell death . Immunity. 1997; ; 7 : :803.–812. 2.
Shibanuma M, Kuroki T, Nose K Isolation of a gene encoding a putative leucine zipper structure that is induced by transforming growth factor beta 1 and other growth factors . J Biol Chem. 1992; ; 267 : :10219.–10224. 3.
Fiol DF, Mak SK, Kultz D Specific TSC22 domain transcripts are hypertonically induced and alternatively spliced to protect mouse kidney cells during osmotic stress . FEBS J. 2007; ; 274 : :109.–124. 4.
Bruscoli S, Donato V, Velardi E, et al. Glucocorticoid-induced leucine zipper (GILZ) and long-gilz inhibit myogenic differentiation and mediate anti-myogenic effects of glucocorticoids . J Biol Chem. 2010; ; 285 : :10385.–10396. 5.
Khoury CM, Yang Z, Li XY, et al. A TSC22-like motif defines a novel antiapoptotic protein family . FEMS Yeast Res. 2008; ; 8 : :540.–563. 6.
Soundararajan R, Wang J, Melters D, Pearce D Differential activities of glucocorticoid-induced leucine zipper protein isoforms . J Biol Chem. 2007; ; 282 : :36303.–36313. 7.
Kester HA, Blanchetot C, den Hertog J, et al. Transforming growth factor-beta-stimulated clone-22 is a member of a family of leucine zipper proteins that can homo- and heterodimerize and has transcriptional repressor activity . J Biol Chem. 1999; ; 274 : :27439.–27447. 8.
Ayroldi E, Riccardi C. Glucocorticoid-induced leucine zipper (GILZ): a new important mediator of glucocorticoid action . Faseb J. 2009; ; 23 : :3649.–3658. 9.
Gupta RA, Sarraf P, Brockman JA, et al. Peroxisome proliferator-activated receptor gamma and transforming growth factor-beta pathways inhibit intestinal epithelial cell growth by regulating levels of TSC-22 . J Biol Chem. 2003; ; 278 : :7431.–7438. 10.
Lee JH, Rho SB, Park SY, Chun T. Interaction between fortilin and transforming growth factor-beta stimulated clone-22 (TSC-22) prevents apoptosis via the destabilization of TSC-22 . FEBS Lett. 2008; ; 582 : :1210.–1218. 11.
Yan X, Zhang J, Pan L, et al. TSC-22 promotes transforming growth factor beta-mediated cardiac myofibroblast differentiation by antagonizing Smad7 activity . Mol Cell Biol. 2011; ; 31 : :3700.–3709. 12.
Mittelstadt PR, Ashwell JD. Inhibition of AP-1 by the glucocorticoid-inducible protein GILZ . J Biol Chem. 2001; ; 276 : :29603.–29610. 13.
Bereshchenko O, Coppo M, Bruscoli S, et al. GILZ promotes production of peripherally induced Treg cells and mediates the crosstalk between glucocorticoids and TGF-beta signaling . Cell Rep. 2014; ; 7 : :464.–475. 14.
Nakamura M, Kitaura J, Enomoto Y, et al. Transforming growth factor-beta-stimulated clone-22 is a negative-feedback regulator of Ras/Raf signaling: Implications for tumorigenesis . Cancer Sci. 2012; ; 103 : :26.–33. 15.
Hino S, Kawamata H, Omotehara F, et al. Cytoplasmic TSC-22 (transforming growth factor-beta-stimulated clone-22) markedly enhances the radiation sensitivity of salivary gland cancer cells . Biochem Biophys Res Commun. 2002; ; 292 : :957.–963. 16.
Latre de Late P, Pepin A, Assaf-Vandecasteele H, et al. Glucocorticoid-induced leucine zipper (GILZ) promotes the nuclear exclusion of FOXO3 in a Crm1-dependent manner . J Biol Chem. 2010; ; 285 : :5594.–5605. 17.
Ohta S, Shimekake Y, Nagata K. Molecular cloning and characterization of a transcription factor for the C-type natriuretic peptide gene promoter . Eur J Biochem. 1996; ; 242 : :460.–466. 18.
Asselin-Labat ML, Biola-Vidamment A, Kerbrat S, et al. FoxO3 mediates antagonistic effects of glucocorticoids and interleukin-2 on glucocorticoid-induced leucine zipper expression . Mol Endocrinol. 2005; ; 19 : :1752.–1764. 19.
Cohen N, Mouly E, Hamdi H, et al. GILZ expression in human dendritic cells redirects their maturation and prevents antigen-specific T lymphocyte response . Blood. 2006; ; 107 : :2037.–2044. 20.
Godot V, Garcia G, Capel F, et al. Dexamethasone and IL-10 stimulate glucocorticoid-induced leucine zipper synthesis by human mast cells . Allergy. 2006; ; 61 : :886.–890. 21.
Berrebi D, Bruscoli S, Cohen N, et al. Synthesis of glucocorticoid-induced leucine zipper (GILZ) by macrophages: an anti-inflammatory and immunosuppressive mechanism shared by glucocorticoids and IL-10 . Blood. 2003; ; 101 : :729.–738. 22.
Hoppstadter J, Diesel B, Eifler LK, et al. Glucocorticoid-induced leucine zipper is downregulated in human alveolar macrophages upon Toll-like receptor activation . Eur J Immunol. 2012; ; 42 : :1282.–1293. 23.
Beaulieu E, Ngo D, Santos L, et al. Glucocorticoid-induced leucine zipper is an endogenous antiinflammatory mediator in arthritis . Arthritis Rheum. 2010; ; 62 : :2651.–2661. 24.
Wang Y, Ma YY, Song XL, et al. Upregulations of glucocorticoid-induced leucine zipper by hypoxia and glucocorticoid inhibit proinflammatory cytokines under hypoxic conditions in macrophages . J Immunol. 2012; ; 188 : :222.–229. 25.
Asselin-Labat ML, David M, Biola-Vidamment A, et al. GILZ, a new target for the transcription factor FoxO3, protects T lymphocytes from interleukin-2 withdrawal-induced apoptosis . Blood. 2004; ; 104 : :215.–223. 26.
Uchida D, Omotehara F, Nakashiro K, et al. Posttranscriptional regulation of TSC-22 (TGF-beta-stimulated clone-22) gene by TGF-beta 1 . Biochem Biophys Res Commun. 2003; ; 305 : :846.–854. 27.
Kato M, Wang L, Putta S, et al. Post-transcriptional up-regulation of Tsc-22 by Ybx1, a target of miR-216a, mediates TGF-beta-induced collagen expression in kidney cells . J Biol Chem. 2010; ; 285 : :34004.–34015. 28.
Yu J, Ershler M, Yu L, et al. TSC-22 contributes to hematopoietic precursor cell proliferation and repopulation and is epigenetically silenced in large granular lymphocyte leukemia . Blood. 2009; ; 113 : :5558.–5567. 29.
Nakashiro K, Kawamata H, Hino S, et al. Down-regulation of TSC-22 (transforming growth factor beta-stimulated clone 22) markedly enhances the growth of a human salivary gland cancer cell line in vitro and in vivo . Cancer Res. 1998; ; 58 : :549.–555. 30.
Joha S, Nugues AL, Hetuin D, et al. GILZ inhibits the mTORC2/AKT pathway in BCR-ABL+ cells . Oncogene. 2011; ; 31 : :1419.–1430. 31.
Ohta S, Yanagihara K, Nagata K. Mechanism of apoptotic cell death of human gastric carcinoma cells mediated by transforming growth factor beta . Biochem J. 1997; ; 324 : :777.–782. 32.
Redjimi N, Gaudin F, Touboul C, et al. Identification of glucocorticoid-induced leucine zipper as a key regulator of tumor cell proliferation in epithelial ovarian cancer . Mol Cancer. 2009; ; 8 : :83.. 33.
Esposito E, Bruscoli S, Mazzon E, et al. Glucocorticoid-induced leucine zipper (GILZ) over-expression in T lymphocytes inhibits inflammation and tissue damage in spinal cord injury . Neurotherapeutics. 2011; ; 9 : :210.–225. 34.
Srinivasan M, Janardhanam S. Novel p65 binding glucocorticoid-induced leucine zipper peptide suppresses experimental autoimmune encephalomyelitis . J Biol Chem. 2011; ; 286 : :44799.–44810. 35.
Hamdi H, Godot V, Maillot MC, et al. Induction of antigen-specific regulatory T lymphocytes by human dendritic cells expressing the glucocorticoid-induced leucine zipper . Blood. 2007; ; 110 : :211.–219. 36.
Karaki S, Garcia G, Tcherakian C, et al. Enhanced glucocorticoid-induced leucine zipper in dendritic cells induces allergen-specific regulatory CD4+ T-cells in respiratory allergies . Allergy. 2014; ; 69 : :624.–631. 37.
Suarez PE, Rodriguez EG, Soundararajan R, et al. The glucocorticoid-induced leucine zipper (gilz/Tsc22d3-2) gene locus plays a crucial role in male fertility . Mol Endocrinol. 2012; ; 26 : :1000.–1013. 38.
Bruscoli S, Velardi E, Di Sante M, et al. Long glucocorticoid-induced leucine zipper (L-GILZ) protein interacts with ras protein pathway and contributes to spermatogenesis control . J Biol Chem. 2012; ; 287 : :1242.–1251. 39.
Venanzi A, Di Sante M, Bruscoli S, et al. Recombinant long-glucocorticoid-induced leucine zipper (L-GILZ) protein restores the control of proliferation in gilz KO spermatogonia . Eur J Pharm Sci. 2014;; 63C : :22.–28. 40.
Cabon L, Martinez-Torres AC, Susin SA. La mort cellulaire programmée ne manque pas de vocabulaire . Med Sci (Paris). 2013; ; 29 : :1117.–1124. |