| |
| Med Sci (Paris). 2015 February; 31(2): 127–128. Published online 2015 March 4. doi: 10.1051/medsci/20153102004.Les mastocytes aggravent le choc septique chez la souris en inhibant la phagocytose des macrophages péritonéaux Grégory Gautier1,2** and Pierre Launay1,2* 1Centre de recherche sur l’inflammation, Inserm U1149, UFR de médecine Bichat, 75018Paris, France 2Université Paris Diderot, Sorbonne Paris Cité, Laboratoire d’excellence INFLAMEX, 75018Paris, France MeSH keywords: Animaux, Granulocytes basophiles, Cytokines, Modèles animaux de maladie humaine, Gènes rapporteurs, Interleukine-4, Macrophages péritonéaux, Mastocytes, Souris, Souris knockout, Souris transgéniques, Péritonite, Phagocytose, Sepsie, Récepteur de type Toll-4, immunologie, sécrétion, pharmacologie, physiologie, effets des médicaments et substances chimiques, transplantation, déficit |
Interaction macrophages résidents-mastocytes lors d’une infection péritonéale Le choc septique est la première cause de mortalité dans le monde. Il résulte d’une réponse aiguë de l’organisme à une infection bactérienne sévère. Le contrôle des phases précoces de cette infection sévère est primordial pour augmenter le taux de survie. Dans une péritonite, due à une infection bactérienne du péritoine, les macrophages péritonéaux sont une première ligne de défense. Les neutrophiles et les monocytes sanguins sont ensuite rapidement recrutés dans la cavité péritonéale afin de participer à la décimation bactérienne. Les mastocytes sont des cellules présentes dans la cavité péritonéale, et ont été décrites comme jouant un rôle pro-inflammatoire ou anti-inflammatoire suivant le moment de l’infection ou le type d’infection (aiguë ou chronique) [1]. Les mastocytes (mais également les basophiles) contiennent dans leurs granules des cytokines qui peuvent être immédiatement libérées en réponse à leur activation [2]. Nous avons donc émis l’hypothèse selon laquelle les mastocytes pourraient jouer un rôle clé régulateur dans la différenciation et la maturation des cellules macrophagiques résidentes. Pour analyser le rôle physiologique des mastocytes et des basophiles in vivo, nous avons généré un nouveau modèle de souris permettant de suivre ces cellules en détectant l’émission de fluorescence, et de les éliminer par injection de toxine diphtérique (DT)1. Cette souris, appelée RMB (red mast cells and basophils), possède également l’avantage de ne présenter aucun défaut hématopoïétique, contrairement aux autres modèles murins existants couramment utilisés pour étudier les mastocytes. Notre souris RMB nous a permis d’établir les cinétiques de repopulation des mastocytes et basophiles après leur élimination totale : 12 jours pour un retour complet des basophiles dans la circulation contre plusieurs mois pour normaliser le taux de mastocytes. En utilisant un modèle de sepsis chez la souris par induction d’une ligature suivie d’une perforation du caecum, nous avons observé que le taux de survie des souris RMB dont seuls les mastocytes sont éliminés (le choc septique est créé au-delà de 12 jours alors que le taux de basophiles est rétabli) était meilleur que celui des souris contrôles. Aucune différence des taux de cytokines sécrétées dans le péritoine et dans le sang n’est observée si l’on compare les souris dépourvues de mastocytes et les souris contrôles. En revanche, le nombre de bactéries dans le sang et dans le péritoine s’est avéré être beaucoup plus important chez les souris possédant des mastocytes. Cette augmentation du nombre de bactéries suggérait un défaut des cellules effectrices résidentes. Alors que les cellules péritonéales ne sont pas affectées par l’absence de mastocytes en situation normale, l’induction d’un sepsis en l’absence de mastocytes a induit une altération profonde du nombre de macrophages péritonéaux. |
Le rôle clé de l’IL-4 sécrétée par les mastocytes activés Nous nous sommes donc particulièrement intéressés à la relation entre mastocytes résidents et macrophages résidents, qui représentent la première ligne de défense antibactérienne. Des études in vitro ont été menées pour comprendre cette relation. Après stimulation de mastocytes par des bactéries, le surnageant de culture des mastocytes stimulés est récupéré et filtré afin d’éliminer les bactéries et les débris cellulaires. Ce surnageant est ensuite déposé sur des macrophages issus de la cavité péritonéale. Nous avons ainsi observé que la phagocytose de bactéries par les macrophages est inhibée par un facteur soluble provenant des mastocytes. La libération de ce facteur se produit après un temps très court d’exposition des mastocytes aux bactéries (15 minutes suffisent), suggérant que ce facteur est préalablement accumulé dans les granules mastocytaires. En utilisant des mastocytes dérivés de souris déficientes pour le récepteur TLR-4 (toll like receptor) ou pour un intermédiaire de la voie de transduction du signal TLR, nous avons montré l’implication du TLR-4 dans l’activation bactérienne de ces cellules. Des recherches bibliographiques ont montré que l’IL(interleukine)-4 peut contrôler la phagocytose des bactéries par les macrophages. Comme les mastocytes sont riches en IL-4, nous avons testé cette hypothèse et démontré que les mastocytes produisent de l’IL-4 après seulement 15 minutes d’activation bactérienne. Les macrophages déficients pour le récepteur de l’IL-4 ne sont plus sensibles à l’inhibition de phagocytose induite par les mastocytes activés. De plus, à l’aide d’anticorps neutralisant l’IL-4 et de mastocytes issus de souris déficientes pour la synthèse d’IL-4, nous avons confirmé l’implication majeure de cette cytokine. Le récepteur de l’IL-4 partageant une chaîne commune avec celui de l’IL-13, nous avons également testé le rôle de l’IL-13. Aucune inhibition n’a été observée avec des anticorps neutralisants anti-IL-13, et les mastocytes issus de souris déficientes pour la synthèse d’IL-13 induisent la même inhibition, excluant tout rôle de cette cytokine. Afin de confirmer nos résultats in vivo, des souris RMB dont les mastocytes ont été éliminés par injection de toxine diphtérique ont été reconstituées soit avec des mastocytes provenant de souris déficientes en IL-4, soit avec des mastocytes de souris sauvages. Nous avons observé que le taux de survie après induction d’un sepsis par blessure caecale des souris reconstituées avec des mastocytes déficients en IL-4 est supérieur à celui des souris reconstituées avec des mastocytes provenant de souris sauvages. Enfin, la survie après blessure caecale de souris injectées avec un anticorps neutralisant l’IL-4 est également fortement augmentée comparée à celle des souris injectées avec un anticorps isotype contrôle. L’ensemble de ces résultats in vitro et in vivo démontrent un rôle spécifique de l’IL-4 sécrétée par les mastocytes activés par des bactéries dans l’inhibition de la phagocytose des macrophages, et met en évidence le rôle délétère des mastocytes lors d’une infection bactérienne sévère [3] (Figure 1).
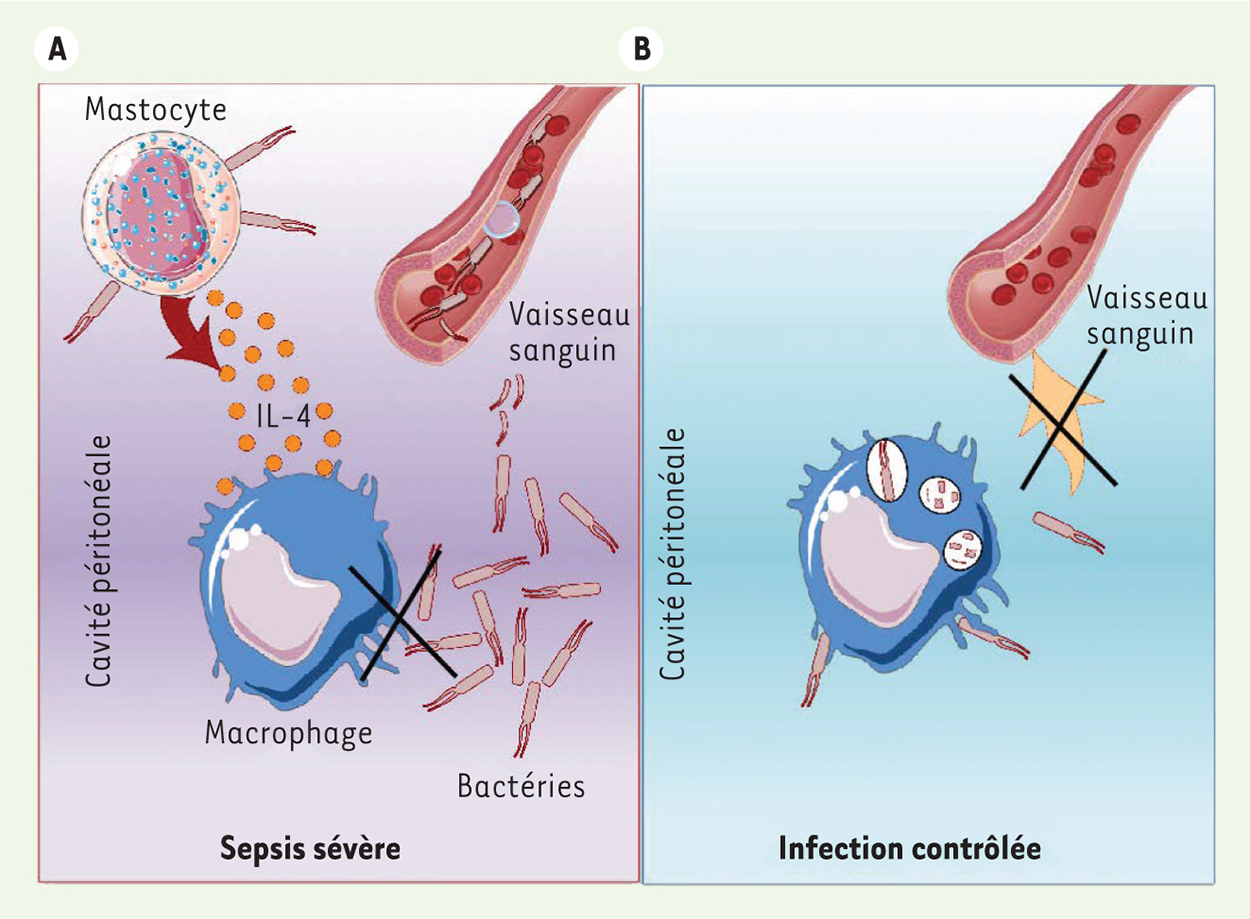
 | Figure 1.
L’IL-4 mastocytaire contrôle la phagocy tose des macrophages. A. Dans un modèle aigu de choc septique, les mastocytes sécrètent de l’IL-4 dès les premières minutes de l’infection bactérienne, ce qui affecte la phagocytose des bactéries par les macrophages résidents. Cette réduction de phagocytose impacte la survie des souris infectées.
B. chez les souris déficientes en mastocytes, les macrophages résidents peuvent efficacement phagocyter les bactéries infiltrantes et réduire la mortalité des souris en choc septique en contrôlant l’infection (modifiée d’après J Clin Invest [ 3]). |
|
Lors d’une forte prolifération accidentelle de bactéries dans la cavité péritonéale, les mastocytes libèrent instantanément de l’IL-4 qui inhibe la capacité des macrophages résidents à phagocyter les bactéries. Celles-ci peuvent alors prendre le système immunitaire de vitesse en proliférant et en se propageant via le sang dans tout l’organisme, conduisant à une septicémie. En revanche, la neutralisation de cette étape précoce de libération d’IL-4 mastocytaire permet aux macrophages résidents de contenir l’infection bactérienne, contribuant ainsi à la résolution de la péritonite. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Tsai M, Grimbaldeston MA, Yu M, Tam SY, Galli SJ. Using mast cell knock-in mice to analyze the roles of mast cells in allergic responses in vivo . Chem Immunol Allergy. 2005; ; 87 : :179.–197. 2.
de Vries VC, Noelle RJ. Mast cell mediators in tolerance . Curr Opin Immunol. 2010; ; 22 : :643.–648. 3.
Dahdah A, Gautier G, Attout T, et al. Mast cells aggravate sepsis by inhibiting peritoneal macrophage phagocytosis . J Clin Invest. 2014; ; 124 : :4577.–4589. |