| |
| Med Sci (Paris). 2015 February; 31(2): 135–136. Published online 2015 March 4. doi: 10.1051/medsci/20153102007.Un nouveau rôle pour le canal ionique TRPV1 dans l’activation des lymphocytes T CD4 Samuel Bertin1* and Eyal Raz1 1University of California, San Diego, Department of Medicine, Stein Clinical Research, Room 126, 9500 Gilman Drive, La Jolla, CA92093-0663, États-Unis MeSH keywords: Animaux, Lymphocytes T CD4+, Signalisation du calcium, Capsaïcine, Humains, Inflammation, Activation des lymphocytes, Lymphokines, Souris, Souris knockout, Cartographie d'interactions entre protéines, Canaux cationiques TRPV, composition chimique, physiologie, immunologie, effets des médicaments et substances chimiques, pharmacologie, étiologie, sécrétion, déficit |
Les ions calcium (Ca2+) régulent une multitude de processus cellulaires, et la signalisation induite par le Ca2+ est essentielle à la fonction de la plupart des cellules, y compris les lymphocytes T CD4 (LT CD4) [1]. Ces derniers orchestrent la réponse immunitaire à médiation cellulaire à l’encontre de potentiels agents pathogènes, de cellules infectées par des virus ou de cellules tumorales, et sont également impliqués dans la réponse inflammatoire associée à certaines maladies auto-immunes telles que les maladies inflammatoires chroniques de l’intestin (MICI) [2]. Une entrée de Ca2+ est un événement essentiel à l’activation des LT CD4 et à leur différenciation en lymphocytes T effecteurs [1]. Bien que les canaux CRAC (Ca2+-release activated Ca2+ channel) soient reconnus comme importants pour ce processus, de nombreuses études indiquent que les LT CD4 expriment également d’autres canaux ioniques dont les fonctions sont, pour la plupart, méconnues [3, 4]. |
Activation des lymphocytes T par le Ca2 +Jusqu’à ce jour, la recherche sur l’entrée de Ca2+ dans les cellules non excitables a été dominée par le concept d’entrée de Ca2+ dépendante de la libération des réserves (SOCE ou store operated Ca2+ entry) [1, 3]. Dans ce modèle, l’entrée de Ca2+ se fait en deux temps. Ainsi, la libération des réserves calciques intracellulaires (par exemple les citernes du réticulum endoplasmique et l’appareil de Golgi) précède et induit l’entrée de Ca2+ extracellulaire par des canaux calciques localisés sur la membrane plasmique. Des travaux menés au cours des 10 dernières années ont permis d’identifier les protéines ORAI1 et STIM1 (stromal interacting molecule 1) comme les constituants principaux des canaux CRAC et largement responsables de l’influx SOCE [1, 3, 5]. Le rôle important de ces canaux a notamment été reconnu lors de l’identification de mutations, entre autres dans les gènes ORAI1 et STIM1, dans le déficit immunitaire combiné sévère (DICS) [5] (→).
(→) Voir la Synthèse de F. Le Deist et T. Capiod, m/s n° 8-9, août-septembre 2011, page 737
Bien que le rôle des canaux CRAC et de l’entrée SOCE dans l’activation lymphocytaire soit incontestable, il existe également une autre voie d’entrée de Ca2+ dont l’activation est totalement indépendante de la libération des réserves calciques intracellulaires (SICE store independent Ca2+ entry) [1, 3]. Cependant, ce type d’entrée de Ca2+, ainsi que les acteurs moléculaires en jeu, n’ont à ce jour pas encore été clairement identifiés. Parmi les canaux ioniques potentiellement responsables de l’influx SICE, certains canaux de la famille TRP (transient receptor potential) ont été évoqués [6] (→).
(→) Voir la Synthèse de G. Vassort et J. Fauconnier, m/s n° 2, février 2008, page 163
|
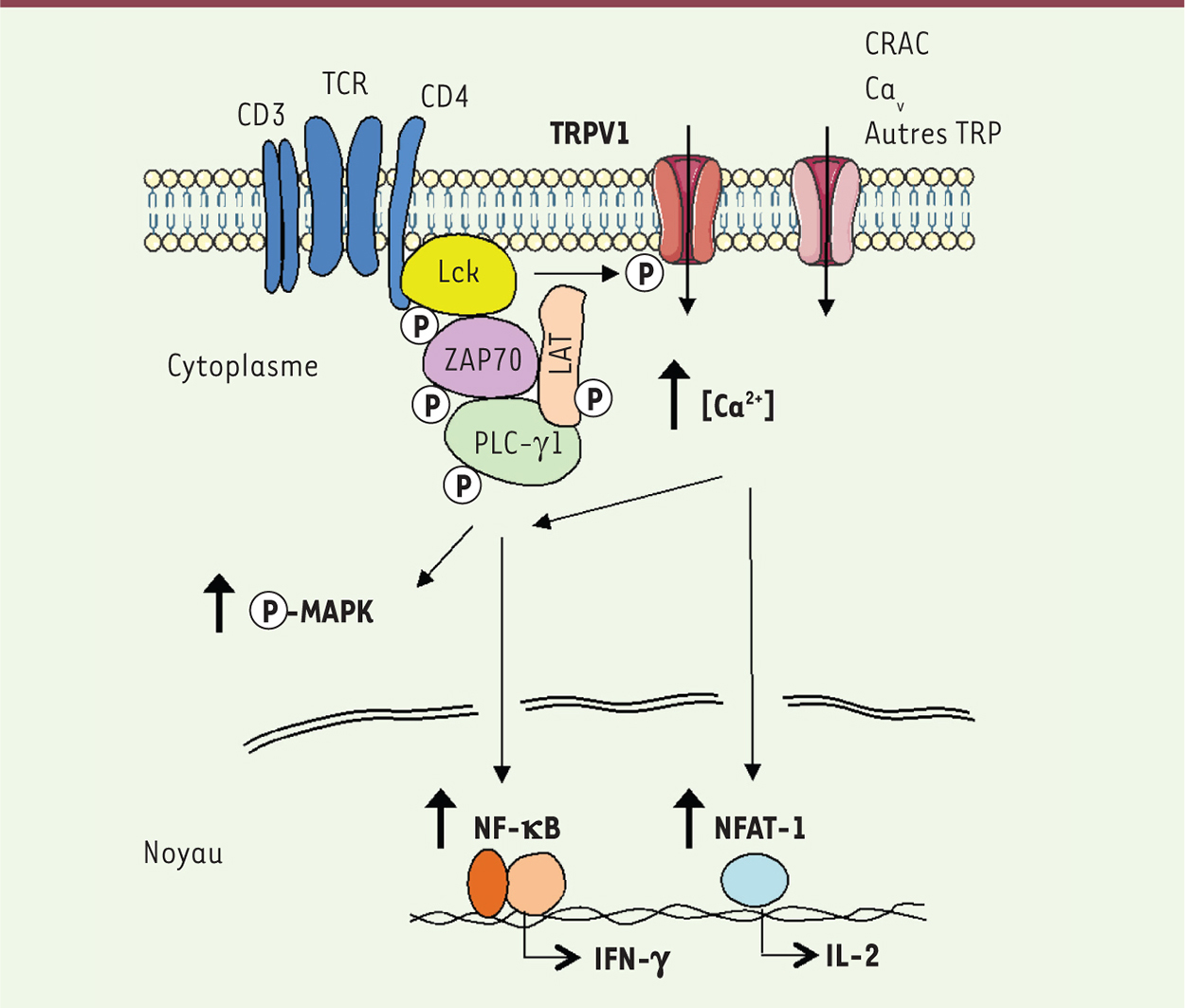
Le rôle du canal ionique TRPV1 TRPV1 (transient receptor potential vanilloid-1) a été le premier canal de la famille TRP à être identié chez les mammifères. Il est aussi connu sous le nom de récepteur de la capsaïcine, l’ingrédient actif trouvé dans les piments forts [7]. Depuis sa découverte, TRPV1 a principalement été étudié dans le système nerveux périphérique et il a été établi que ce canal joue un rôle prépondérant dans la perception de la douleur. Cependant, il est très exprimé dans le corps en dehors des systèmes nerveux central et périphérique, par exemple dans la peau, l’appareil digestif, et le système immunitaire [6, 8]. Ainsi, nous avons récemment découvert l’expression des canaux TRPV1 à la surface des LT CD4 et leur rôle dans l’entrée de Ca2+ dans ces cellules dans des conditions physiologique et pathologique [9]. À l’aide de techniques d’imagerie calcique, nous avons démontré que la capsaïcine, un agoniste sélectif du canal TRPV1 [7], induit un influx de Ca2+ extracellulaire dans les LT CD4 isolés de souris sauvages, mais pas dans les LT CD4 isolés de souris déficientes pour TRPV1. Nous avons ensuite réalisé des expériences de patch-clamp et confirmé les caractéristiques biophysiques des canaux TRPV1 exprimés à la surface des LT CD4. Bien que le rapport de perméabilité au Ca2+ et au sodium (PCa/PNa) soit d’environ 10 pour TRPV1 [7], et donc par comparaison moins sélectif pour le Ca2+ que ce rapport dans les canaux CRAC [3, 4], nous avons identifié que l’influx de Ca2+ induit par le TCR (T cell receptor) était moindre dans les LT CD4 déficients pour TRPV1 que dans les LT CD4 de type sauvage. Cette observation était également reproductible après traitement de LT CD4 sauvages par des antagonistes sélectifs pour TRPV1. En revanche, une activation des LT CD4 de façon indépendante du TCR (T-cell receptor) - avec l’ionomycine ou la thapsigargine (un inhibiteur spécifique des ATPases-Ca2+ SERCA qui pompent le Ca2+ à l’intérieur du réticulum) - n’affectait pas l’influx de Ca2+via TRPV1. Ces résultats suggéraient que TRPV1 agit comme un canal SICE dans les LT CD4 et contribue à l’influx de Ca2+ induit par le TCR. Nous avons ensuite cherché à comprendre comment TRPV1 est activé après stimulation du TCR. À l’aide de techniques d’imagerie confocale, nous avons constaté que TRPV1 est physiquement associé à la molécule CD4 (un corécepteur du TCR) ainsi qu’à la protéine tyrosine kinase Lck dans les LT CD4. De plus, la stimulation du TCR induit rapidement la phosphorylation de TRPV1 sur des résidus tyrosine, mais ce phénomène est absent dans des LT CD4 déficients en Lck. Sur la base de ces observations, nous avons postulé que la phosphorylation de TRPV1 par Lck pourrait conduire à l’activation des canaux TRPV1 après stimulation du TCR. Cependant, d’autres mécanismes en aval du TCR peuvent également contribuer à l’activation de TRPV1, telle que l’hydrolyse du phosphatidyl-inositol-diphosphate (PIP2) par la phospholipase C-γ1 (PLC-γ1), qui libère TRPV1 de l’inhibition exercée par PIP2 [10]. Dans ces LT CD4 déficients en TRPV1, et contrairement aux LT-CD4 de type sauvage, nous avons observé une diminution de l’activation des facteurs de transcription NFAT (Nuclear factor of activated T-cells) et NF-kB, en accord avec la réduction de l’influx calcique induit par le TCR, ainsi qu’une réduction de la production de certaines cytokines, telles que l’interleukine-2 (IL-2) et l’interféron-γ (IFN-γ), après stimulation du TCR. De plus, dans des modèles animaux de MICI, la délétion génétique ou l’inhibition pharmacologique de TRPV1 dans les LT CD4 réduisent de manière significative la gravité de la colite. |
Conclusions et perspectives Déterminer comment les signaux calciques sont régulés dans les LT CD4 est essentiel pour mieux comprendre les mécanismes conduisant à l’activation de ces cellules, et pour concevoir des stratégies thérapeutiques ciblant cette voie de signalisation, par exemple pour le traitement de maladies auto-immunes ou inflammatoires. Nos observations suggèrent que les canaux TRPV1 jouent des rôles physiologiques importants au-delà de leurs fonctions largement décrites de récepteurs de la douleur dans les neurones sensoriels. Ainsi, notre étude démontre que l’influx de Ca2+ au travers des canaux TRPV1 contribue à l’activation des LT CD4 et à la production de cytokines pro-inflammatoires par ces cellules (Figure 1). Ces données suggèrent que cibler TRPV1 pourrait représenter une nouvelle stratégie thérapeutique pour inhiber les réponses pro-inflammatoires associées à certaines maladies auto-immunes telles que les MICI. ‡
 | Figure 1.
Modèle proposé pour la régulation de l’activation des LT CD4 par TRPV1. La stimulation du TCR induit une cascade de phosphorylations qui conduit à l’activation de canaux calciques localisés sur la membrane plasmique. Nos observations suggèrent que TRPV1 fait partie de ces canaux et contribue à l’influx de Ca 2+ nécessaire à l’activation de voies de signalisation en aval ainsi qu’aux fonctions des LT-CD4, comme par exemple la production de cytokines. © : Nature publishing group [ 9]. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Hogan PG, Lewis RS, Rao A. Molecular basis of calcium signaling in lymphocytes : STIM and ORAI . Annu Rev Immunol. 2010; ; 28 : :491.–533. 2.
Monteleone G, Caprioli F. T-cell-directed therapies in inflammatory bowel diseases . Clin Sci (Lond). 2010; ; 118 : :707.–715. 3.
Feske S, Skolnik EY, Prakriya M. Ion channels and transporters in lymphocyte function and immunity . Nat Rev Immunol. 2012; ; 12 : :532.–547. 4.
Feske S.. Ca2+ influx in T cells : how many Ca2+ channels? Front Immunol. 2013; ; 4 : :99.. 5.
Le Deist F, Capiod T. Immunodéficiences et pathologies associées aux mutations dans STIM/ORAI : un complexe membranaire au cœur de la signalisation calcique . Med Sci (Paris). 2011; ; 27 : :737.–745. 6.
Vassort G, Fauconnier J. Les canaux TRP (transient receptor potential): une nouvelle famille de canaux à expression variée . Med Sci (Paris). 2008; ; 24 : :163.–168. 7.
Caterina MJ, Schumacher MA, Tominaga M, et al. The capsaicin receptor : a heat-activated ion channel in the pain pathway . Nature. 1997; ; 389 : :816.–824. 8.
Fernandes ES, Fernandes MA, Keeble JE. The functions of TRPA1 and TRPV1: moving away from sensory nerves . Br J Pharmacol. 2012; ; 166 : :510.–521. 9.
Bertin S, Aoki-Nonaka Y, de Jong PR, et al. The ion channel TRPV1 regulates the activation and proinflammatory properties of CD4+ T cells . Nat Immunol. 2014; ; 15 : :1055.–1063. 10.
Prescott ED, Julius D. A modular PIP2 binding site as a determinant of capsaicin receptor sensitivity . Science. 2003; ; 300 : :1284.–1288. |