| |
| Med Sci (Paris). 2015 February; 31(2): 203–208. Published online 2015 March 5. doi: 10.1051/medsci/20153102018.Journal de bord d’un prix Nobel Laure Rondi-Reig1,2,3* 1CNRS, UMR 8246, Neuroscience Paris Seine-IBPS, équipe cervelet, navigation et mémoire, 9, quai Saint Bernard, case 16, 75005, Paris, France 2Sorbonne Universités, UPMC Université Paris 06, DHU FAST, UM119 3Inserm, UMR-S 1130, F-75005, Paris, France |

Identifier les déterminants de nos comportements, comprendre l’origine mécanistique de nos actions et de nos pensées constituent le graal de chaque neuroscientifique. C’est en enregistrant l’activité des neurones dans le cerveau de rongeurs que John O’Keefe, puis Edvard et May-Britt Moser, ont découvert des indicateurs neuronaux de position et de déplacement : les cellules de lieu et les cellules de grille. Le prix Nobel de médecine ou physiologie 2014 a été attribué à une découverte fondamentale à plusieurs titres. Tout d’abord parce qu’il s’agit d’une découverte de recherche fondamentale ! « Il n’y a pas de recherche appliquée » disait Pasteur, « il n’y a que des applications de la recherche ». Cette récompense prestigieuse met ainsi en lumière l’importance de financer des recherches sur les mécanismes fondamentaux du cerveau. Mieux comprendre comment le cerveau fonctionne pour expliquer pourquoi il dysfonctionne. Ensuite, parce que cette découverte révèle des mécanismes neurophysiologiques qui sous-tendent une fonction cognitive complexe et essentielle au quotidien : notre représentation spatiale, c’est-à-dire notre mémoire de l’espace, des trajets et de nos déplacements. |
Des paradigmes d’apprentissage à l’hypothèse de carte cognitive Au début du xxe siècle, John Broadus Watson, héritier de Descartes, crée la behaviorist school. Il souhaite objectiver l’approche psychologique et oppose à l’introspection l’approche empirique fondée sur l’observation d’évènements mesurables en réponse à des stimulus de l’environnement. Il fait de l’apprentissage par « essai-erreur » un paradigme central pour l’étude du comportement. Le courant de pensée initié par Watson suppose que tous les comportements peuvent être expliqués sans impliquer la conscience. Burrhus Frederic Skinner, dans les années 1940 à 1950, introduit, en lien avec cette notion centrale d’apprentissage, la notion de conditionnement opérant. Des animaux apprennent par essai-erreur les actions à effectuer pour obtenir une récompense. En étudiant le comportement animal en lien avec l’environnement dans lequel il a lieu, Skinner se situe dans le courant « behavioriste » initié par Watson, mais il est également influencé par les travaux de Pavlov sur le conditionnement des animaux et les idées de Thorndike sur l’apprentissage. Il établit ainsi les notions de renforcement et d’apprentissage programmé mais continu. Il suppose que le comportement devient de plus en plus automatique si une réponse est stable. De plus, si l’effet du comportement est source de plaisir, celui-ci sera renforcé. L’objectif de Skinner est de caractériser les conditions et les processus par lesquels l’environnement (stimulus) contrôle le comportement (réponse), sans faire référence à des variables internes considérées comme non observables et hypothétiques. Le cerveau, et a fortiori les mécanismes cérébraux, sont donc considérés comme une boite noire et les protocoles expérimentaux d’apprentissage sont extrêmement simplifiés (Figure 1).
 | Figure 1.
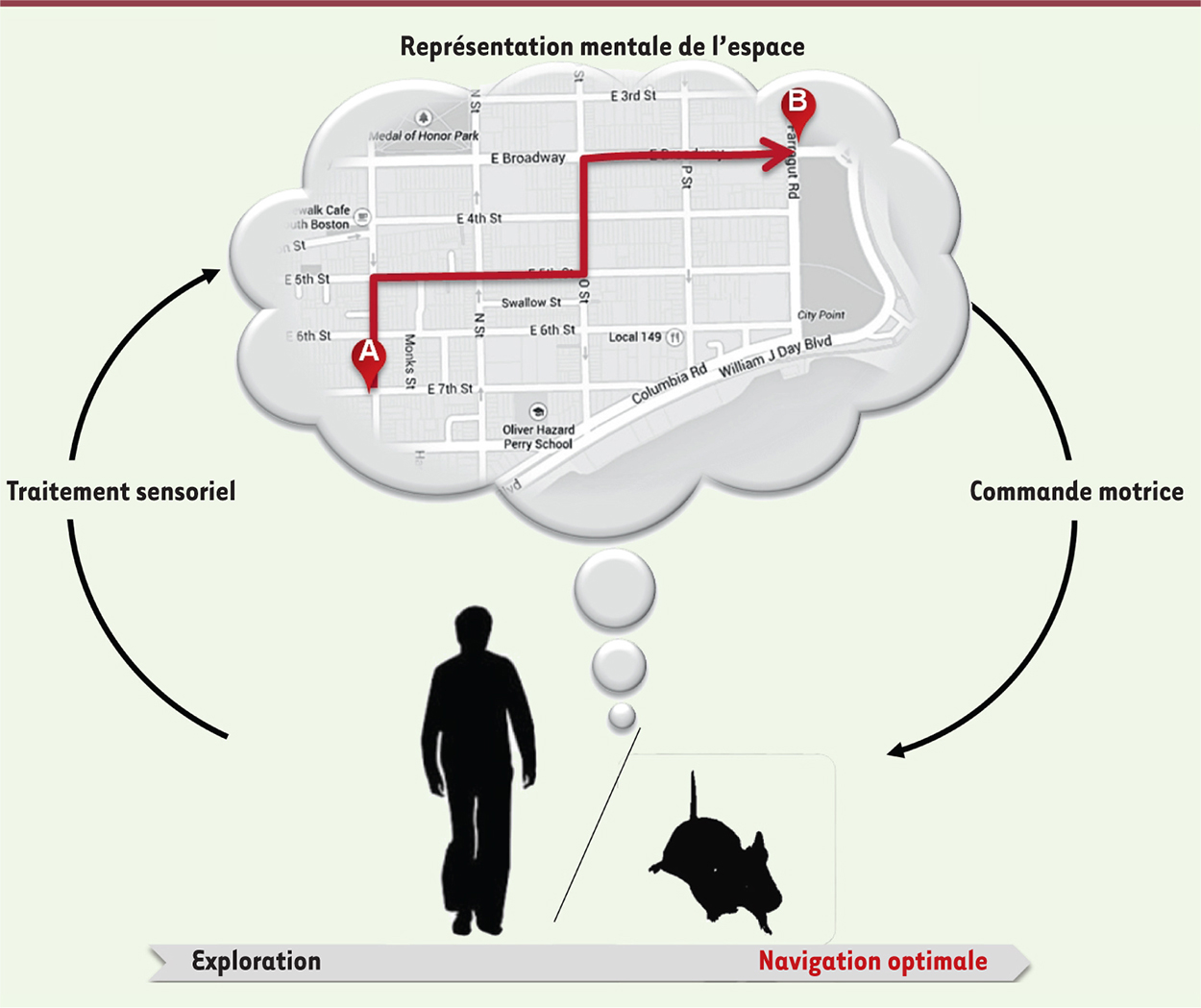
Un lien entre processus cérébraux et comportement. Schéma illustrant le lien causal entre représentation mentale et navigation. Il existe une double dynamique à l’échelle comportementale et à l’échelle des processus mentaux. Le comportement d’exploration est caractéristique de la découverte d’un nouvel environnement et peut évoluer vers une navigation dirigée vers un but et l’utilisation d’un chemin optimal (ici symbolisé par la flèche rouge). En parallèle, le navigateur se crée une représentation mentale de l’environnement dans lequel il navigue, représentation qui peut être modifiée/mise à jour lors de la navigation et grâce aux différents signaux sensoriels perçus par le navigateur. Réciproquement, cette représentation mentale va guider la mise en œuvre et l’organisation dans le temps d’un ensemble de commandes motrices engendrant les déplacements volontaires dans l’environnement. Les cellules de lieu et les cellules de grille font partie des substrats neuronaux de la représentation mentale. |
Il faut attendre 1948 pour voir émerger une approche cognitiviste. Edvard Tolman suggère alors que les animaux pourraient interagir avec le monde extérieur grâce à une représentation mentale de cet environnement : une « carte cognitive ». Cette carte du monde extérieur pourrait être apprise grâce à un traitement cérébral de diverses informations sensorielles, mémorisées et ensuite utilisées d’une façon adaptative, permettant ainsi un comportement flexible face aux changements de l’environnement [1]. Cette théorie repose sur une expérience effectuée en 1930 dans laquelle Tolman montra que des rats, habitués à chercher de la nourriture dans un labyrinthe par un chemin court, étaient capables, lorsque ce chemin était bloqué, de choisir celui permettant de contourner le blocage [2]. Entre « behavioristes » et cognitivistes, le débat sur l’existence de processus mentaux s’installe, mais le cerveau reste une boite noire. |
Les microélectrodes : quand électrophysiologie et comportement se rencontrent, la boite noire s’éclaire au niveau de l’hippocampe Lorsque les premiers enregistrements intracérébraux commencent à être réalisés, les chercheurs détectent plus facilement l’activité d’une cellule nerveuse dans l’hippocampe que dans le cortex. Ces succès expliquent que le cortex hippocampique ait servi de banc d’essai pour un grand nombre de développements méthodologiques en neuroscience. En particulier, les premières implantations cérébrales de microélectrodes sont réalisées dans l’hippocampe. En 1940, Birdsie Renshaw, Alexander Forbes et Robert Morison y réalisent les premiers enregistrements extracellulaires intracérébraux, réussissant ainsi à détecter dans cette structure l’activité à l’échelle d’une cellule nerveuse. En 1971, John O’Keefe et son étudiant Dostrovsky enregistrent dans l’hippocampe l’activité de cellules uniques, les cellules pyramidales, chez un animal éveillé en train de réaliser un comportement d’exploration. Très vite, il apparaît que le champ récepteur de ces neurones a une nature particulière puisqu’il dépend de l’endroit où l’animal se trouve : O’Keefe nomme ces neurones « cellules de lieu », et l’endroit où elles déchargent « champ de lieu ». De manière surprenante, chaque cellule de lieu est active pour une position particulière de l’animal dans un environnement. Ensemble, les différents neurones semblent donc former une carte mentale de l’environnement. La découverte va révolutionner l’approche des neurosciences comportementales. En 1978, O’Keefe développe sa découverte dans un livre écrit conjointement avec Lynn Nadel intitulé The Hippocampus as a cognitive map. La théorie de la carte cognitive assise sur des bases physiologiques va ouvrir des décennies d’expériences et de débats qui ont façonné la recherche en neurosciences et, en son sein, la compréhension des mécanismes de la mémoire. De nombreux travaux de recherche découlent de la découverte des cellules de lieu dans l’hippocampe. En effet, celles-ci ont des caractéristiques curieuses. L’activité des cellules de lieu hippocampiques est souvent mesurée alors que le rongeur explore des petites arènes circulaires. Dans ce cas, la plupart des cellules n’ont qu’un champ de lieu, parfois deux, mais jamais plus. En enregistrant plusieurs cellules de lieu, O’Keefe et ses collaborateurs notent que l’activité d’un ensemble de cellules de lieu indique à l’animal où il se trouve dans l’espace [3, 4]. Si l’animal est placé dans un nouvel environnement, une bonne moitié des cellules vont continuer à être actives ; cependant, la nouvelle position de leur champ de lieu sera totalement indépendante de celle qui était observée dans l’environnement précédent. Ce processus, connu sous le nom de remapping, peut être interprété comme un signal de nouveauté. À l’inverse, lorsqu’un animal se déplace dans le noir, dans une arène qu’il a préalablement explorée de jour, l’activité des cellules de lieu reste stable [5], suggérant que l’environnement a été mémorisé. Un deuxième éclairage apporté par O’Keefe concerne l’organisation de la carte spatiale, qui ne ressemble en rien aux cartes sensorielles décrites par Marshall, Mountcastle, Hubel et Wiesel dans le cortex. Dans le cas du toucher ou de la vision, des cellules voisines codent l’information provenant de régions voisines. Pour la carte spatiale, aucune topographie claire n’existe : des neurones adjacents dans l’hippocampe n’ont pas des champs de lieu adjacents dans l’environnement. Ce résultat est tout aussi inattendu et novateur que la découverte des cellules de lieu. Les cellules pyramidales de l’hippocampe ont donc une activité qui leur permet de coder l’espace dans lequel un navigateur se déplace. Cependant, alors que les cellules de lieu véhiculent une information sur la position de l’animal, naviguer d’un endroit à un autre nécessite un substrat neuronal plus diversifié, communiquant également sur le but à atteindre et les chemins possibles. De nombreux travaux vont se lancer dans la quête de ce chaînon manquant. |
Une mémoire de l’espace ou un espace de mémoire : le lien entre mémoire et navigation Alors que des études psychologiques classiques chez un patient devenu célèbre, le patient HM, permettent à Brenda Milner et William Scoville d’établir dès 1957 l’importance de l’hippocampe dans l’encodage d’une mémoire déclarative et le rappel d’informations de nature épisodique (les notions de quoi, où et quand), la découverte dans l’hippocampe d’un corrélat de position pose question. Comment un codage a priori purement spatial peut-il être compatible avec le rôle de l’hippocampe dans la mémoire épisodique ? O’Keefe fait alors une troisième contribution majeure dans la description du système hippocampique. Il décrit l’existence d’un codage temporel au sein de l’hippocampe, appelé précession de phase [6]. L’activité d’une cellule hippocampique est en relation avec l’activité globale de l’hippocampe mesurable sous forme d’une oscillation rythmique et sinusoïdale de fréquence comprise entre 6 et 12 Hz. Cette oscillation, appelée rythme thêta, est observée lorsque l’animal explore librement l’arène [7]. Ce rythme représente l’activité d’une large population de neurones hippocampiques synchronisés par l’activité des interneurones inhibiteurs. Chaque cellule de lieu décharge légèrement plus rapidement que la fréquence du rythme théta. Ainsi, lorsque qu’un rat ou une souris traverse physiquement le champ d’activité d’une cellule de lieu, celle-ci va décharger à chaque traversée dans des phases de plus en plus précoces au sein de thêta. C’est ce phénomène de décalage temporel qui est appelé précession de phase. Il révèle une activité séquentielle des neurones hippocampiques et donne ainsi une indication sur la trajectoire, le chemin emprunté par l’animal. Depuis ces résultats, plusieurs travaux de recherche suggèrent que la computation hippocampique sous-tend non seulement un codage rétrospectif (le souvenir d’un évènement), mais également un codage prospectif, c’est-à-dire la prédiction mentale de l’événement à venir. Cependant, un autre débat anime la communauté « mémoire » ; à la théorie de la carte cognitive s’opposent d’autres théories, en particulier la théorie de la mémoire relationnelle portée par Howard Eichenbaum. L’hippocampe ne serait pas seulement une structure qui code pour l’espace, mais un espace de mémoire [8, 9], en particulier de la mémoire épisodique. Ainsi, il a récemment été montré que certains neurones de l’hippocampe possèdent également des propriétés temporelles qui en font des « cellules de temps ». Celles-ci vont être actives dans leur champ de lieu, mais cette activité est également modulée par la durée passée dans un endroit particulier ou la distance parcourue [10, 11]. Une même cellule de lieu peut également s’activer dans un même environnement, soit en fonction de la position de l’animal dans l’environnement, soit en fonction de sa position dans une séquence de mouvement qu’il est en train de réaliser [12]. Ces différentes propriétés font ainsi des cellules de l’hippocampe un élément clé du codage de l’espace, du souvenir et même du temps. |
Les cellules de grille : un système métrique extra-hippocampique Après la découverte des différentes propriétés des cellules de lieu, une question demeurait. Comment le signal de ces cellules du CA1 de l’hippocampe était-il généré ? S’agissait-il d’un signal intrinsèque ou au contraire d’un signal dépendant des voies afférentes à l’hippocampe ? Le champ CA1 de l’hippocampe reçoit des informations intra-hippocampiques via le CA3 mais aussi extra-hippocampiques via le cortex entorhinal. May-Britt et Edvard Moser décident d’étudier des rats chez lesquels le CA1, isolé du CA3, ne reçoit que les afférences entorhinales. Ils constatent alors que le codage spatial est conservé. Le signal spatial n’est donc pas intrinsèque à l’hippocampe mais dépend de la voie d’entrée directe du cortex entorhinal sur le champ CA1 de l’hippocampe [13]. Les travaux du couple Moser se focalisent alors sur la recherche d’une activité dépendante de l’espace dans le cortex entorhinal : existe-t-il un code spatial dans cette structure qui permette de générer la carte hippocampique ? Ils découvrent ainsi des neurones du cortex entorhinal médian1 dont l’activité corrèle avec la position de l’animal dans l’espace [14]. Toutefois, ces cellules ont une activité particulière puisqu’elles présentent plusieurs champs de lieu, qui ne se recouvrent pas et forment un motif hexagonal répétitif en forme de « grille » [15]. L’activité de ces « cellules de grille » est caractérisée par plusieurs paramètres : la taille des champs de lieu situés à chaque sommet du motif hexagonal, leur espacement, l’orientation de la grille (relativement à un axe de référence) et la phase spatiale de la grille (la position des motifs par rapport à ceux des cellules voisines). Des cellules de grille voisines ont une orientation et un espacement similaires, mais leurs phases spatiales sont distribuées de sorte qu’un nombre limité de cellules de grille permettent de couvrir l’environnement entier. De plus, ces cellules déchargent à intervalles réguliers et au-delà de l’environnement déjà exploré. Il s’agit donc d’un codage global de l’espace qui contraste avec la décharge locale de la cellule de lieu [14, 15]. Lorsqu’une cellule de grille est enregistrée dans différents environnements, elle maintient la taille et l’espacement du champ, mais l’orientation et la phase de la grille sont modifiées [16]. Cette modification affecte toutes les cellules de grille d’une manière cohérente. Ce phénomène, appelé le « réalignement de grille », indique que, dans le cortex entorhinal médian, la carte des cellules de grille s’adapte aux changements de l’environnement, mais sans perdre sa structure spatiale intrinsèque. D’autres types de cellules ont ensuite été décrits dans le cortex entorhinal médian, en particulier des cellules de direction de la tête, décrites précédemment dans le subiculum2 par Jim Ranck (voir revue dans [17]), et dont l’activité dépend de la direction de la tête de l’animal, et des cellules de bordure, qui s’activent à proximité des bordures de l’endroit exploré par l’animal [18, 19]. On suppose que ces cellules sont capables d’intégrer l’information de position et de direction lorsque l’animal se déplace, afin de mettre à jour la représentation de sa position [20]. La question qui vient naturellement à la suite de ces différentes découvertes concerne l’importance (relative) de chacun des signaux (de grille, de bordure et de direction de la tête) issus du cortex entorhinal dans la genèse de l’activité des cellules de lieu hippocampiques. La question est encore débattue [21], mais des éléments de réponse ont été apportés par des études menées parallèlement par les groupes de Moser et O’Keefe au cours du développement postnatal. À 16 jours chez le rat, alors que l’activité des cellules de lieu est déjà spatialement informative, les cellules de bordure comme les cellules de direction de la tête ont déjà des signaux particulièrement matures [22–24]. Ces signaux provenant du cortex entorhinal semblent donc importants pour la formation de l’activité spatiale des cellules de lieu. Au même âge, en revanche, les cellules de grille expriment une très faible périodicité spatiale, ce qui suggère, avec d’autres expériences, que le signal des cellules de grilles n’est pas nécessaire à l’activité spatiale hippocampique [25]. Des travaux des Moser suggèrent même une dépendance inverse : l’inactivation de l’hippocampe fait perdre la périodicité de leur activité aux cellules de grille et les transforme en cellules de direction de la tête [26]. Ainsi, le codage de l’espace n’est pas un processus hiérarchique aboutissant à l’hippocampe, mais repose sur des relations réciproques entre l’hippocampe et le cortex entorhinal. En conclusion, un ensemble de propriétés physiologiques sous-tendant la mémoire spatiale et la navigation ont été découvertes : Tolman nous a proposé un cadre de travail, John O’Keefe, Edvard Moser et May-Britt Moser ont découvert des cellules qui sont des éléments clefs supports des opérations mentales associées à la notion de carte cognitive. Ensemble, ces différents types de cellules forment un système de cartographie interne qui permet à un navigateur de se déplacer de manière flexible dans un environnement, autrement dit d’adapter sa navigation à son environnement. La compréhension des différents codages neuronaux, de la découverte des cellules de lieu à celle des cellules de grille, de la cellule unique à la population neuronale, démontre l’existence d’une dynamique d’activité et d’oscillations qui contribuent non pas à une carte au sens euclidien du terme, mais bel et bien à une représentation mentale de l’environnement qui nous entoure et de nos déplacements au sein de cet environnement. |
Et maintenant ? Au-delà de ces découvertes Les enregistrements électrophysiologiques chez l’animal libre de ses mouvements et la manipulation des conditions environnementales ont permis de corréler l’activité de différents types de neurones à différents paramètres comportementaux tels que la localisation de l’animal, son orientation ou la séquence de ses mouvements, afin d’inférer le type d’informations reçues et codées par ces neurones. À l’heure actuelle, il est possible d’effectuer des enregistrements simultanés dans plusieurs régions, tout en inactivant des structures connectées à celles enregistrées afin de mieux déchiffrer le flux d’informations au sein des réseaux cérébraux (Figure 2).
 | Figure 2.
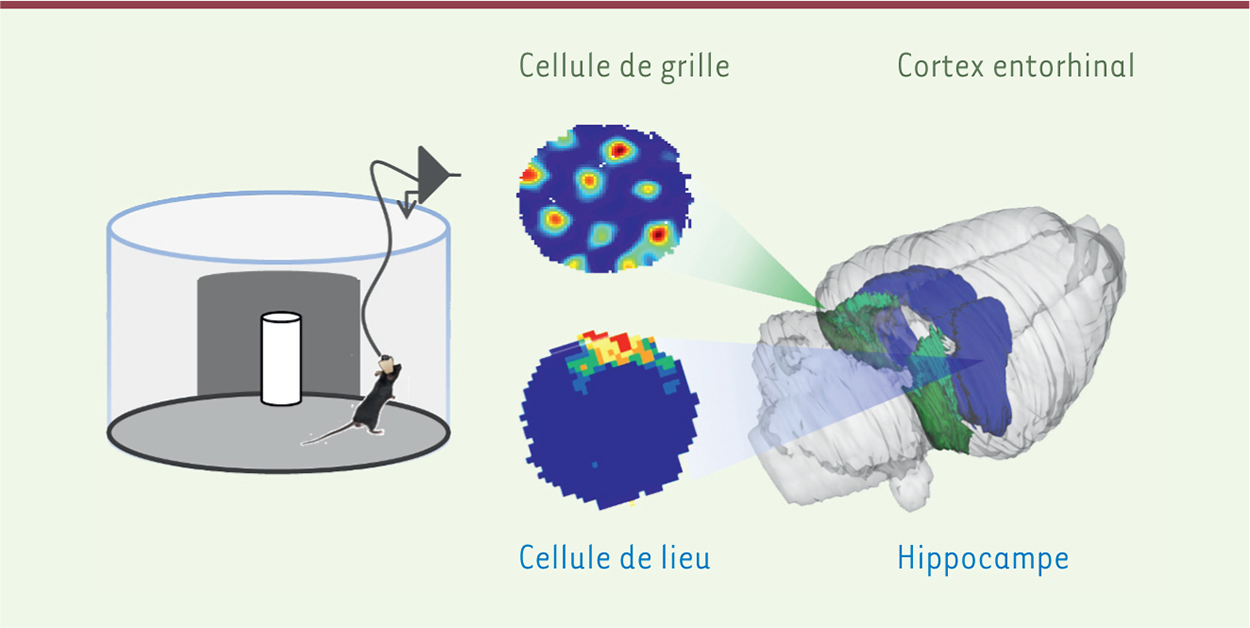
Enregistrement de cellules de lieu ou de grille chez un animal libre de ses mouvements. Le rongeur est traditionnellement placé dans une arène circulaire ou carrée qu’il est libre d’explorer (à gauche). L’activité des cellules de lieu ou des cellules de grille est enregistrée grâce à un système de tétrodes implantées à long terme au niveau de l’hippocampe (bleu) ou du cortex entorhinal (vert). Une cellule de lieu (en bas) a un champ d’activité localisé spatialement dans l’arène alors qu’une cellule de grille (en haut) a un champ d’activité régulièrement réparti selon un schéma hexagonal, dans l’ensemble de l’arène. Exemple de cellule de lieu provenant de [ 33] ; exemple de cellule de grille provenant de la thèse de P.Y. Jacob, 2013 [ 34] (avec la permission de P.Y. Jacob – enregistrement chez le rat). |
Plusieurs questions demeurent cependant. Les substrats neuronaux de la représentation spatiale découverts chez les rongeurs et présents dans de nombreuses espèces comme le singe ou la chauve-souris existent-t-il également chez l’homme ? Quelques données encore éparses suggèrent l’existence de cellules de lieu et de grille chez l’humain [27–29]. La convergence des tests comportementaux entre humains et animaux, par exemple via l’utilisation de la réalité virtuelle, laisse envisager le développement d’outils permettant d’évaluer des fonctions cognitives similaires dans différentes espèces. Des dispositifs de réalité virtuelle permettent aujourd’hui de simuler des tâches de navigation en découplant les différentes informations sensorielles. En faisant tourner une boule avec ses pattes, l’animal peut modifier son environnement visuel tout en conservant sa tête immobile, supprimant ainsi les informations vestibulaires issues de l’oreille interne. Deux études ont ainsi démontré que les signaux non vestibulaires liés au mouvement propre (proprioceptif ou tactile) contribuent à l’activité des cellules de lieu au même titre que les signaux vestibulaires [30, 31]. Où et comment sont combinées, filtrées ou prédites ces différentes informations sensorielles (visuelles, tactiles, olfactives, vestibulaires, proprioceptives, etc.) influençant le code spatial, et quelles sont les autres structures participant au codage de l’espace ? Le cervelet, une structure anatomiquement câblée pour réaliser une prédiction sensorielle, pourrait jouer un rôle déterminant dans ces processus et dans le codage d’un signal de nouveauté [32]. En effet, une altération à l’échelle synaptique du cervelet altère le code spatial de l’hippocampe [33]. Pour répondre à ces questions, Il est nécessaire de mieux appréhender l’activité du substrat neuronal à différentes échelles : de la cellule unique à la population de neurones ; jusqu’à l’activité des structures cérébrales grâce par exemple aux techniques d’imagerie et d’analyse en connectivité fonctionnelle ; de l’animal à l’homme, en développant les outils permettant d’étudier finement le comportement et d’évaluer les fonctions cognitives à travers différentes espèces. La convergence du développement de nouveaux outils et de la créativité scientifique aussi bien que technologique sans cesse renouvelée des chercheurs, ingénieurs, médecins a pour but d’éclairer les fonctions de notre cerveau jusqu’à la transparence. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
|

John O’Keefe est directeur du département de neurosciences cognitives et directeur du Sainsbury Wellcome Centre for Neural Circuits and Behaviour à l’University College London (UCL) à Londres. Né en 1939 aux États-Unis, il a obtenu son doctorat en 1967 sur la description de l’activité des neurones de l’amygdale chez le chat, au sein du département dirigé par Donald Hebb à l’université de McGill au Canada. Il rejoint UCL en 1967 pour un post-doctorat et obtient le titre de Professeur en 1987. Il a obtenu de nombreux prix dont le Prix Louisa Gross Horwitz (2013) avec May-Britt et Edvard Moser, et le prix Norvégien Kavli (2014). Il est membre de la Société Royale et de l’Académie des sciences médicales au Royaume Uni.

May-Britt et Edvard Moser sont tous deux cofondateurs et directeurs de l’institut Kavli (Neuroscience System) et du centre de biologie de la mémoire au sein de NTNU (Norwegian University of Science and Technology) à Trondheim. Lui est actuellement chercheur en visite au Max Plank Institute de neurobiologie à Munich. Nés en Norvège, Edvard en 1962 et May-Britt en 1963, ils obtiennent chacun leur doctorat en neurophysiologie en 1995. Ils réalisent un postdoctorat au sein du laboratoire de Richard Morris à Edimbourg et visitent à la même période le laboratoire de John O’Keefe à Londres. Ils retournent tous deux en Norvège en 1996, en tant que Professeurs à NTNU. Ils ont obtenu ensemble de nombreux prix : le prix de médecine Louis Jeantet (2011), le prix Louisa Gross Horwitz (2013), le prix européen Körber (2014), et le prix Karl Spencer Lashley (2014). Ils sont tous deux membres de la société Royale des sciences et des lettres de Norvège, de l’Académie norvégienne des sciences et des lettres et de l’Académie norvégienne des sciences technologiques.
|
|
Footnotes |
1.
Tolman EC. Cognitive maps in rats and men . Psychol Rev. 1948; ; 55 : :189.–208. 2.
Tolman EC, Honzik CH. Introduction and removal of reward, and maze performance in rats . Univ Calif Publ Psychol. 1930; ; 4 : :257.–275. 3.
O’Keefe J. Place units in the hippocampus of the freely moving rat . Exp Neurol. 1976; ; 51 : :78.–109. 4.
J. O’Keefe DHC, O’Keefe J, Conway DH. Hippocampal place units in the freely moving rat: why they fire where they fire . Exp Brain Res. 1978; ; 31 : :573.–590. 5.
Quirk GJ, Muller RU, Kubie JL. The firing of hippocampal place cells in the dark depends on the rat’s recent experience . J Neurophysiol. 1990; ; 10 : :2008.–2017. 6.
O’Keefe J, Recce ML. Phase relationship between hippocampal place units and the EEG theta rhythm . Hippocampus. 1993; ; 3 : :317.–330. 7.
Vanderwolf CH. Hippocampal electrical activity and voluntary movement in the rat . Electroencephalogr Clin Neurophysiol. 1969; ; 26 : :407.–418. 8.
Eichenbaum H, Dudchenko P, Wood E, et al. The hippocampus, memory, and place cells: is it spatial memory or a memory space? Neuron. 1999; ; 23 : :209.–226. 9.
O’Keefe J.. Do hippocampal pyramidal cells signal non-spatial as well as spatial information? Hippocampus. 1999; ; 9 : :352.–364. 10.
MacDonald CJ, Lepage KQ, Eden UT, et al. Hippocampal time cells bridge the gap in memory for discontiguous events . Neuron. 2011; ; 71 : :737.–749. 11.
Kraus B, Robinson R, White J, et al. Hippocampal time cells: time versus path Integration . Neuron. 2013; ; 78 : :1090.–1101. 12.
Cabral HO, Vinck M, Fouquet C, et al. Oscillatory dynamics and place field maps reflect hippocampal ensemble processing of sequence and place memory under NMDA receptor control . Neuron. 2014; ; 81 : :402.–415. 13.
Brun VH, Otnass MK, Molden S, et al. Place cells and place recognition maintained by direct entorhinal-hippocampal circuitry . Science. 2002; ; 296 : :2243.–2246. 14.
Fyhn M, Molden S, Witter MP, et al. Spatial representation in the entorhinal cortex . Science. 2004; ; 305 : :1258.–1264. 15.
Hafting T, Fyhn M, Molden S, et al. Microstructure of a spatial map in the entorhinal cortex . Nature. 2005; ; 436 : :801.–806. 16.
Fyhn M, Hafting T, Treves A, et al. Hippocampal remapping and grid realignment in entorhinal cortex . Nature. 2007; ; 446 : :190.–194. 17.
Muller RU, Ranck JB, Taube JS. Head direction cells: properties and functional significance . Curr Opin Neurobiol. 1996; ; 6 : :196.–206. 18.
Solstad T, Boccara CN, Kropff E, et al. Representation of geometric borders in the entorhinal cortex . Science. 2008; ; 322 : :1865.–1868. 19.
Savelli F, Yoganarasimha D, Knierim JJ. Influence of boundary removal on the spatial representations of the medial entorhinal cortex . Hippocampus. 2008; ; 18 : :1270.–1282. 20.
Sargolini F, Fyhn M, Hafting T, et al. Conjunctive representation of position, direction, and velocity in entorhinal cortex . Science. 2006; ; 312 : :758.–762. 21.
Sasaki T, Leutgeb S LJ. Spatial and memory circuits in the medial entorhinal cortex . Curr Opin Neurobiol. 2014;; 32C : :16.–23. 22.
Langston RF, Ainge JA, Couey JJ, et al. Development of the spatial representation system in the rat . Science. 2010; ; 328 : :1576.–1580. 23.
Wills TJ, Cacucci F, Burgess N, et al. Development of the hippocampal cognitive map in preweanling rats . Science. 2010; ; 328 : :1573.–1576. 24.
Bjerknes TL, Moser EI, Moser MB. Representation of geometric borders in the developing rat . Neuron. 2014; ; 82 : :71.–78. 25.
Brandon M, Koenig J, Leutgeb J, et al. New and distinct hippocampal place codes are generated in a new environment during septal inactivation . Neuron. 2014; ; 82 : :789.–796. 26.
Bonnevie T, Dunn B, Fyhn M, et al. Grid cells require excitatory drive from the hippocampus . Nat Neurosci. 2013; ; 16 : :309.–317. 27.
Ekstrom AD, Kahana MJ, Caplan JB, et al. Cellular networks underlying human spatial navigation . Nature. 2003; ; 425 : :184.–188. 28.
Doeller CF, Barry C, Burgess N. Evidence for grid cells in a human memory network . Nature. 2010; ; 463 : :657.–661. 29.
Jacobs J, Weidemann CT, Miller JF, et al. Direct recordings of grid-like neuronal activity in human spatial navigation . Nat Neurosci. 2013; ; 16 : :1188.–1190. 30.
Chen G, King JA, Burgess N, O’Keefe J. How vision and movement combine in the hippocampal place code . Proc Natl Acad Sci USA. 2013; ; 110 : :378.–383. 31.
Ravassard P, Kees A, Willers B, et al. Multisensory control of hippocampal spatiotemporal selectivity . Science. 2013; ; 340 : :1342.–1346. 32.
Rondi-Reig L, Paradis AL, Lefort JM, et al. How the cerebellum may monitor sensory information for spatial representation . Front Syst Neurosci. 2014; ; 8 : :205.. 33.
Rochefort C, Arabo A, Andre M, et al. Cerebellum shapes hippocampal spatial code . Science. 2011; ; 334 : :385.–389. 34.
Jacob PY. Rôle du cortex entorhinal médian dans le traitement des informations spatiales : études comportementales et électrophysiologiques . Université Aix-Marseille; , Thèse, 2014. |