| |
| Med Sci (Paris). 2015 March; 31(3): 244–247. Published online 2015 April 8. doi: 10.1051/medsci/20153103006.Un nouvel interrupteur oncogénique dans la progression du cancer de la prostate L’« exceptionnel » ORAI3 Charlotte Dubois,1* Fabien Vanden Abeele,1 and Natalia Prevarskaya1 1Inserm U1003, laboratoire d’excellence, canaux ioniques d’intérêt thérapeutique, équipe labellisée par la Ligue nationale contre le cancer, SIRIC ONCOLille, université des sciences et technologies de Lille, rue Paul Langevin, 59656Villeneuve d’Ascq Cedex, France MeSH keywords: Canaux calciques, Transformation cellulaire néoplasique, Évolution de la maladie, Gènes switch, Humains, Mâle, Thérapie moléculaire ciblée, Tumeurs de la prostate, génétique, physiologie, thérapie |
Le cancer est sans aucun doute l’un des systèmes biologiques les plus complexes. Ces dernières années, les scientifiques ont découvert une multitude de facteurs et de voies de signalisation qui leur sont associées, qui agissent de concert afin de permettre la croissance tumorale et de faire échouer les nombreuses thérapies. Certaines caractéristiques du cancer sont évidentes, mais beaucoup d’autres sont plus subtiles et très difficiles à identifier. L’enjeu sous-jacent est d’identifier de nouvelles cibles thérapeutiques spécifiques. |
Les perturbations de l’homéostasie calcique au cours de la progression tumorale : rôle des canaux calciques Les canaux calciques sont peu à peu apparus comme des acteurs cruciaux de la progression tumorale, même si la perspective d’en faire des cibles thérapeutiques spécifiques dans la guerre contre le cancer était sujette à débat. En effet, le calcium est un second messager intracellulaire ubiquitaire impliqué dans des processus tels que la prolifération, l’apoptose, la sécrétion ou encore la migration cellulaires [1]. Les canaux calciques de la membrane plasmique contrôlent ces processus grâce à la régulation des échanges d’ions calcium entre le milieu extracellulaire et le cytosol où de nombreux effecteurs dépendants du calcium sont présents. Plusieurs études ont montré l’existence de différents types de perturbations pouvant affecter au final le rôle physiologique des canaux ioniques (Figure 1). Ainsi, depuis une quinzaine d’années, des chercheurs ont tenté d’identifier les acteurs moléculaires qui permettent au calcium de participer à la progression tumorale. Comme c’est le cas dans les cellules normales, dans les cellules tumorales aussi les processus cellulaires régulés par le calcium sont soumis à une régulation très fine, orchestrée par différents canaux et pompes calciques. De façon tout à fait intéressante, quelques canaux ioniques ont une distribution tissulaire très spécifique, et l’altération de leur expression est notamment une caractéristique de certains cancers [2].
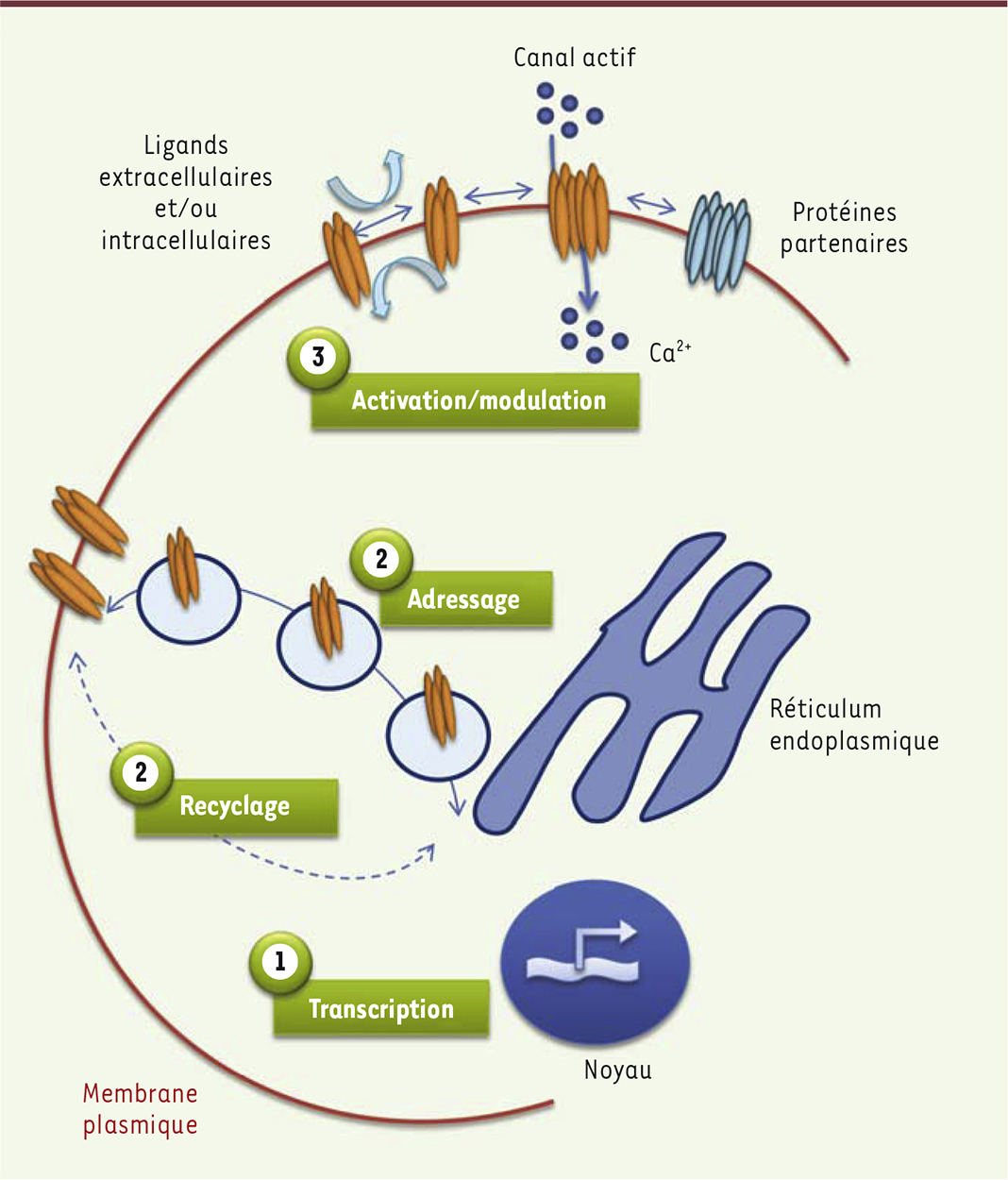
 | Figure 1.
Principales étapes pouvant être impliquées dans la perturbation du fonctionnement des canaux ioniques membranaires. Les canaux ioniques sont présents dans les membranes biologiques et notamment au niveau de la membrane plasmique des cellules. Ils jouent à ce niveau un rôle central dans la physiologie des cellules excitables et non excitables. Le fonctionnement normal de ces canaux peut être perturbé et ces perturbations sont à l’origine de nombreuses pathologies. On rencontre notamment des mutations dont certaines altèrent le fonctionnement des canaux. Ces mutations sont à l’origine de pathologies comme la mucoviscidose. D’autres perturbations, qui n’impliquent pas forcément une mutation du gène codant pour le canal, peuvent être à l’origine de troubles physiologiques. Ces perturbations affectent par exemple la transcription avec des modifications épigénétiques, le recyclage, l’adressage, l’activation ou la modulation des canaux. Ces perturbations sont par exemple extrêmement fréquentes au cours de la cancérogenèse. |
|
Rôles des protéines ORAI et STIM dans la progression tumorale Dans une étude récente [3], nous révélons un nouveau niveau de complexité concernant les perturbations de la signalisation calcique observées au cours de la progression du cancer. Le domaine de la signalisation calcique a connu une révolution en 2005 et 2006 avec la découverte des protéines ORAI1 et STIM1, acteurs moléculaires de l’entrée calcique de type SOCE (store operated calcium entry) [4, 5, 12]. Le mécanisme de cet influx calcique a été décrit pour la première fois en 1986 par Putney [6] : l’épuisement des stocks calciques du réticulum endoplasmique de la cellule, qui représentent la majeure partie des stocks calciques intracellulaires, était capable d’activer un influx de calcium à travers la membrane plasmique. Des études ont ensuite montré que les protéines ORAI1 forment le canal permettant l’influx de calcium à travers la membrane plasmique, et que les protéines STIM1 - exprimées au niveau du réticulum endoplasmique (RE) - sont chargées de contrôler la concentration en calcium dans le RE, et permettent d’activer une entrée de type SOCE quand ces stocks sont diminués. Des perturbations de cet influx calcique transitant par ORAI1 ont été associées à différents cancers. Ainsi, dans le cancer du sein, une diminution de l’expression des protéines ORAI1 ou STIM1 par l’intermédiaire d’ARN interférents (ARNi) permet de réduire la capacité d’invasion des cellules cancéreuses in vitro ainsi que le processus de métastases in vivo [7]. Autre exemple, nous avions montré, dès 2002, l’existence d’un phénotype agressif de cancer de la prostate en relation avec une inhibition de l’entrée de calcium par ces canaux SOC [8]. Cependant, à cette époque, les canaux ORAI n’avaient pas été identifiés, ce qui ne nous permettait pas de poursuivre nos investigations. Depuis, nous avons identifié une surexpression du messager codant pour la protéine ORAI3 dans des prélèvements de tumeurs issus de patients, qui n’existe pas dans les tissus sains. Ces résultats allaient à l’encontre de nos premières conclusions. Nous avons alors cherché à comprendre le rôle mystérieux de cette surexpression de l’isoforme ORAI3 dans la cancérogenèse prostatique. |
Rôle du microenvironnement tumoral et des modifications épigénétiques De nombreuses études fonctionnelles de la protéine ORAI3, utilisant la technique de patch-clamp, ont révélé une caractéristique de ce canal qualifiée d’exceptionnelle pour un canal ionique [9]. En effet, les protéines ORAI1 et STIM1 sont les acteurs moléculaires de l’entrée calcique de type SOCE. Cependant, il a été également montré qu’ORAI3, en association avec ORAI1, formait un nouveau canal calcique activé non plus par la diminution de la concentration en calcium dans le RE, mais par l’acide arachidonique (AA). Ces complexes ORAI1/ORAI3 ont été appelés canaux ARC (acide arachidonic regulated channel) [10], mais leur rôle dans la cancérogenèse n’avait jamais été étudié. Or, nous montrons que les cellules cancéreuses prostatiques utilisent l’isoforme ORAI3 pour provoquer des perturbations de l’homéostasie calcique dont la finalité est de permettre l’émergence d’un phénotype agressif caractérisé par une prolifération et une résistance à l’apoptose accrues (Figure 2). Ce nouveau type de switch oncogénique peut être provoqué au cours du cancer par des modifications épigénétiques aboutissant à la surexpression d’ORAI3. En effet, nous avons reproduit in vitro les rapports d’expression des protéines ORAI1 et 3. Plus l’expression d’ORAI3 augmente, plus cela favorise la formation des hétéromères ORAI1/3 au détriment des canaux homomériques ORAI1 qui forment les SOC. Nous montrons que les hétéromères ORAI1/3 stimulent la prolifération via le facteur de transcription NFAT (nuclear factor of activated T cell), alors que les homomères ORAI1 sont impliqués dans l’induction de l’apoptose. De même, il est bien établi que la progression tumorale prostatique s’accompagne d’une perturbation du métabolisme de l’acide arachidonique [11]. Nous avons également reproduit in vitro ces conditions et, de façon surprenante, nous montrons qu’un traitement à court terme par l’acide arachidonique permet un remodelage de l’homéostasie calcique avec, cette fois encore, la formation préférentielle des hétéromères ORAI1/3 au détriment des canaux homomériques ORAI1 formant les SOC. Ces résultats laissent penser qu’il est possible de modifier la proportion des canaux homomériques et hétéromériques en un laps de temps très court, trop court pour impliquer une synthèse de novo de protéines. De nouvelles expérimentations seront nécessaires pour comprendre comment un tel remodelage est possible aussi rapidement.
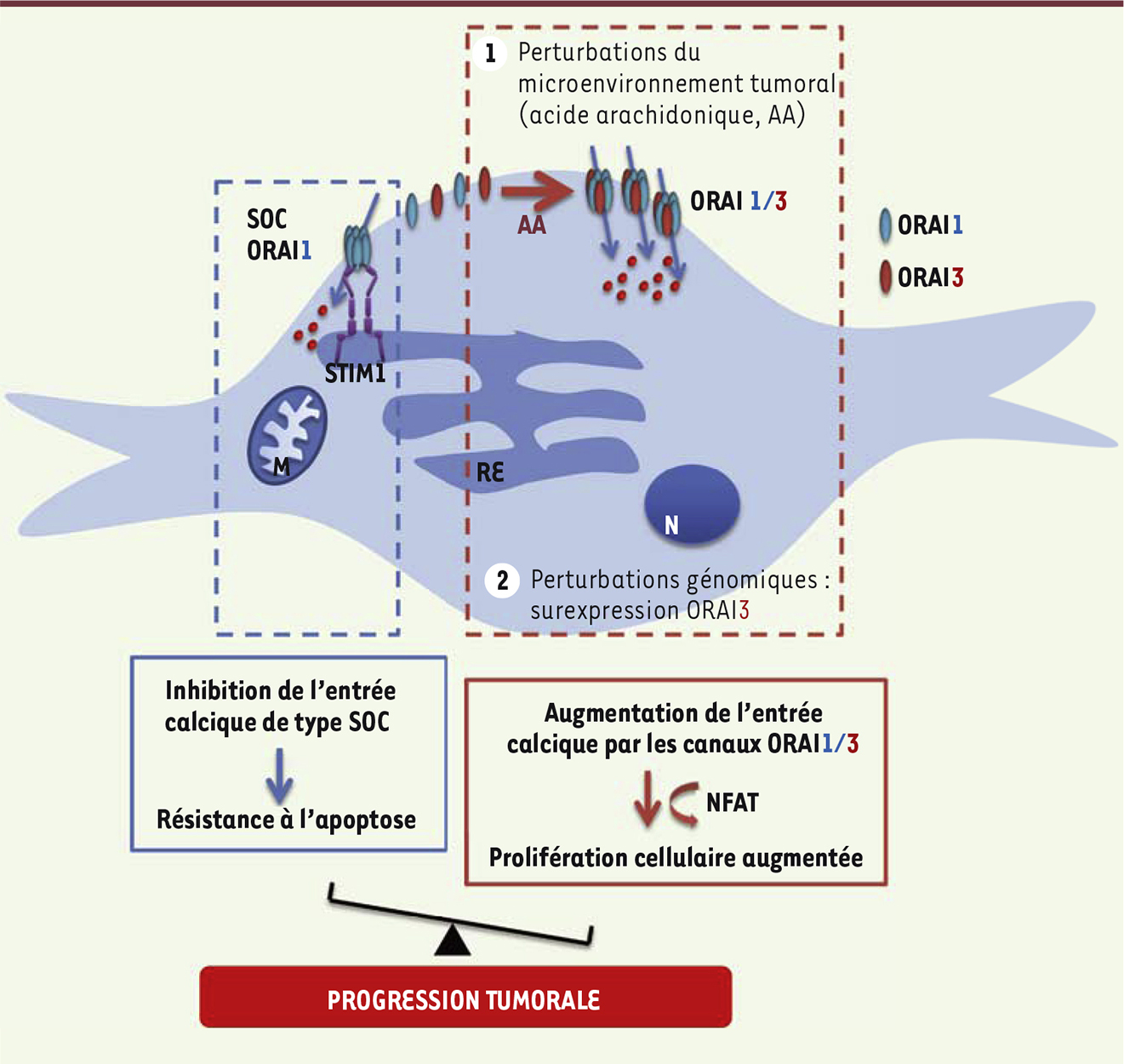
 | Figure 2.
Les perturbations de l’équilibre dynamique des canaux ORAI favorisent l’émergence d’un phénotype cancéreux agressif. Le remodelage génomique (par surexpression de la protéine ORAI3) et/ou du microenvironnement tumoral (via des perturbations du métabolisme de l’acide arachidonique), conduisent à une augmentation de la formation des canaux ORAI1/ORAI3 qui participent à l’activation de la prolifération cellulaire via une voie faisant intervenir NFAT. Cette formation de canaux ORAI1/ORAI3 défavorise celle de canaux homomériques ORAI1 responsables de l’entrée calcique de type SOCE (store operated calcium entry) et impliqués dans l’induction de la mort cellulaire. ORAI3 représente un interrupteur oncogénique qui peut de ce fait être considéré comme une nouvelle cible thérapeutique du traitement du cancer de la prostate. M : mitochondrie, N : noyau, RE : réticulum endoplasmique. |
|
ORAI3, une cible thérapeutique potentielle ? Nous avons évalué l’utilisation de la protéine ORAI3 en tant que cible thérapeutique potentielle in vivo dans des xénogreffes de tumeurs chez la souris. Ainsi, la diminution de son expression par l’utilisation d’ARNi entraîne une réduction de la croissance tumorale, alors que l’injection de cellules cancéreuses surexprimant ORAI3 conduit à une accélération de la croissance tumorale. Cette étude démontre donc le rôle d’interrupteur oncogénique que peut jouer la signalisation calcique, mais elle soulève d’autres questions. Existe-t-il d’autres facteurs de l’environnement tumoral pouvant provoquer un tel changement oncogénique ? Existe-t-il d’autres canaux ioniques pouvant contribuer à favoriser un influx calcique de type pro-apoptotique mais aussi prolifératif ? Peut-on retrouver ce mécanisme moléculaire dans d’autres types de cancers ? D’un point de vue thérapeutique, peut-on imaginer des inhibiteurs pharmacologiques ou des thérapies immunologiques ciblant sélectivement les protéines de la famille ORAI, afin d’inhiber spécifiquement la formation des canaux ORAI1/ORAI3 et favoriser celle des canaux pro-apoptotiques ORAI1 ? |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation . Cell. 2011; ; 144 : :646.–674. 2.
Monteith GR, Davis FM, Roberts-Thomson SJ. Calcium channels and pumps in cancer: changes and consequences . J Biol Chem. 2012; ; 287 : :31666.–31673. 3.
Dubois C, Vanden Abeele F, Lehen’kyi V, et al. Remodeling of channel-forming ORAI proteins determines an oncogenic switch in prostate cancer . Cancer Cell. 2014; ; 26 : :19.–32. 4.
Roos J, DiGregorio PJ, Yeromin AV, et al. STIM1, an essential and conserved component of store-operated Ca2+ channel function . J Cell Biol. 2005; ; 169 : :435.–445. 5.
Feske S, Gwack Y, Prakriya M, et al. A mutation in Orai1 causes immune deficiency by abrogating CRAC channel function . Nature. 2006; ; 441 : :179.–185. 6.
Putney JW. A model for receptor-regulated calcium entry . Cell Calcium. 1986; ; 7 : :1.–12. 7.
Yang S, Zhang JJ, Huang XY. Orai1 and STIM1 are critical for breast tumor cell migration and metastasis . Cancer Cell. 2009; ; 15 : :124.–134. 8.
Vanden Abeele F, Skryma R, Shuba Y, et al. Bcl-2-dependent modulation of Ca2+ homeostasis and store-operated channels in prostate cancer cells . Cancer Cell. 2002;; 1 : :169.–179. 9.
Shuttleworth TJ. Orai3: the exceptional Orai? . J Physiol. 2012; ; 590 : :241.–257. 10.
Mignen O, Thompson JL, Shuttleworth TJ. Both Orai1 and Orai3 are essential components of the arachidonate-regulated Ca2+-selective (ARC) channels . J Physiol. 2008; ; 586 : :185.–195. 11.
Nakanishi M, Rosenberg DW. Roles of cPLA2alpha and arachidonic acid in cancer . Biochim Biophys Acta. 2006; ; 1761 : :1335.–1343. 12.
Le Deist F, Capiod T. Immunodéficiences et pathologies associées aux mutations dans STIM/ORAI . Med Sci (Paris). 2011; ; 27 : :737.–745. |