| |
| Med Sci (Paris). 2015 May; 31(5): 473–475. Published online 2015 June 9. doi: 10.1051/medsci/20153105004.Rôle du VEGF dans l’épuisement des lymphocytes T intratumoraux Thibault Voron,1** Éric Tartour,1,2 Julien Taieb,1,3 and Magali Terme1* 1Inserm U970, PARCC (Paris cardiovascular research center), Université Paris-Descartes, Sorbonne Paris Cité, 56, rue Leblanc, 75015Paris, France 2Service d’immunologie biologique, hôpital européen Georges Pompidou, AP-HP, 20, rue Leblanc, 75015Paris, France 3Service d’hépatogastroentérologie et d’oncologie digestive, hôpital européen Georges Pompidou, AP-HP, 20, rue Leblanc, 75015Paris, France MeSH keywords: Antinéoplasiques, Protocoles de polychimiothérapie antinéoplasique, Lymphocytes T CD8+, Régulation de l'expression des gènes tumoraux, Humains, Indoles, Lymphocytes TIL, Thérapie moléculaire ciblée, Protéines tumorales, Tumeurs expérimentales, Récepteur-1 de mort cellulaire programmée, Pyrroles, Récepteurs aux facteurs de croissance endothéliale vasculaire, Lymphocytes T cytotoxiques, Facteur de croissance endothéliale vasculaire de type A, pharmacologie, usage thérapeutique, effets des médicaments et substances chimiques, immunologie, métabolisme, antagonistes et inhibiteurs, biosynthèse, génétique, traitement médicamenteux, physiologie |
La reconnaissance des cellules tumorales par le système immunitaire et la capacité de ce dernier à réprimer le développement des tumeurs ont été évoquées il y a plus d’un siècle par Paul Erhlich (1909), puis reformulées en 1957 par Sir Macfarlane Burnet et Lewis Thomas sous le concept d’immunosurveillance antitumorale. Il a toutefois fallu attendre la fin des années 1990, et l’amélioration des modèles précliniques immunodéficients, pour que certaines équipes réexplorent l’influence du système immunitaire dans le contrôle du cancer et valident ce concept d’immuno-surveillance. Ce concept est, à l’heure actuelle, à la base des études d’immunologie antitumorale. Cependant, les cellules tumorales acquièrent progressivement des propriétés leur permettant d’échapper à la surveillance continue du système immunitaire. Parmi ces propriétés, la capacité à induire un microenvironnement immuno-suppresseur1 favorisant l’accumulation de cellules immunorégulatrices, telles que les lymphocytes T régulateurs (Treg) et les cellules myéloïdes suppressives (MDSC) [1], ainsi que l’inhibition des fonctions des lymphocytes T CD8+ (LT CD8+) effecteurs [2]. Cette perte de fonction, appelée « épuisement » (exhaustion), est associée à l’expression de molécules de costimulation inhibitrices telles que program cell death-1 (PD-1), T-cell immunoglobulin and mucin 3 domain (TIM-3), cytotoxic T lymphocyte antigen (CTLA-4) ou lymphocyte activation gene 3 (LAG-3). La liaison de ces molécules à leurs ligands (présents dans le microenvironnement tumoral) aboutit à une perte graduelle des fonctions des LT CD8+ infiltrant les tumeurs (prolifération, production de cytokines, cytotoxicité). Au sein de ce microenvironnement tumoral, le vascular endothelial growth factor (VEGF)-A a longtemps été étudié pour ses propriétés proangiogéniques, c’est-à-dire favorisant le développement de vaisseaux sanguins au niveau de la tumeur. Des traitements antiangiogéniques, ciblant, entre autres, le VEGF ou ses récepteurs, ont été développés (tels que le bevacizumab, un anticorps monoclonal anti-VEGF) et sont actuellement utilisés en clinique. Cependant, le VEGF-A possède également des propriétés immunomodulatrices favorisant l’échappement des cellules tumorales à la surveillance par le système immunitaire (induction de Treg et cellules myéloïdes suppressives) [3]. |
Le blocage de la voie VEGF-A/VEGF-R est suffisant pour diminuer l’expression de PD-1 à la surface des lymphocytes T CD8 + infiltrant la tumeur Plusieurs études laissaient supposer un rôle de la voie VEGF-A/VEGFR dans l’épuisement des LT CD8+ infiltrant la tumeur et dans l’expression, à leur surface, de molécules de costimulation inhibitrices telles que PD-1. D’une part, Ozao-Choy et al. avaient montré que l’administration de sunitinib (inhibiteur de tyrosine kinase multicible bloquant VEGF-R1, -R2, -R3, PDGFRa [platelet-derived growth factor receptor], PDGFRb, FLT3 et c-kit [deux récepteurs de facteurs de croissance, FLT3L et le stem cell factor, respectivement]) à des souris porteuses de tumeurs limitait l’expression de l’ARNm codant pour PD-1 au niveau des lymphocytes infiltrant les tumeurs [4]. D’autre part, des études in vitro avaient révélé que le VEGF pouvait diminuer la fonctionnalité de lymphocytes T humains (prolifération) [5, 6]. Nous avons donc émis l’hypothèse que la voie VEGF-A/VEGFR pouvait être impliquée dans l’épuisement des LT CD8+ intratumoraux. Afin d’analyser l’effet du blocage de la voie VEGF-A/VEGFR sur l’épuisement des LT CD8+, nous nous sommes tout d’abord intéressés à l’impact de différents antiangiogéniques, ciblant la voie VEGF-A/VEGFR (sunitinib ou anti-VEGF-A murin) ou non (masitinib), sur l’expression de PD-1 à la surface des LT CD8+ infiltrant une tumeur colique CT26 greffée par voie sous-cutanée et produisant de fortes quantités de VEGF-A. Nous avons ainsi observé que seuls les traitements antiangiogéniques bloquant cette voie VEGF-A/VEGFR induisaient une diminution de l’expression de PD-1 à la surface des LT CD8+ infiltrant la tumeur, contrairement à un traitement par masitinib, alors même que le ralentissement de la croissance tumorale était similaire quel que soit l’antiangiogénique administré [7]. De plus, cette diminution de l’expression de PD-1 sur les LT CD8+ était associée à une restauration de fonction (production d’interféron gamma [IFN]). Enfin, lorsque le traitement par anti-VEGF-A était associé à une élimination des LT CD8+ (par l’utilisation d’un anticorps anti-CD8), l’effet du traitement anti-VEGF-A était moindre. Ces premiers résultats laissaient donc supposer que l’effet antitumoral observé après traitement par anti-VEGF-A n’était pas simplement lié à une activité antiangiogénique, mais également à un effet stimulant sur l’immunité antitumorale, et que le VEGF-A pouvait moduler l’expression de PD-1 à la surface des LT CD8+. |
Le VEGF-A agit directement sur l’expression de PD-1 sur les lymphocytes T CD8 + activés Afin de déterminer si le VEGF-A avait une action directe sur les LT CD8+, nous avons évalué l’expression des récepteurs du VEGF-A (VEGF-R1 et VEGF-R2) sur les LT CD8+in vivo. Nous avons ainsi observé que seuls les LT CD8+ infiltrant les tumeurs exprimaient VEGF-R1 et VEGF-R2, contrairement aux LT CD8+ spléniques de souris naïves ou porteuses de tumeurs. La stimulation, par des doses croissantes d’anticorps anti-CD3, de LT CD8+ purifiés à partir de la rate de souris naïves permettait d’induire l’expression de VEGF-R1 et -R2 à leur surface. Cela suggère que l’expression des récepteurs du VEGF était associée à l’activation des lymphocytes. Dans ces mêmes conditions, l’ajout de VEGF-A permettait d’augmenter l’expression de PD-1 à la surface des LT CD8+. |
Le VEGF-A module le degré d’épuisement des lymphocytes T cytotoxiques infiltrant la tumeur Bien que PD-1 soit la molécule de co-stimulation inhibitrice principalement associée à l’épuisement des lymphocytes T, son expression membranaire peut également refléter une activation transitoire de ces lymphocytes [8]. D’autres molécules de costimulation inhibitrices ont été associées à l’épuisement des lymphocytes, telles que TIM-3, CTLA-4 et LAG-3 [9]. De façon intéressante, nous avons mis en évidence, in vitro, que non seulement le VEGF-A modulait directement l’expression de PD-1 à la surface des LT CD8+ activés, mais qu’il était également responsable d’une augmentation de l’expression d’autres molécules de costimulation inhibitrices (TIM-3, CTLA-4) et d’une augmentation de la densité de ces molécules (TIM-3, CTLA-4 mais aussi LAG-3) [7]. De plus, le VEGF-A favorisait la coexpression simultanée de ces molécules, qui est associée à un degré d’épuisement plus important du lymphocyte [9]. Afin de valider le rôle modulateur de la voie VEGF-A/VEGFR sur l’épuisement des lymphocytes T cytotoxiques, nous avons ensuite évalué l’intérêt d’un traitement par anti-VEGF-A en mesurant l’expression de ces récepteurs associés à l’épuisement des LT CD8+ infiltrant des tumeurs sous-cutanées, mais également hépatiques. L’administration d’un anti-VEGF-A permettait de réduire la proportion de LT CD8+ intratumoraux coexprimant trois ou quatre molécules de costimulation inhibitrices. |
Intérêt d’une combinaison thérapeutique associant un anti-VEGF-A à un anti-PD-1 Avec le développement récent de nouvelles stratégies d’immunothérapies anticancéreuses bloquant les molécules de costimulation inhibitrices (anti-CTLA-4, anti-PD-1) et offrant des réponses objectives prolongées, les stratégies thérapeutiques visant à restaurer une immunité antitumorale efficace semblent prometteuses. Toutefois, ces réponses objectives ne sont pas observées chez tous les patients (31 % de réponses objectives dans le mélanome avec un anti-PD-1 [10] et 11 % avec un anti-CTLA-4 [11, 12]), suggérant que, chez certains patients, cette restauration de l’immunité pourrait être insuffisante. En diminuant la proportion de LT CD8+ épuisés exprimant différentes molécules de costimulation inhibitrices, un traitement par anti-VEGF-A pourrait permettre d’accroître la sensibilisation des tumeurs à des immunomodulateurs tels que l’anti-PD-1. Afin de tester cette hypothèse, nous avons tout d’abord analysé l’effet d’un traitement par anti-PD-1 sur des sarcomes murins produisant du VEGF (MEF [murine embryonic fibroblasts]) ou non (MEF-KO). De façon intéressante, l’effet antitumoral de l’anti-PD1 n’était observé que sur les tumeurs MEF-KO, ce qui suggère que le VEGF-A intratumoral limitait l’action de l’anti-PD-1. De la même manière, le traitement par anti-PD-1 seul paraissait inefficace sur les tumeurs CT26, alors qu’une association anti-PD-1 + anti-VEGF-A avait un effet antitumoral supérieur à celui d’un traitement par anti-VEGF-A seul [7]. |
L’ensemble de ces résultats montrent pour la première fois le rôle clé, et direct, du VEGF-A présent dans le microenvironnement tumoral sur l’épuisement des LT CD8+ intratumoraux (Figure 1), et suggère un effet synergique de l’association d’un anti-VEGF-A à un anti-PD1. Deux essais cliniques associant le bévacizumab (anti-VEGF) à un anti-PD-1 sont en cours pour évaluer l’intérêt d’une telle combinaison dans le cancer du rein métastatique (NCT02348008) et dans le cancer pulmonaire non à petites cellules métastatique (NCT02039674).
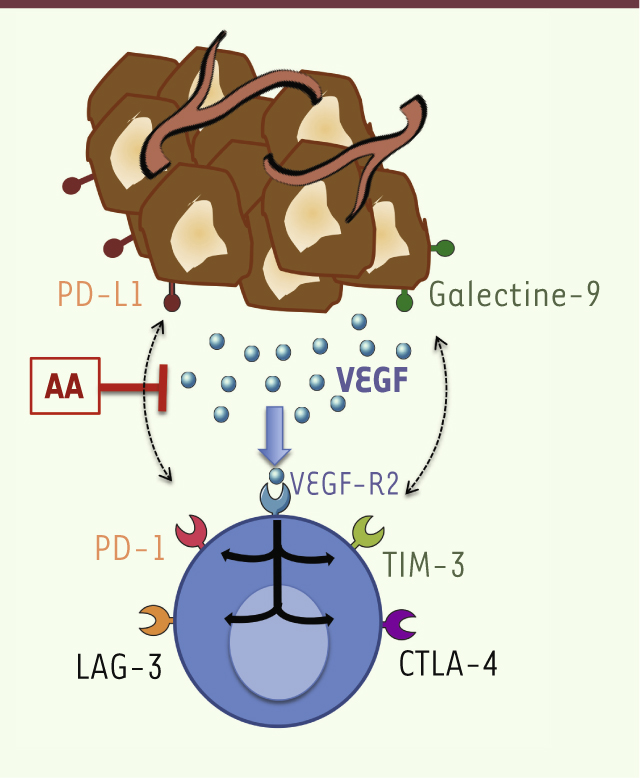
 | Figure 1.
Le VEGF produit par la tumeur est impliqué dans l’épuisement des LT CD8+cytotoxiques. Le VEGF sécrété par la tumeur augmente l’expression des molécules de costimulation inhibitrices (PD-1, TIM-3, CTLA-4, LAG-3) à la surface des LT CD8+ infiltrant la tumeur, via le VEGFR2. Cet effet peut être inhibé par l’utilisation de molécules antiangiogéniques (AA) ciblant la voie VEGF-A/ VEGFR. La liaison de ces molécules de costimulation inhibitrices à leurs ligands, présents dans le microenvironnement tumoral (PD-L1 et galectine-9, les ligands de PD-1 et TIM-3 étant exprimés en partie par les cellules tumorales, les ligands de CTLA-4 et LAG-3 étant exprimés par les cellules présentatrices d’antigène présentes dans le microenvironnement tumoral), induit l’épuisement de ces LT CD8+. |
|
Julien Taieb déclare participer à des activités de conseil et colloques pour l’entreprise Roche.
Thibault Voron, Eric Tartour et Magali Terme déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ces travaux ont été financés et soutenus par Roche, Pfizer, Association pour la recherche contre le cancer, Ligue contre le cancer, et association des gastroentérologues oncologues. Thibault Voron a été financé par l’association Benoit Malassagne, la société française de chirurgie digestive (SFCD), l’assistance publique-hôpitaux de Paris (APHP-FERCM). Magali Terme a été financée par le site de recherche intégré sur le cancer -programme cancer research for personalized medicine (CARPEM), l’association des gastroentérologues oncologues, le labex immunooncology.
|
1.
Bruchard M, Ghiringhelli F. Microenvironnement tumoral : cellules régulatrices et cytokines immunosuppressives . Med Sci (Paris). 2014; ; 30 : :429.–435. 2.
Galon J, Bindea G, Mlecnik B, et al. Microenvironnement immunitaire et cancer : intérêt de l’immunoscore pour prédire l’évolution clinique . Med Sci (Paris). 2014; ; 30 : :439.–444. 3.
Voron T, Marcheteau E, Pernot S, et al. Control of the immune response by pro-angiogenic factors . Front Oncol. 2014; ; 4 : :70.. 4.
Ozao-Choy J, Ma G, Kao J, et al. The novel role of tyrosine kinase inhibitor in the reversal of immune suppression and modulation of tumor microenvironment for immune-based cancer therapies . Cancer Res. 2009; ; 69 : :2514.–2522. 5.
Gavalas NG, Tsiatas M, Tsitsilonis O, et al. VEGF directly suppresses activation of T cells from ascites secondary to ovarian cancer via VEGF receptor type 2 . Br J Cancer. 2012; ; 107 : :1869.–1875. 6.
Ziogas AC, Gavalas NG, Tsiatas M, et al. VEGF directly suppresses activation of T cells from ovarian cancer patients and healthy individuals via VEGF receptor type 2 . Int J Cancer. 2012; ; 130 : :857.–864. 7.
Voron T, Colussi O, Marcheteau E, et al. VEGF-A modulates expression of inhibitory checkpoints on CD8+ T cells in tumors . J Exp Med. 2015; ; 212 : :139.–148. 8.
Badoual C, Hans S, Merillon N, et al. PD-1-expressing tumor-infiltrating T cells are a favorable prognostic biomarker in HPV-associated head and neck cancer . Cancer Res. 2013; ; 73 : :128.–138. 9.
Blackburn SD, Shin H, Haining WN, et al. Coregulation of CD8+ T cell exhaustion by multiple inhibitory receptors during chronic viral infection . Nat Immunol. 2009; ; 10 : :29.–37. 10.
Topalian SL, Sznol M, McDermott DF, et al. Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab . J Clin Oncol. 2014; ; 32 : :1020.–1030. 11.
Wolchok JD, Neyns B, Linette G, et al. Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomised, double-blind, multicentre, phase 2, dose-ranging study . Lancet Oncol. 2010; ; 11 : :155.–164. 12.
Robert C, Mateus C. Anticorps anti-CTLA-4 : une avancée thérapeutique majeure dans le traitement du mélanome métastatique . Med Sci (Paris). 2011; ; 27 : :850.–858. |