| |
| Med Sci (Paris). 2015 May; 31(5): 484–486. Published online 2015 June 9. doi: 10.1051/medsci/20153105008.Implications cliniques de l’immunosénescence dans les maladies rénales chroniques Jamal Bamoulid,1,2* Clémence Carron,1 Thomas Crépin,1,2 Philippe Saas,1 and Didier Ducloux1,2 1Inserm U1098, EFS B/FC, Université de Franche-Comté, LabEx LipSTIC, FHU INCREASE, 8, rue JFX Girod, F-25020Besançon, France 2CHRU Besançon, néphrologie, F-25030Besançon, France MeSH keywords: Vieillissement, - traduction non trouvée, Humains, Mémoire immunologique, Immunosuppresseurs, Rein, Transplantation rénale, Activation des lymphocytes, Lymphokines, Insuffisance rénale chronique, Sous-populations de lymphocytes T, Lymphocytes T régulateurs, Thymus (glande), Immunologie en transplantation, immunologie, pharmacologie, usage thérapeutique, physiopathologie, sécrétion, anatomopathologie, chirurgie, croissance et développement |
L’insuffisance rénale chronique (IRC) est caractérisée par une perte progressive de la capacité des reins à filtrer le sang avec pour conséquences une accumulation sanguine de toxines urémiques et l’apparition de troubles hydroélectrolytiques. Elle s’accompagne de la perte de certaines fonctions hormonales entraînant l’apparition de troubles phosphocalciques et d’une anémie. Les causes d’insuffisance rénale chronique sont multiples, mais les complications communes : anémie, œdèmes, ostéopathie, augmentation du risque de mortalité, notamment d’origine infectieuse et cardiovasculaire. Au stade d’insuffisance rénale terminale, deux traitements de suppléance sont disponibles : l’épuration extrarénale, encore appelée dialyse, et/ou la transplantation rénale. Alors que la dialyse s’accompagne d’une forte morbi-mortalité, la transplantation rénale améliore la qualité et l’espérance de vie des patients, et reste à ce jour le traitement de choix de l’insuffisance rénale terminale. |
Modifications du système immunitaire au cours de l’insuffisance rénale Des travaux récents suggèrent que les modifications phénotypiques et fonctionnelles du système immunitaire au cours de l’insuffisance rénale chronique pourraient contribuer à l’état inflammatoire chronique décrit chez ces patients et expliquer en partie la surmortalité constatée. En effet, l’insuffisance rénale chronique s’accompagne d’une diminution de l’immunité adaptative dont témoignent la diminution de la réponse vaccinale et l’augmentation de la susceptibilité aux infections, toutes deux caractéristiques de ce que l’on observe chez les personnes âgées [1]. Carerro et al. [2] ont rapporté une augmentation des marqueurs d’immunosénescence (ce terme désigne le vieillissement du système immunitaire) chez les patients en hémodialyse. Cette immunosénescence prématurée serait secondaire au stress oxydatif et au statut inflammatoire chronique, induits à la fois par des facteurs « urémiques » et par les stimulations antigéniques répétées, liées aux matériaux bio-incompatibles utilisés en dialyse. Betjes et al. [3] ont confirmé cette association entre insuffisance rénale terminale et immunosénescence prématurée. En revanche, l’immunosénescence est très peu documentée chez les patients après une transplantation rénale. L’amélioration de la fonction rénale et le sevrage de la dialyse pourraient induire une réversibilité de l’immunosénescence après la transplantation. |
Immunosénescence : concept et marqueurs immunologiques L’inflammation chronique et l’activation lymphocytaire sont deux pierres angulaires de l’immunosénescence liée à l’âge. Celle-ci contribue au risque accru de complications dégénératives (cancers, infections) et de mortalité caractérisant les personnes âgées. L’involution thymique, ou perte de la fonction du thymus, organe impliqué dans l’éducation des lymphocytes T naïfs, est caractéristique de l’immunosénescence [4]. Elle débute dès l’adolescence et se poursuit tout au long de la vie adulte. Histologiquement, elle se traduit par une transformation graisseuse du tissu thymique, expliquant la réduction constante de la capacité de ce tissu à produire des lymphocytes T naïfs et à maintenir un répertoire immunitaire T polyclonal, garant de l’efficacité de la réponse du système immunitaire à tout nouvel antigène. Cette involution s’accompagne d’altérations de la composition et de la fonction des lymphocytes T : réduction du compartiment de lymphocytes T naïfs, expansion de celui des lymphocytes T mémoires caractérisés par la capacité à produire des cytokines pro-inflammatoires (IFN-γ [interféron], TNF-α [tumor necrosis factor]), restriction oligoclonale du répertoire lymphocytaire T, raccourcissement de la taille des télomères des lymphocytes T (sénescence réplicative), diminution de la capacité fonctionnelle des lymphocytes T à contrôler les infections et à répondre aux vaccins [5]. Les lymphocytes T CD4+ deviennent plus sensibles à l’apoptose que les lymphocytes T CD8+, ce qui conduit à une inversion du rapport CD4/CD8. Certaines données suggèrent également une expansion associée du compartiment des lymphocytes T régulateurs [6]. Les infections virales latentes, en particulier par le cytomégalovirus (CMV), contribuent à l’accélération du phénomène d’immunosénescence par la stimulation antigénique chronique qu’elles entretiennent et qui favorise l’expansion périphérique d’une population oligoclonale de lymphocytes T anti-CMV au détriment des autres populations lymphocytaires T, conduisant ainsi à la perte du caractère polyclonal du répertoire T [5]. |
Immunosénescence accélérée et états pathologiques Plusieurs travaux ont mis en évidence un phénomène d’immunosénescence accélérée dans des états pathologiques associés à une inflammation chronique et une morbi-mortalité élevée, proche de celle qui est observée dans la population âgée et la population dialysée. Les patients irradiés, survivants des catastrophes atomiques d’Hiroshima et de Nagasaki, développent une lymphopénie T CD4+ prolongée associée à une augmentation de l’incidence d’infarctus du myocarde [7]. L’analyse des lymphocytes T met en évidence un renouvellement faible des populations naïves et une restriction du répertoire entraînant une altération de l’immunité anti-infectieuse [8]. Le renouvellement à long terme du pool lymphocytaire se fait aux dépens de lymphocytes T CD8+ mémoires [9]. Cette reconstitution s’accompagne d’une augmentation des marqueurs d’inflammation (protéine C réactive, IL-6) [10]. Les mêmes observations cliniques et immunologiques ont été rapportées dans la lymphopénie induite par le virus de l’immunodéficience humaine (VIH) [11]. En outre, l’exposition chronique de cette population immunodéprimée à des pathogènes tels que le CMV accélèrerait l’immunosénescence [12]. |
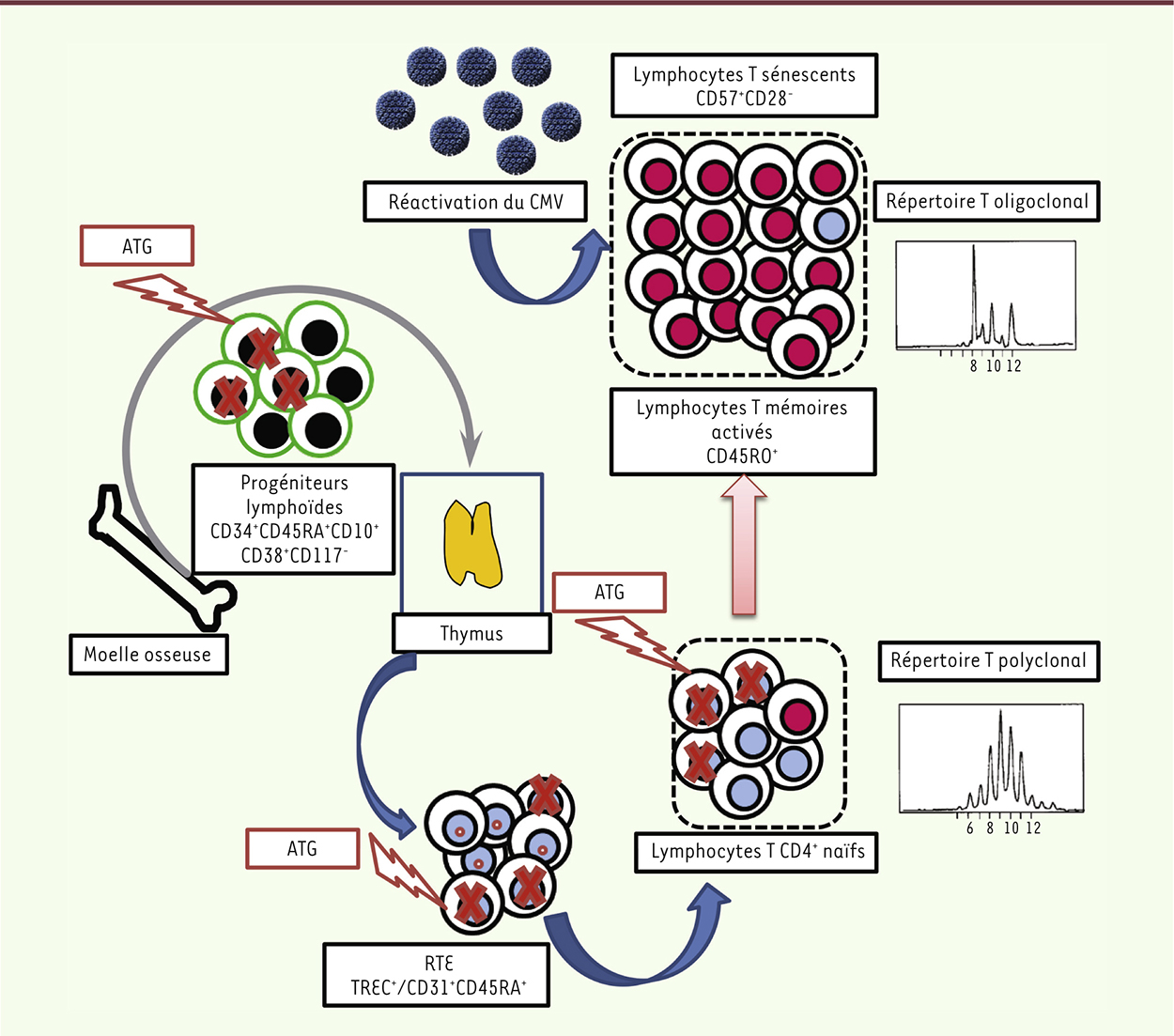
Immunosénescence et transplantation d’organe Nous avons récemment confirmé qu’une immunosénescence accélérée existait chez les patients atteints d’insuffisance rénale terminale au moment de la transplantation rénale [13]. On observe ainsi (1) une dysfonction thymique ; (2) une proportion élevée de lymphocytes T sénescents (CD57+CD28−) ; (3) un raccourcissement de la taille des télomères et une activité télomérase1 lymphocytaire effondrée. L’amélioration de la fonction rénale et le sevrage de la dialyse induites par la transplantation permettent de corriger - au moins partiellement - l’immunosénescence chez un certain nombre de patients. En revanche, chez d’autres, paradoxalement, l’immunosénescence persiste, voire s’aggrave. Deux facteurs principaux semblent contribuer à ce phénomène : l’utilisation de globulines anti-lymphocytaires polyclonales ou ATG, un traitement de prévention du rejet aigu d’allogreffe qui entraîne une profonde lymphopénie T, et l’infection par le CMV. L’ATG induit : (1) une dysfonction thymique et une diminution du pourcentage des progéniteurs lymphoïdes circulants en amont du thymus ; (2) une augmentation de la proportion des lymphocytes T sénescents, accentuée par la séropositivité pour le CMV ; (3) une augmentation du pourcentage des lymphocytes T régulateurs d’origine périphérique, accentuée par la dysfonction thymique ; (4) la persistance d’un raccourcissement de la taille des télomères et d’une activité télomérase lymphocytaire effondrée (Figure 1). Ces anomalies ne sont pas observées chez des patients transplantés, mais qui ont reçu, comme alternative à l’ATG, un traitement d’induction par basiliximab, un anticorps monoclonal anti-CD25 bloquant l’activation des lymphocytes T sans entraîner de lymphopénie. Les conséquences cliniques de la persistance ou de l’accélération de l’immunosénescence après l’administration d’ATG restent à éclaircir (toxicité thymique directe ou indirecte, myélotoxicité).
 | Figure 1.
Facteurs contribuant à la persistance ou à l’aggravation de l’immunosénescence accélérée après transplantation rénale. Rôle conjoint de l’ATG (globulines polyclonales antilymphocytaires) sur les progéniteurs lymphoïdes en amont du thymus, sur les RTE (recent thymic emigrants, lymphocytes T naïfs émigrant du thymus) et les lymphocytes T CD4+ naïfs et du CMV augmentant le pool de lymphocytes T mémoires, puis sénescents. TREC : T cell receptor excision circles. |
Notre travail montre également que, chez les patients traités exclusivement par ATG, une proportion élevée de lymphocytes T sénescents au moment de la transplantation est associée à un risque plus élevé de maladies à CMV et à une augmentation de l’incidence cumulée de rejets aigus. Ceci suggère que l’ATG accroît les conséquences de ces altérations immunologiques. Un travail récent suggère aussi que l’expansion des lymphocytes T sénescents après transplantation est associée à une dysfonction chronique du greffon rénal à long terme [14]. Le rôle pathogène des lymphocytes T sénescents reste controversé, même s’il est de plus en plus souvent décrit dans diverses maladies auto-immunes ou auto-inflammatoires [15]. Les mécanismes physiopathologiques impliquant ces lymphocytes sont encore mal connus, notamment en transplantation rénale. Enfin, si cette implication était avérée, il resterait néanmoins à découvrir comment prévenir ou inverser ce phénomène. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Verkade MA, van de Wetering J, Klepper M, et al. Peripheral blood dendritic cells and GM-CSF as an adjuvant for hepatitis B vaccination in hemodialysis patients . Kidney Int. 2004; ; 66 : :614.–621. 2.
Carrero JJ, Stenvinkel P, Fellstrom B, et al. Telomere attrition is associated with inflammation, low fetuin-A levels and high mortality in prevalent haemodialysis patients . J Intern Med. 2008; ; 263 : :302.–312. 3.
Betjes MG, Langerak AW, van der Spek A, et al. Premature aging of circulating T cells in patients with end-stage renal disease . Kidney Int. 2011; ; 80 : :208.–217. 4.
Gruver AL, Hudson LL, Sempowski GD. Immunosenescence of ageing . J Pathol. 2007; ; 211 : :144.–156. 5.
Derhovanessian E, Maier AB, Beck R, et al. Hallmark features of immunosenescence are absent in familial longevity . J Immunol. 2010; ; 185 : :4618.–4624. 6.
Wang L, Xie Y, Zhu LJ, et al. An association between immunosenescence and CD4+CD25+ regulatory T cells: a systematic review . Biomed Environ Sci. 2010; ; 23 : :327.–332. 7.
Kusunoki Y, Kyoizumi S, Yamaoka M, et al. Decreased proportion of CD4 T cells in the blood of atomic bomb survivors with myocardial infarction . Radiat Res. 1999; ; 152 : :539.–543. 8.
Kusunoki Y, Yamaoka M, Kasagi F, et al. Long-lasting changes in the T-cell receptor V beta repertoires of CD4 memory T-cell populations in the peripheral blood of radiation-exposed people . Br J Haematol. 2003; ; 122 : :975.–984. 9.
Yamaoka M, Kusunoki Y, Kasagi F, et al. Decreases in percentages of naive CD4 and CD8 T cells and increases in percentages of memory CD8 T-cell subsets in the peripheral blood lymphocyte populations of A-bomb survivors . Radiat Res. 2004; ; 161 : :290.–298. 10.
Hayashi T, Kusunoki Y, Hakoda M, et al. Radiation dose-dependent increases in inflammatory response markers in A-bomb survivors . Int J Radiat Biol. 2003; ; 79 : :129.–136. 11.
Deeks SG. HIV infection, inflammation, immunosenescence, and aging . Annu Rev Med. 2011; ; 62 : :141.–155. 12.
Hsue PY, Hunt PW, Sinclair E, et al. Increased carotid intima-media thickness in HIV patients is associated with increased cytomegalovirus-specific T-cell responses . AIDS. 2006; ; 20 : :2275.–2283. 13. Crépin T, Carron C, Roubiou C, et al. ATG-induced accelerated immune senescence: clinical implications in renal transplant recipients . Am J Transplant. 2015; ; 15 : :1028.–1038. 14.
Yap M, Boeffard F, Clave E, et al. Expansion of highly differentiated cytotoxic terminally differentiated effector memory CD8+ T cells in a subset of clinically stable kidney transplant recipients: a potential marker for late graft dysfunction . J Am Soc Nephrol. 2014; ; 25 : :1856.–1868. 15.
Broux B, Markovic-Plese S, Stinissen P, Hellings N. Pathogenic features of CD4+CD28- T cells in immune disorders . Trends Mol Med. 2012; ; 18 : :446.–453. |