| |
| Med Sci (Paris). 2015 May; 31(5): 515–521. Published online 2015 June 9. doi: 10.1051/medsci/20153105013.L’émail Un autoassemblage unique dans le monde du minéral Guilhem Lignon,1* Muriel de la Dure-Molla,1,2* Arnaud Dessombz,1*** Ariane Berdal,1,2**** and Sylvie Babajko1# 1Laboratoire de physiopathologie orale moléculaire, Inserm UMRS 1138, centre de recherche des Cordeliers, université Paris Diderot-Paris 7, université Pierre et Marie Curie-Paris 6, université Paris Descartes-Paris 5, 15-21, rue de l’École de Médecine, 75270Paris cedex 06, France 2Centre de référence des malformations rares de la face et de la cavité buccale, CRMR-MAFACE, hôpital Rothschild, APHP, Paris, France |

Les mécanismes moléculaires de la formation de l’émail, l’amélogenèse, et sa physiopathologie commencent à être élucidés. L’émail présente une architecture minérale construite sur un échafaudage peptidique labile. La dynamique de l’amélogenèse dépend d’une cascade ordonnée d’évènements contrôlés par les améloblastes, seules cellules épithéliales de l’organisme directement impliquées dans un processus de squelettogenèse physiologique. Toute altération génétique ou systémique de l’amélogenèse va laisser une empreinte dans l’architecture minérale de l’émail (Figure 1). Sa chronologie de minéralisation s’étendant des derniers mois de gestation à la préadolescence, chaque dent, temporaire ou permanente, témoigne d’une période définie. Le profil des anomalies amélaires (i.e. de l’émail) permet ainsi de retracer la nature et la chronologie d’un évènement tératogène. Par ailleurs, la compréhension des processus contrôlés par les peptides de l’émail est une source d’inspiration pour des applications futures. En effet, ces peptides pourraient être utilisés, dans une perspective biomimétique, pour la régénération des tissus épithéliaux et squelettiques avec des applications cliniques concrètes.
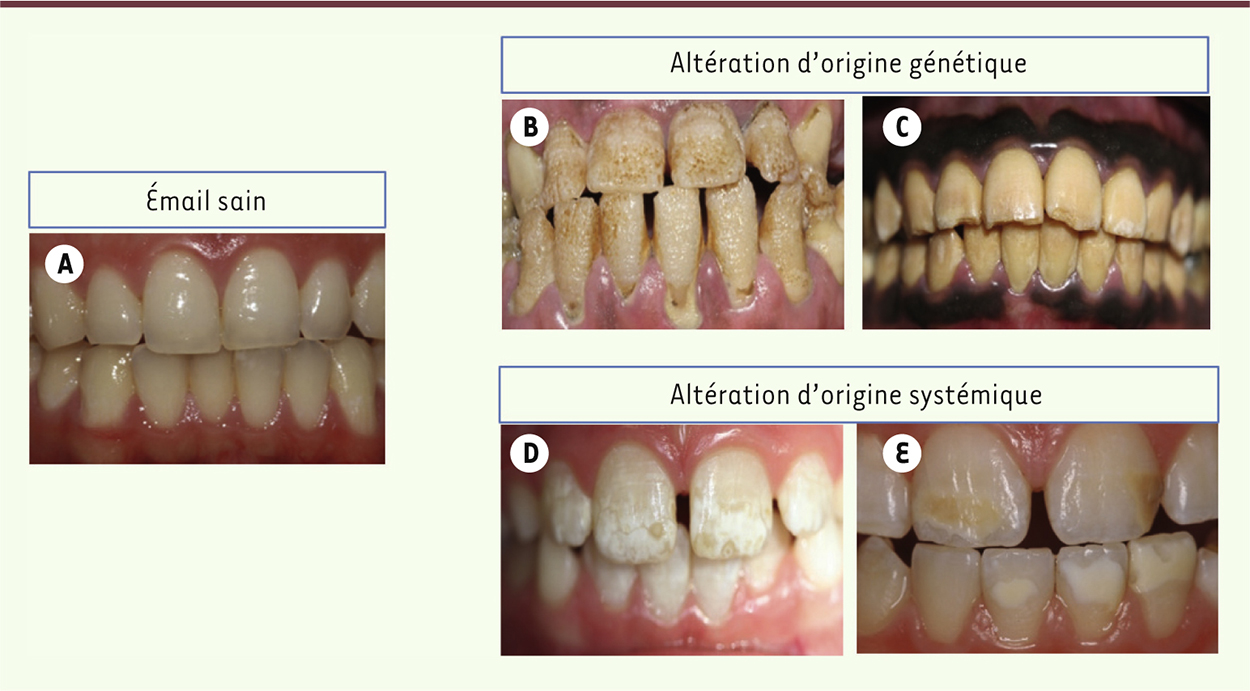
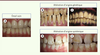 | Figure 1.
Phénotype clinique des différentes pathologies amélaires. A. Émail sain. B. Amélogenèse imparfaite héréditaire de type hypoplasique. C. Amélogenèse imparfaite héréditaire de type hypomature. D. Émail fluorotique. E. Émail atteint de MIH (molar incisor hypomineralization). |
|
Un autoassemblage minéral sur un échafaudage peptidique labile L’émail mature se distingue par une matrice totalement acellulaire, hyperminéralisée (97 %) et quasi dépourvue de protéines (la phase aqueuse représente 3 % du volume amélaire) [1]. Cette construction complexe (Figure 2) diffère de la charpente collagénique pérenne, robuste et imprégnée de petits cristallites de minéral d’apatite (quelques dizaines de nm) de tous les autres tissus minéralisés (os, dentine, cément dentaire) [2]. Or, l’émail est un des rares tissus minéralisés de l’organisme (avec les otolithes) élaboré par des cellules épithéliales. Ces améloblastes disparaissent en fusionnant avec l’épithélium oral lors de l’éruption dentaire, rendant toute altération de l’émail irréversible et empêchant tout processus de cicatrisation lors d’altérations congénitales ou acquises.
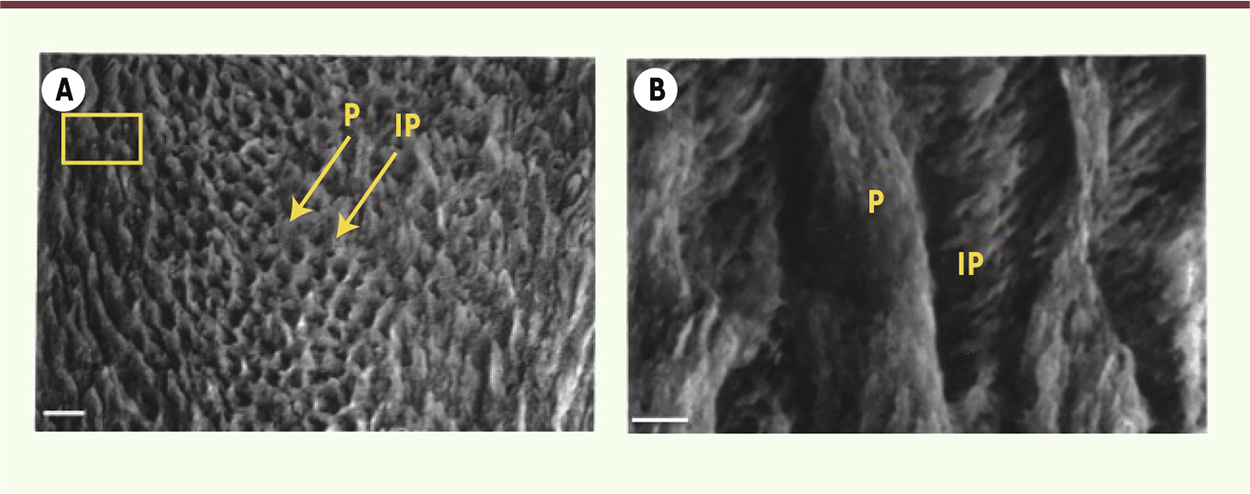
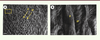 | Figure 2.
Coupe d’émail observée au microscope électronique à balayage après une attaque acide. A. L’émail est constitué d’une série de prismes arrondis (P) indiqués par les flèches. Ces structures sont préalablement occupées par le prolongement de Tomes. Les parois de ces prismes sont formées par l’émail interprismatique (IP) Barre d’échelle = 10 μM. B. À plus fort grossissement, on peut distinguer la différence d’orientation des cristaux dans l’émail prismatique (P) et interprismatique (IP). Barre d’échelle = 1 μM. |
L’unité élémentaire de l’émail est le cristal d’hydroxyapatite, de formule Ca5(PO4)3(OH), usuellement formulée Ca10(PO4)6(OH)2 pour correspondre à la réalité chimique de la composition de la maille élémentaire cristalline. L’apatite peut présenter de nombreuses substitutions ioniques (Ca2+ par Sr2+ et PO43- par CO32- ou F-) augmentant sa stabilité chimique face aux agressions acides constantes du milieu buccal et de son microbiote. La formation de ce cristal est régie par des phénomènes thermodynamiques : à basse concentration, les ions restent en solution et solvatés puisque l’énergie nécessaire pour rester dans cet état ionique est plus faible que celle requise pour précipiter. À saturation, l’équilibre énergétique s’inverse et la nucléation du cristal débute grâce aux peptides matriciels (amélogénines [AMEL], améloblastine [AMBN] et énaméline [ENAM]) (Figure 3). Plusieurs sites de nucléation au sein des autoassemblages peptidiques extracellulaires sont à l’origine d’un seul cristal de composition hétérogène. De plus, la fixation de peptides matriciels sur des faces spécifiques de ce cristal en module l’énergie de surface, guidant la croissance du cristal selon des directions précises. Ces peptides extracellulaires s’interposent entre les cristaux en croissance, permettant ainsi d’élaborer de longs cristaux de minéral, parfaitement ordonnés et organisés. C’est leur dégradation par des enzymes (la métalloprotéase 20 [MMP20] et la kallikréine 4 [KLK4]) lors de la maturation de l’émail (dernière phase de l’amélogenèse), qui autorise une croissance minérale complète (Figure 3) [3]. En résumé, les peptides amélaires modèlent l’architecture cristalline depuis les étapes de nucléation du minéral jusqu’à la fin de la croissance du cristal, de par la dynamique de leur autoassemblage et de leur dégradation par protéolyse.
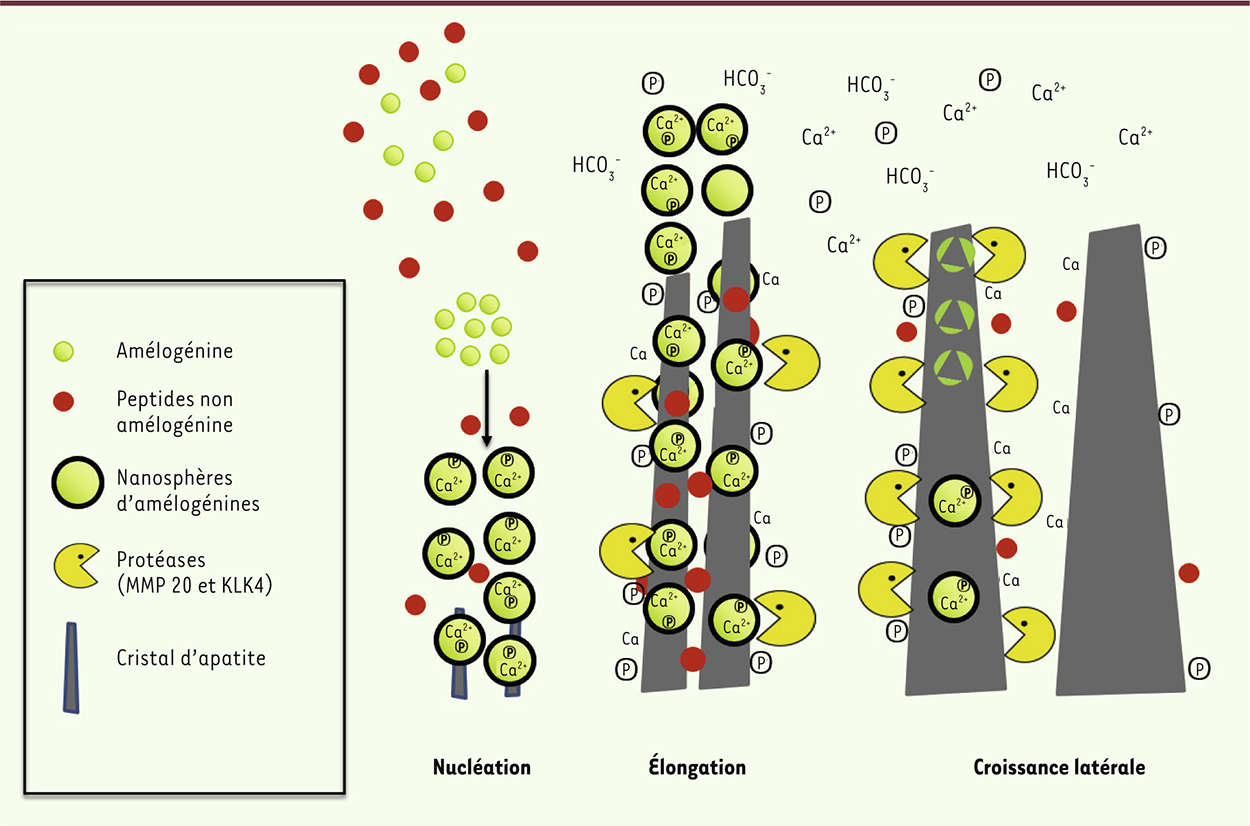
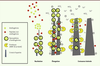 | Figure 3.
Croissance minérale pendant l’amélogenèse. La nucléation cristalline débute par une phase de sécrétion. Les différents peptides matriciels, majoritairement AMEL, AMBN et ENAM, sont sécrétés. L’AMEL peut s’assembler en nanosphères et les autres protéines restent sous la forme de monomère. Les nanosphères d’AMEL, chargées de calcium et de phosphate (Ⓟ) vont déclencher la formation cristalline, appelée nucléation. La phase de sécrétion se poursuit ensuite en une élongation cristalline : les différents peptides vont venir se positionner sur le cristal en formation, inhibant sa croissance latérale et autorisant son élongation (croissance du cristal en hauteur). La sécrétion des protéases se produit depuis la phase de sécrétion (MMP20) jusqu’à la fin de la maturation (essentiellement KLK4 mais aussi MMP20). Elles dégradent les peptides amélaires et permettent ainsi la croissance latérale du cristal pour donner un émail mature. Tout au long de ce processus, des ions bicarbonate sont sécrétés pour contrebalancer l’acidification du milieu secondaire à la croissance cristalline (due à l’incorporation des phosphates dans l’apatite laissant des protons libres). |
|
Au sein de la matrice amélaire, l’AMEL est la protéine majoritaire, représentant plus de 90 % des protéines, l’AMBN est présente pour environ 5 % et ENAM pour 1 à 5 % [3]. Dès leur arrivée dans le compartiment extracellulaire, de longs et fins cordons de minéral se forment (Figure 3) au contact de la membrane plasmique de l’améloblaste sécrétoire. Les peptides amélaires (regroupant les protéines citées précédemment, leurs produits de dégradation ménagée et d’autres peptides impliqués dans la minéralisation tels que l’amélotine, l’odontogenic ameloblast associated protein [ODAM], SCPPPQ1, etc.) lient le calcium ionique et le cristal d’apatite en formation par des motifs chargés négativement (phosphates, sulfates, carboxyles ou hydroxyles). Ces domaines constituent des niches d’attraction des ions Ca2+ et PO43- déclenchant la nucléation des cristaux. Une deuxième propriété de ces peptides est de s’autoassembler. Manipulée in vitro, l’AMEL peut former différents modules structurels, nanosphères, rubans ou micelles, par ailleurs utilisés pour reconstruire des défauts tissulaires ou enrober des produits actifs. In vivo, il n’existe pas de consensus sur sa forme d’autoassemblage en nanosphères ou en rubans [4, 5]. Situés sur les faces latérales des cristaux d’apatite, ces peptides favorisent l’allongement cristallin selon l’axe principal et empêchent leur fusion [6] (Figure 3). Cette disposition assure la formation de cristaux organisés parallèlement, extrêmement longs (> 100 μm) mais très réduits dans leur diamètre initial (10 nm). La phase minérale ainsi organisée au stade de sécrétion occupe 10 à 20 % du volume de l’émail [7]. Dans cet échafaudage, les interactions entre peptides amélaires contrôlent la morphogenèse élémentaire de chaque cristal ainsi que l’organisation superstructurale des cristaux en cordons prismatiques enchevêtrés. Ceci confère l’épaisseur et une résistance mécanique maximale à l’émail [8]. Ces peptides assurent également l’interaction entre matrice extracellulaire et surface membranaire du pôle sécrétoire de l’améloblaste (appelé prolongement de Tomes), qui guide l’organisation des cristaux en groupes inter et intraprismatiques selon une orientation spécifique (Figure 4C).
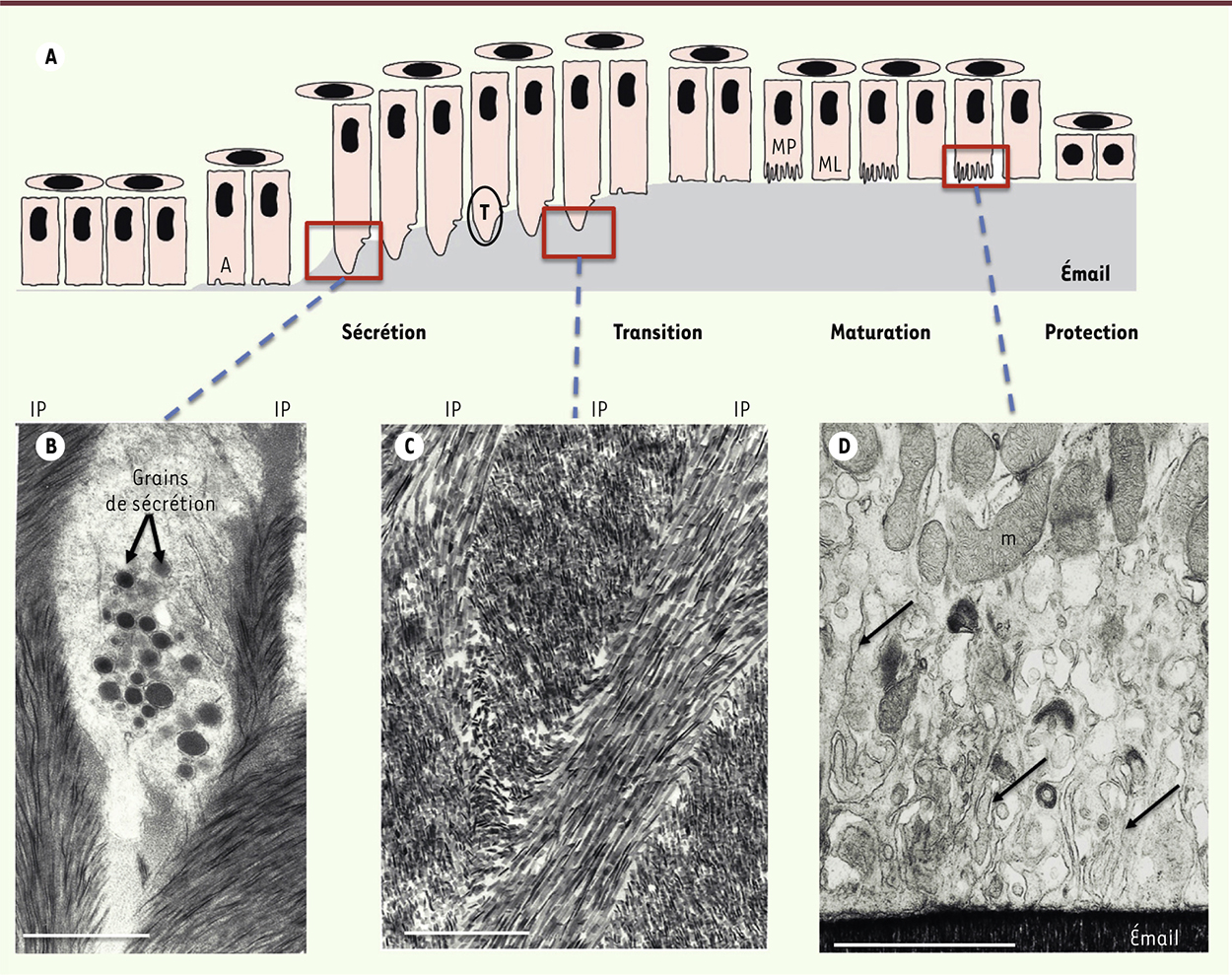
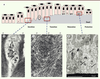 | Figure 4.
Le processus d’amélogenèse. A. Cycle des améloblastes (A) pendant l’amélogenèse. Ils passent successivement par des stades de sécrétion (au cours desquels apparaît le prolongement de tomes [t]), transition, maturation (avec ML : améloblastes de maturation à bord lisse, et MP : améloblastes de maturation à bord plissé) et protection. C’est au cours de ces différents stades que les améloblastes vont acquérir leurs différentes propriétés pour produire un émail mature. B. Le prolongement de Tomes des améloblastes est observé en microscopie électronique à transmission. Les grains de sécrétion migrent jusqu’à l’extrémité distale du prolongement de Tomes où ils vont sécréter les différents peptides amélaires qui vont permettre la formation de l’émail mature. L’émail interprismatique (IP) en cours de formation est également visible. C. Deux sites de sécrétion existent chez l’améloblaste : le premier se situe au niveau de la partie proximale du prolongement de Tomes et est responsable de la sécrétion de l’émail interprismatique. Le deuxième se situe au niveau de la partie distale du prolongement et sécrète l’émail prismatique (P). Plusieurs améloblastes participent à l’élaboration de l’émail interprismatique tandis que l’émail prismatique est produit par un seul améloblaste. D. Les améloblastes de maturation à bords plissés sont observés en microscopie électronique à transmission. Les replis membranaires sont indiqués par les flèches. Ces améloblastes comprennent de nombreuses mitochondries (m) reflétant la forte activité métabolique en lien avec les transferts ioniques actifs. Barre d’échelle = 2 μM pour B, C et D. |
Ce bref résumé ne rend compte que partiellement de la biodiversité exceptionnelle des peptides amélaires, de leur dynamique et de leur labilité. De nombreuses isoformes sont issues de l’épissage alternatif des ARN, notamment pour les AMEL. La dégradation ménagée de la protéine totale, essentiellement assurée par l’enzyme MMP20, produit de nombreux peptides eux-mêmes actifs [9, 10]. Au stade de maturation (Figures 4A et 4C), les peptides sont détruits par une dégradation enzymatique plus extensive puis quasi totale, assurée essentiellement par KLK4. Le cristal d’apatite, dépourvu des peptides amélaires limitant sa croissance latérale, prend alors toute son extension, aboutissant à un taux final de 97 % de minéral (Figure 3). Par ailleurs, de plus en plus d’études accordent aux peptides de l’émail des fonctions de signalisation dépassant le seul contexte de l’amélogenèse [9, 10]. Le dogme de l’expression restreinte d’AMEL et d’AMBN est progressivement battu en brèche ; on sait aujourd’hui que celle-ci s’étend à la dentine, au ligament parodontal, aux cémentoblastes, à l’os, et même à des tissus non minéralisés [11, 12]. Il a d’ailleurs été récemment proposé que les peptides amélaires soient une caractéristique propre aux cellules osseuses de la mâchoire [11]. Ils permettraient ainsi d’assurer l’adaptation fonctionnelle de l’os des mâchoires aux conditions buccales, mastication, défense contre l’environnement agressif associant aliments, biofilms et microbiote oral. |
Un programme épithélial ordonné Une telle architecture minérale résulte d’activités cellulaires séquentielles et ordonnées assurées par l’épithélium améloblastique. Ce dernier est mis en place lors du développement par des cascades de signalisation (impliquant les protéines BMP [bone morphogenic protein], Shh [sonic hedgehog], Wnt, FGF [fibroblast growth factor], Msx1 [Msh homeobox 1] et 2, Dlx [distal-less homeobox] 1-6, Pax 9, Sox 2) [13–15] en dialogue avec le mésenchyme. Il donnera l’épithélium adamantin interne, formé par les améloblastes (Figure 4A), directement en charge de l’amélogenèse. Les améloblastes sont polarisés et reliés entre eux par des complexes jonctionnels étanches qui leur permettent notamment de contrôler l’accès des ions à la matrice qu’ils sécrètent à leur pôle apical. Le prolongement de Tomes (Figure 4B) est à l’origine du prisme d’émail. La partie distale de ce prolongement va donner l’émail intraprismatique et la partie proximale, l’émail interprismatique (Figure 4B-C). Au cours de la première étape de l’amélogenèse, phase sécrétoire, la production de protéines matricielles est maximale et celle des protéases, modérée [16]. Une fois l’épaisseur finale de l’émail atteinte, la phase de maturation de l’amélogenèse peut débuter. Les améloblastes diminuent leur activité sécrétoire et deviennent des améloblastes de maturation (Figure 4A-D). Ils assurent alors le transport de calcium et la protéolyse, qui permettent la croissance des cristaux en largeur et longueur [16]. Ces améloblastes possèdent l’équipement moléculaire des systèmes épithéliaux de transport ionique :
-
systèmes jonctionnels, canaux ioniques : SLC24A4 ;
-
calciprotéines cytosoliques ;
-
les calbindines, enzymes membranaires ;
-
CaATPase, kinases ;
-
FAM20A [family with sequence similarity 20, member A] et FAM20C ;
-
anhydrases carboniques et échangeurs ioniques
pour contrôler le pH déterminant la croissance cristalline, aquaporines pour le volume d’eau, etc.). L’amélogenèse comprend ainsi les mêmes échanges ioniques que ceux se produisant dans le rein ou l’intestin. Un fait cellulaire marquant de ce stade est la multiplication de la surface d’échange avec le compartiment extracellulaire (Figure 4D), comme dans les cellules rénales impliquées dans la réabsorption de calcium et phosphate. Les modélisations cellulaires de ces étapes sont peu performantes, car elles ne permettent pas d’analyser les circuits transcellulaires et paracellulaires entre le compartiment sanguin et la matrice. Après la phase de maturation, les améloblastes perdent leur aspect sécrétoire, se raccourcissent, puis les échanges ioniques s’arrêtent [17]. |
Les amélogenèses imparfaites isolées Comme la plupart des gènes impliqués dans la biominéralisation, ceux qui codent les protéines de la matrice amélaire sont hautement conservés. Ils constituent une sous-famille du groupe des SCPP (phoshoprotéines extracellulaires liant le calcium) [18]. La mutation de ces gènes induit des amélogenèses imparfaites héréditaires isolées (AIH) (Figures 1B-C), reproduites dans des modèles expérimentaux de rongeurs dont ces gènes sont mutés. L’émail résultant peut être altéré de façon quantitative, donnant des formes hypoplasiques (développement insuffisant) (Figure 1B), ou qualitative, donnant des formes hypomatures et hypominéralisées (Figure 1C) dont la classification selon Witkop est toujours actuelle [19].
-
L’AIH autosomique dominante représente 46 % à 67 % des cas d’amélogenèses imparfaites héréditaires [20]. Les gènes atteints sont notamment ENAM ou FAM83H (gène codant pour une protéine de 127 kD impliquée dans la différenciation améloblastique, mais dont la fonction n’est pas élucidée à ce jour), avec une prédominance pour FAM83H. Récemment, une mutation de l’AMBN a également été identifiée [21].
-
L’AIH liée au chromosome X représente 5 % des formes d’AIH. Deux gènes distincts codant des amélogénines sont portés par le chromosome X d’une part (production de 90 % des ARN d’AMEL), et Y d’autre part [22]. L’aspect strié de l’émail chez les femmes hétérozygotes est pathognomonique et reflète le phénomène de lyonisation (inactivation d’un chromosome X) : alternance des plages d’émail anormales avec l’émail sain. Le garçon est plus gravement atteint. Les mutations fonctionnelles répertoriées entraînant une perte de l’AMEL (totale ou partielle) sont à l’origine de formes hypoplasiques. Celles touchant la région de reconnaissance d’une enzyme protéolytique conduisent aux formes hypominéralisées/hypomatures [23].
-
L’AIH autosomique récessive est la plus rare. Six gènes ont été incriminés, majoritairement dans des formes hypomatures ou hypominéralisées. Les principaux sont KLK4 et MMP20. D’épaisseur normale, l’émail fragile présente une teinte variant du blanc au brun.
Les défauts génétiques de l’émail ne sont pas restreints à ces formes isolées. Une série importante de formes syndromiques sont répertoriées (164 entrées OMIM en 2014 pour enamel [émail]). Elles reflètent les nombreuses propriétés fonctionnelles partagées avec d’autres tissus spécialisés dans les échanges ioniques [24] ou d’origine ectodermique (Dlx3 du syndrome tricho-dento-osseux). Le profil spécifique de l’émail peut être un outil diagnostique en génétique moléculaire [24]. Dans le syndrome émail-rein par exemple, l’AIH s’accompagne d’une néphrocalcinose (excès de dépôts de calcium dans le rein). De plus, certains symptômes dentaires sont pathognomoniques de ce syndrome : des défauts de forme touchant les incisives, une hyperplasie gingivale et l’absence d’éruption dentaire [24]. Le gène muté est alors FAM20A. |
Anomalies de l’émail liées à l’environnement Des facteurs environnementaux peuvent être à l’origine de défauts structuraux de l’émail (Figures 1D-E). Seront altérées les dents en cours de minéralisation au moment de l’exposition. Un exemple classique est la fluorose dentaire résultant de l’ingestion excessive de fluor [25]. Des doses prophylactiques, plus faibles, ont au contraire un effet bénéfique dans la prévention des caries (ce qui explique la diminution significative de leur prévalence au cours de ces dernières décennies) [26]. La fluorose se caractérise par l’apparition de tâches blanchâtres et d’un émail cassant qui peut être endommagé (Figure 1D). La sévérité de la pathologie dépend de la quantité de fluor ingérée. Une origine environnementale est également avérée dans le cas d’une autre pathologie, récemment décrite, molar incisor hypomineralization ou MIH, qui touche actuellement 15 à 20 % des enfants de 6-7 ans [27] et affecte sélectivement la première molaire et les incisives permanentes (Figure 1E). Des travaux expérimentaux ont montré des liens entre le MIH et l’exposition à différents agents environnementaux pendant la période périnatale. Cette anomalie relativement fréquente est associée au problème émergeant des perturbateurs endocriniens (notamment le bisphénol A) [28, 29], omniprésents et dont la fenêtre de sensibilité maximale s’étend de la vie fœtale à la petite enfance [30]. Ces polluants environnementaux peuvent interagir avec certains récepteurs hormonaux et altérer ainsi la quantité de peptides matriciels sécrétés en modulant leur niveau d’expression. Le MIH constituerait un marqueur précoce d’exposition aux perturbateurs endocriniens, aisément et rapidement diagnostiqué, alors que des années sont nécessaires pour identifier d’autres pathologies associées à cette exposition telles que l’infertilité masculine, les cancers hormono-dépendants ou l’obésité [31]. |
Biomimétique et protéines de l’émail La multifonctionnalité des peptides amélaires est associée au fait que certains de leurs domaines peptidiques font partie d’une classe de protéines « désordonnées » c’est-à-dire capables de changer de conformation [32]. Wald et al. classent les protéines amélaires, en particulier l’améloblastine [AMBN], dans ce groupe. L’état « non structuré » de ce type de protéines, commun à tous les organismes vivants, est essentiel pour les fonctions cellulaires de base. Il répond au double cahier des charges des peptides amélaires : constituants élémentaires d’une matrice extracellulaire évolutive en lien avec la nanoarchitecture cristalline, et signaux du modelage tissulaire disponibles dans le microenvironnement des mâchoires [11]. Ce type de protéines représente plus de 50 % des protéines chez les eucaryotes. Elles sont impliquées dans la reconnaissance moléculaire et sont la cible de protéases. Du fait de la perte des améloblastes au moment de l’éruption dentaire, l’émail est incapable de se régénérer. Toute une littérature vise à comprendre la formation des nanosphères par la manipulation des peptides amélaires pour, à terme, pouvoir recréer un émail synthétique lors de dommages causés par des caries ou lors de désordres amélaires dûs à des facteurs environnementaux ou génétiques. La biomimétique consiste à reproduire et imiter artificiellement les procédés de la nature dans les organismes vivants. À cet effet, de nombreuses études réalisées à partir d’amélogénine [AMEL] recombinante ont été entreprises chez Escherichia coli (malgré l’absence chez cette bactérie de modifications post-traductionnelles permettant la maturation des protéines synthétisées) [4, 33]. Néanmoins, une équipe a ainsi reproduit in vitro la formation de nanorubans d’AMEL recombinante (rH174) dans une émulsion huile-eau de micelles inverses en présence d’ions Ca2+ et PO43- à pH acide. Ces nanorubans s’autoassemblent en faisceaux imitant la structure des cristallites d’émail [4]. La technique d’assemblage par dépôt électrolytique (ELD) permet également la préparation de polymères composites par coprécipitation simultanée d’AMEL recombinante (rP172) et du phosphate de calcium minéral en conditions physiologiques [34]. Une fois sécrétés, ces polymères s’assemblent pour donner les nanosphères, qui s’associent entres elles pour former les nanorubans qui vont se déposer sur le cristal en formation [5, 33]. Les peptides amélaires purifiés à partir du porc (contenant majoritairement des amélogénines) sont commercialisés et utilisés en clinique depuis une dizaine d’années. Lorsque ces peptides sont appliqués à la surface des racines dentaires, ils précipitent et forment une matrice extracellulaire stable pouvant interagir avec les cellules dans les tissus adjacents. Ce processus imite alors l’odontogenèse. La capacité d’une seule protéine amélaire à provoquer la régénération de tous les tissus parodontaux ouvre la voie au développement de nouveaux dispositifs thérapeutiques à partir de peptides recombinants [35]. La mise en évidence des effets cellulaires de l’AMEL et de l’AMBN a fait l’objet de quelques dizaines de publications scientifiques ; les études utilisaient des peptides recombinants ou des modèles de surexpression. Les AMEL sont des peptides ostéoinducteurs puissants [36, 37]. L’AMBN, quant à elle, module différentes voies de signalisation cellulaire, costimulant la résorption et l’apposition osseuses [38]. Ces mêmes peptides sont également exploités pour le traitement des plaies cutanées dans des cas de difficultés de cicatrisation [39]. |
L’amélogenèse fait intervenir toute une série de protéines capables d’interagir entre elles et avec les phases minérale, ionique et cristalline. La mutation des gènes correspondant à ces protéines entraîne une amélogenèse imparfaite, soit isolée, soit en association avec d’autres symptômes lorsque la protéine intervient au sein d’autres tissus biologiques. L’expression de ces mêmes gènes peut être altérée par des facteurs environnementaux. L’analyse détaillée de la forme clinique des défauts d’émail permet d’identifier le facteur et la fenêtre développementale impliqués. Son utilisation diagnostique plus systématisée serait un outil précieux de compréhension des réseaux intégrés au croisement de maladies rares touchant développement, dermatologie, néphrologie, fonctionnalités crâniofaciale et squelettique. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Pugach MK, Gibson CW. Analysis of enamel development using murine model systems: approaches and limitations . Front Physiol. 2014; ; 5 : :313.. 2.
Margolis HC, Kwak SY, Yamazaki H. Role of mineralization inhibitors in the regulation of hard tissue biomineralization: relevance to initial enamel formation and maturation . Front Physiol. 2014; ; 5 : :339.. 3.
Hu JC, Yamakoshi Y, Yamakoshi F, et al. Proteomics and genetics of dental enamel . Cells Tissues Organs. 2005; ; 181 : :219.–231. 4.
Martinez-Avila O, Wu S, Kim SJ, et al. Self-assembly of filamentous amelogenin requires calcium and phosphate: from dimers via nanoribbons to fibrils . Biomacromolecules. 2012; ; 13 : :3494.–3502. 5.
Brookes SJ, Lyngstadaas SP, Robinson C, et al. Intracellular nanosphere subunit assembly as revealed by amelogenin molecular cross-linking studies . Eur J Oral Sci. 2006; ; 114 : :280.–286. 6.
Du C, Falini G, Fermani S, et al. Supramolecular assembly of amelogenin nanospheres into birefringent microribbons . Science. 2005; ; 307 : :1450.–1454. 7.
Margolis HC, Beniash E, Fowler CE. Role of macromolecular assembly of enamel matrix proteins in enamel formation . J Dent Res. 2006; ; 82 : :775.–793. 8.
Paine ML, Snead ML. Protein interactions during assembly of the enamel organic extracellular matrix . J Bone Miner Res. 1997; ; 12 : :221.–227. 9.
Haruyama N, Hatakeyama J, Moriyama K, Kulkarni AB. Amelogenins: multi-functional enamel matrix proteins and their binding partners . J Oral Biosci. 2011; ; 53 : :257.–266. 10.
Mitani K, Haruyama N, Hatakeyama J, Igarashi K. Amelogenin splice isoforms stimulate chondrogenic differentiation of ATDC5 cells . Oral Dis. 2013; ; 19 : :169.–179. 11.
Jacques J, Hotton D, De la Dure-Molla M, et al. Tracking endogenous amelogenin and ameloblastin in vivo . PLoS One. 2014; ; 94 : :e99626.. 12.
Jacques J, Hotton D, Asselin A, et al. Ameloblastin as a putative marker of specific bone compartments . Connect Tissue Res. 2014; ; 55 : :117.–120. 13.
Molla M, Descroix V, Aïoub M, et al. Enamel protein regulation and dental and periodontal physiopathology in MSX2 mutant mice . Am J Pathol. 2010; ; 177 : :2516.–2526. 14.
Dong X, Shen B, Ruan N, et al. Expression patterns of genes critical for BMP signaling pathway in developing human primary tooth germs . Histochem Cell Biol. 2014; ; 6 : :657.–665. 15.
Michon F. Les cellules souches épithéliales dentaires exprimant Sox2 participent au renouvellement de l’incisive de souris . Med Sci (Paris). 2013; ; 4 : :341.–342. 16.
Simmer JP, Papagerakis P, Smith CE, et al. Regulation of dental enamel shape and hardness . J Dent Res. 2010; ; 89 : :1024.–1038. 17.
Robinson C. Enamel maturation: a brief background with implications for some enamel dysplasias . Front Physiol. 2014; ; 5 : :388.. 18.
Kawasaki K. The SCPP gene repertoire in bony vertebrates and graded differences in mineralized tissues . Dev Genes Evol. 2009; ; 219 : :147.–157. 19.
Witkop CJ. Amelogenesis imperfecta, dentinogenesis imperfecta and dentin dysplasia revisited: problems in classification . J Oral Pathol. 1988; ; 17 : :547.–553. 20.
Molla M, Bailleul-Forestier I, Artaud C, et al. Odontogénétique . EMC - Médecine buccale; , 2008 : :44. p. 21.
Poulter JA, Murillo G, Brookes SJ, et al. Deletion of ameloblastin exon 6 is associated with amelogenesis imperfecta . Hum Mol Genet. 2014; : 23 : :5317.–5324. 22.
Salido EC, Yen PH, Koprivnikar K, et al. The human enamel protein gene amelogenin is expressed from both the X and the Y chromosomes . Am J Hum Genet. 1992; ; 50 : :303.–316. 23.
Barron MJ, Brookes SJ, Kirkham J, et al. A mutation in the mouse Amelx tri-tyrosyl domain results in impaired secretion of amelogenin and phenocopies human X-linked amelogenesis imperfecta . Hum Mol Genet. 2010; ; 19 : :1230.–1247. 24.
De la Dure-Molla M, Quentric M, Yamaguti PM, et al. Pathognomonic oral profile of enamel renal syndrome (ERS) caused by recessive FAM20A mutations . Orphanet J Rare Dis. 2014; ; 9 : :84.. 25.
Houari S, Wurtz T, Ferbus D, et al. Asporin and the mineralization process in fluoride-treated rats . J Bone Miner Res. 2014; ; 29 : :1446.–1455. 26.
Spira A. La prévention en France, 2004 : éléments de réflexion . Med Sci (Paris). 2004; ; 20 : :926.–928. 27.
Jälevik B. Prevalence and diagnosis of molar-incisor-hypomineralisation (MIH): a systematic review . Eur Arch Paediatr Dent. 2010; ; 11 : :59.–64. 28.
Jedeon K, De la Dure-Molla M, Brookes SJ, et al. Enamel defects reflect perinatal exposure to bisphenol A . Am J Pathol. 2013; ; 183 : :108.–118. 29.
Jedeon K, Loiodice S, Marciano M, et al. Estrogen and bisphenol A affect male rat enamel formation and promote ameloblast proliferation . Endocrinology. 2014; ; 155 : :3365.–3375. 30.
Varayoud J, Ramos JG, Bosquiazzo VL, et al. Neonatal exposure to bisphenol A alters rat uterine implantation-associated gene expression and reduces the number of implantation sites . Endocrinology. 2011; ; 152 : :1101.–1111. 31.
De Coster S, Van Larebeke N. Endocrine-disrupting chemicals: associated disorders and mechanisms of action . J Environ Public Health. 2012; ; 2012 : :713696.. 32.
Wald T, Bednárová L, Osiˇcka R, et al. Biophysical characterization of recombinant human ameloblastin . Eur J Oral Sci. 2011; ; 119 : :261.–269. 33.
He X, Wu S, Martinez-Avila O, et al. Self-aligning amelogenin nanoribbons in oil-water system . J Struct Biol. 2011; ; 174 : :203.–212. 34.
Fan Y, Sun Z, Wang R, et al. Enamel inspired nanocomposite fabrication through amelogenin supramolecular assembly . Biomaterials. 2007; ; 28 : :3034.–3042. 35.
Haze A, Taylor AL, Haegewald S, et al. Regeneration of bone and periodontal ligament induced by recombinant amelogenin after periodontitis . J Cell Mol Med. 2009; ; 13 : :1110.–1124. 36.
Warotayanont R, Frenkel B, Snead ML, Zhou Y. Leucine-rich amelogenin peptide induces osteogenesis by activation of the Wnt pathway . Biochem Biophys Res Commun. 2009; ; 387 : :558.–563. 37.
Hatakeyama J, Sreenath T, Hatakeyama Y, et al. The receptor activator of nuclear factor-kappa B ligand-mediated osteoclastogenic pathway is elevated in amelogenin-null mice . J Biol Chem. 2003; ; 278 : :35743.–3578. 38.
Lu X, Ito Y, Kulkarni A, et al. Ameloblastin-rich enamel matrix favors short and randomly oriented apatite crystals . Eur J Oral Sci. 2011; ; 119 : :254.–256. 39.
Vowden P, Romanelli M, Peter R, et al. The effect of amelogenins (Xelma) on hard-to-heal venous leg ulcers . Wound Repair Regen. 2006; ; 14 : :240.–246. |