| |
| Med Sci (Paris). 2015 May; 31(5): 546–550. Published online 2015 June 9. doi: 10.1051/medsci/20153105017.Comorbidité entre la dépression et l’addiction Vers une cible moléculaire commune ? Margarita Arango-Lievano1* and Michael G. Kaplitt2** 1Département de physiologie, institut de génomique fonctionnelle, Inserm U661, CNRS UMR5203, 141, rue de la Cardonille, 34090Montpellier, France 2Département de chirurgie neurologique, Weill Cornell Medical College, 1300 York Avenue, New York, 10021 NY, États-Unis |

Vignette © Inserm/éric Dehausse, Yasmina Saoudi/Vingt mille lieues sous les mers. Jules Verne - Musée Jules Verne - Ville de Nantes. Un tiers des patients développant une addiction ont un trouble affectif préexistant comme la dépression [1]. D’une part, la dépression augmente le risque de rechute après sevrage ; d’autre part, chez les patients souffrant d’une dépression majeure, la sévérité et la durée de leurs symptômes sont plus grandes s’ils souffrent aussi d’une addiction [2, 3]. Des études récentes suggèrent que l’étiologie de cette comorbidité, bien qu’incomprise, reflète un déséquilibre de l’activation des circuits et des mécanismes de signalisation de la récompense [4]. D’un point de vue neuroanatomique, l’addiction autant que la dépression peuvent être interprétées comme des maladies de l’apprentissage de la récompense [5–7]. Ce système d’apprentissage est fortement conservé chez les mammifères et représente un avantage évolutif important, puisqu’il permet de renforcer les comportements de survie tels que la reproduction et l’alimentation [5]. Un des symptômes les plus caractéristiques de la dépression est l’anhédonie, qui se définit comme la perte des sensations de plaisir, générant un déficit de motivation général pouvant se révéler fatal [8]. Au contraire, un comportement addictif se traduit par un détournement de cette voie focalisant la motivation vers la recherche des objets de l’addiction [6]. La voie de l’apprentissage du plaisir fait intervenir de nombreux noyaux cortico-limbiques dont le noyau accumbens (NAc), noyau sous-cortical appartenant au striatum, est le principal centre d’intégration [7]. Des thérapies de stimulation profonde du cerveau visant le NAc s’avèrent efficaces, bien qu’invasives, pour traiter addictions et dépression [9–11]. Le NAc reçoit des afférences sérotoninergiques du noyau du raphé, dopaminergiques de l’aire tegmentale ventrale, et glutamatergiques du cortex préfrontal. Il est constitué à 95 % de neurones épineux moyens (MSN) qui sont classés en deux sous-types en fonction de leurs efférences et signatures moléculaires. Les neurones composant la voie striato-nigrale ou voie directe2 (boucle de projection cortex cérébral - striatum - pallidum interne/substance noire réticulée - thalamus - cortex), expriment le récepteur de la dopamine de type 1 (DRD1), alors que les neurones composant la voie striato-pallidale, ou voie indirecte, expriment le récepteur de la dopamine de type D2 (DRD2). Les 5 % de neurones du NAc restants sont constitués d’interneurones dont les neurones cholinergiques (1 % des neurones) représentent la seule source d’acétylcholine pour cette structure [12]. Les neurones du NAc se différencient par leur signature moléculaire, mais aussi par leurs contributions aux réponses adaptatives induites par les drogues. Ainsi, les neurones épineux moyens de la voie striato-nigrale sont impliqués dans la réponse de récompense initiale, et dans la sensibilisation locomotrice induite par la cocaïne [13, 14]. D’un point de vue moléculaire, la cocaïne induit une réponse distincte dans ces neurones, qui commence par l’activation des MAP (mitogen-activated protein) kinases et aboutit à l’expression des gènes de réponse précoce que sont c-fos et zif-268 [15]. L’inactivation de ces neurones par voie optogénétique3, réduit l’effet appétitif de la cocaïne, alors que leur activation l’augmente [13]. Le système sérotoninergique est la cible principale des antidépresseurs. Ce système est aussi impliqué dans les comportements de récompense. Le laboratoire du Pr Paul Greengard a identifié la protéine p11 comme étant une petite protéine nécessaire à la localisation membranaire des récepteurs de la sérotonine 5HT1-B et 5HT4 [16, 17]. Comme la quantité de p11 est inférieure dans le cerveau des patients dépressifs à celle du cerveau de sujets contrôles, ce laboratoire a créé une souris génétiquement invalidée pour le gène correspondant (p11-knocked-out) et a démontré que celle-ci présentait des comportements anhédoniques et de désespoir, interprétés comme des symptômes dépressifs [16]. Dans cette synthèse, nous développons les arguments expérimentaux nous ayant permis de démontrer l’importance des niveaux d’expression de p11 dans le NAc pour le contrôle des comportements liés à la dépression et l’addiction. Nous montrerons successivement comment la déficience de p11 dans les interneurones cholinergiques du Nac est responsable des comportements de type dépressif, puis comment la modulation des niveaux d’expression de p11 dans le NAc contrôle la sensibilité aux effets appétitifs4 de la cocaïne. L’ensemble de ces données suggèrent que p11 intervient dans les mécanismes physiopathologiques de la dépression et de l’addiction, et que des interventions cherchant à augmenter son expression dans le NAc pourraient être envisagées comme stratégies thérapeutiques. |
La protéine P11 exprimée dans le NAc est suffisante pour moduler les comportements liés à la dépression Étant donné que le défaut en protéine p11 se traduit par des comportements associés à la dépression [18], nous avons cherché à identifier les réseaux neuroanatomiques impliqués. Comme les patients souffrant d’une dépression majeure présentent une diminution de l’expression de p11 dans le Nac [18], nous avons donc étudié les conséquences comportementales d’une perte de p11 dans cette région. La perte de p11 a été induite via l’administration d’un shARN (short hairpin ARN) spécifique délivré par un virus adéno-associé de type 2 (AAV2) injecté dans le NAc de souris contrôles [19]. Ces animaux ont ensuite été soumis à une série de tests évaluant leurs comportements moteurs, impliquant l’anhédonie (mesurée dans un test de préférence au sucrose) et le désespoir (reconnu par exemple par une augmentation du temps d’immobilité dans les tests de suspension par la queue ou de nage forcée, qui est interprétée comme un symptôme de dépression chez la souris). Le temps d’immobilité dans ces tests des animaux dont le taux de p11 est très diminué dans le NAc est bien supérieur à celui mesuré chez les souris ayant reçu un AAV2 contrôle. Le phénotype de ces souris est identique à celui de souris ayant une invalidation constitutive du gène p11 (souris p11-KO) [16, 19]. Ce résultat démontre sans ambiguïté que, dans le NAc, la perte de p11 est essentielle à la manifestation d’un comportement de désespoir (Figure 1). Deux observations renforcent cette conclusion : (1) la perte de p11 dans le NAc n’a pas d’incidence sur d’autres activités comportementales telles que la locomotion ; (2) la déficience de p11 dans d’autres régions du cerveau (le cortex cingulaire ou l’hippocampe) n’a pas d’incidence sur les comportements moteurs, de motivation et de désespoir [19].
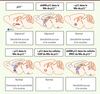 | Figure 1.
Récapitulatif de l’effet de la titration de p11 dans le NAc sur les phénotypes de dépression et la sensibilité aux effets appétitifs de la cocaïne. La souris déficiente en p11 présente des phénotypes de dépression et une sensibilité accrue à la cocaïne. Ces phénotypes sont reproduits par l’inactivation de l’expression de p11 uniquement dans le NAc. Inversement, la réintroduction de p11 uniquement dans le NAc de souris KO (p11-/-) est suffisante pour restaurer un comportement normal. La même stratégie de surexpression chez des souris sauvages (p11+/+) n’a pas d’effet sur les comportements dépressifs tout en diminuant la sensibilité à la cocaïne. Bien que l’expression de p11 dans le NAc module la comorbidité entre ces deux pathologies, seules les cellules cholinergiques du NAc requièrent p11 pour restaurer des comportements affectifs normaux chez les souris KO, alors que seules les cellules (DRD1+) requièrent p11 pour exprimer la sensibilité à la cocaïne. |
L’effet de la restauration de l’expression de p11 dans le NAc des souris déficientes est, lui aussi, sans ambiguïté. L’injection, dans le Nac de souris p11-KO ou de souris sauvages, d’un virus AAV2 vecteur de la séquence codant p11, ou de celle de la YFP (yellow fluorescent protein) utilisée comme contrôle, a donc été réalisée. Les mesures du comportement hédonique (recherche du plaisir qui se manifeste dans le test de préférence au sucrose), de désespoir (dans les tests de suspension par la queue ou de nage forcée) et moteur, indiquent que les souris p11-KO réexprimant p11 seulement dans le NAc ne présentent plus de comportement dépressif. La spécificité d’action et l’efficacité de la surexpression de p11 dans le NAc ouvrent ainsi la perspective d’applications thérapeutiques. Ces perspectives sont d’autant plus pertinentes que si la surexpression de p11 dans le NAc de souris présentant une déficience a un effet positif, elle est sans effet sur le comportement de souris contrôles (Figure 1). En terme de mécanistique, l’expression de p11 restreinte au NAc augmente la liaison de cyanopindolol radiomarqué dans la même structure [19]. Le cyanopindolol est un agoniste du récepteur synaptique 5HT1b qui ne diffuse pas à travers la membrane cellulaire. Ce résultat indique donc que p11 pourrait augmenter la localisation synaptique du récepteur. En appliquant la technique d’imagerie calcique en temps réel à des neurones du NAc mis en culture, nous avons pu démontrer que cette augmentation de liaison se traduit par une augmentation de la transduction du signal sérotoninergique induite à partir de ce récepteur en particulier [19]. |
Au sein du NAc, les interneurones cholinergiques sont responsables des effets dépressifs Le NAc contenant plusieurs types cellulaires, nous avons cherché à caractériser le circuit précis qui est sensible à la dérégulation de l’expression de p11 [18]. Des analyses d’expression montrent que, dans le NAc, la protéine p11 est exprimée dans tous les neurones épineux moyens présentant des récepteurs à la dopamine de type 1 et 2 (DRD1 et DRD2) et, avec une plus forte intensité, dans les interneurones cholinergiques [20]. Pour invalider l’expression de p11 dans un seul type cellulaire, nous avons utilisé le système cre-lox : des souris chez lesquelles le gène p11 est flanqué par deux séquences lox (loxp11) ont été croisées avec des souris transgéniques exprimant la recombinase Cre sous le contrôle de promoteurs spécifiques (DRD1, DRD2, A2a, ChAT). Dans ces conditions, dans les cellules exprimant Cre, et seulement dans celles-ci, les deux séquences lox seront recombinées induisant ainsi une élimination de la séquence génique de p11. L’invalidation de p11 dans les cellules exprimant le DRD2 ou la choline acétyltransférase (ChAT) a le même effet sur les comportements anhédoniques et de désespoir que l’invalidation constitutive de p11 [20]. Les cellules ChAT exprimant aussi le DRD2 [21], ce résultat ne permet cependant pas de déterminer la contribution de neurones épineux moyens exprimant le DRD2, ni de préciser la localisation des neurones contrôlant ce phénotype puisque ceux-ci se distribuent au-delà des limites anatomiques du NAc (e.g. striatum dorsal, ventral, septum, hippocampe) [22]. Afin d’aller plus loin dans la caractérisation des cellules participant au phénotype dépressif, nous avons utilisé une combinaison de techniques génétiques et virales pour rétablir l’expression de p11 dans un seul type cellulaire du NAc des souris p11-KO [20]. Dans un premier temps, les interneurones cholinergiques ont été ciblés. Ce type cellulaire ne représente que 1 % des neurones du Nac, mais exprime beaucoup plus de p11 que les autres types de neurones. Des AAV2 porteurs de la séquence codante de p11 en aval d’une cassette STOP flanquée de sites lox ont été injectés à des souris p11-KO croisées avec des souris CHAT-Cre afin d’assurer la spécificité d’expression de p11 dans les neurones cholinergiques (ChAT). Bien que contraignante, cette méthodologie permet de cibler les neurones ChAT seulement dans la région du cerveau qui est infectée par le vecteur viral. Le rétablissement de l’expression de p11 dans les seuls interneurones cholinergiques du NAc restaure un comportement normal dans le test de préférence du sucrose et dans le test de suspension par la queue (Figure 1), sans toutefois modifier l’activité locomotrice [20]. Cet effet est spécifique du NAc puisque le rétablissement de p11 dans les interneurones cholinergiques du striatum dorsal des souris p11-KO n’a pas d’incidence sur ces mêmes comportements [20]. Même si les interneurones cholinergiques ne représentent que 1 % des neurones du NAc, ils y sont la seule source d’acétylcholine, et leur activité régule l’excitabilité des neurones épineux moyens. |
P11 module la réponse de récompense induite par la cocaïne La protéine p11 jouant un rôle essentiel dans le NAc dans le contrôle de comportements liés à la dépression chez la souris, il est légitime de se demander si, dans cette même région, p11 régule aussi des comportements addictifs, en prenant comme exemple les phénomènes de récompense liés à la consommation de cocaïne. Pour répondre à cette question, nous avons, dans un premier temps, cherché à savoir si l’administration chronique de cocaïne influence l’expression de p11 dans le NAc. Nous avons montré que, pour deux doses différentes (20 mg kg−1 et 10 mg kg −1), et deux paradigmes expérimentaux différents (la préférence de place conditionnée [CPP] et la sensibilisation locomotrice), l’administration de cocaïne pendant plus de cinq jours réduit de 50 % l’expression du transcrit du gène p11, en particulier dans le NAc [23]. Cette observation renforce l’hypothèse générale selon laquelle p11 dans le NAc contribue à la comorbidité des comportements addictifs et dépressifs au moins chez la souris. Bien entendu, cette observation pose de nouvelles questions aujourd’hui sans réponses. Par exemple, la perte d’expression de p11 dans le NAc induite par la cocaïne favorise-t-elle le développement de comportements dépressifs ? Si c’est le cas, l’emploi d’une stratégie de thérapie génique visant à rétablir l’expression de p11 dans le NAc au-dessus d’un seuil aurait-elle des effets bénéfiques ? |
Les effets appétitifs de la cocaïne divergent en fonction du dosage de p11 dans le NAc L’effet appétitif de la cocaïne chez des souris p11-KO, dont le déficit de p11 est antérieur à l’injection de cocaïne, a été étudié à l’aide du test de place conditionnée [23]. Ce test permet d’estimer la valeur hédonique d’une substance en évaluant la préférence du sujet pour un endroit associé à cette substance. Pour avoir une idée du seuil de sensibilité à la cocaïne, nous avons utilisé une faible dose de cette drogue (7,5 mg kg−1). Nous observons que les souris homozygotes invalidées constitutivement pour p11 (p11-KO) sont plus sensibles aux effets appétitifs de la cocaïne que les souris sauvages. Ce résultat suggère que plus le déficit de p11 dans le NAc est fort, plus les souris seront sensibles aux effets appétitifs de la cocaïne (les hétérozygotes n’ont pas été testés). Pour étudier l’implication de p11 au sein du NAc dans cette sensibilisation, nous avons injecté des AAV exprimant p11 ou la YFP dans le NAc de souris p11-KO et sauvages. Conformément à nos hypothèses, la restauration de l’expression de p11 dans le NAc de souris p11-KO suffit à rétablir une réponse normale à la cocaïne dans le test de préférence de place conditionnée. Au contraire, les souris sauvages surexprimant p11 dans le NAc n’établissent pas de préférence de place conditionnée en réponse à cette dose de drogue, témoignant d’une diminution de leur sensibilité. En termes neurochimiques, l’expression du gène c-fos induite en réponse à l’exposition à la cocaïne est fortement augmentée dans le NAc des souris exprimant la YFP, mais pas dans le Nac de souris exprimant p11. En conséquence, p11 dans le NAc servirait à réduire la transduction du signal induit par la cocaïne [23]. L’ensemble de ces résultats suggèrent une relation inversement proportionnelle entre la quantité de p11 dans le NAc et la réponse à la récompense associée à la cocaïne. Ce modèle prédit que l’invalidation sélective de p11 dans le NAc devrait augmenter cette réponse. Comme précédemment, nous avons induit un déficit de p11 via des vecteurs viraux exprimant un shARN dirigé contre p11 injectés dans le NAc de souris sauvages. En accord avec la prédiction de départ, le score des souris dont le déficit de p11 est restreint au NAc est supérieur à celui des souris contrôles (recevant un shARN contrôle) dans le test de place conditionnée [23]. Il reste à identifier les neurones du NAc qui sont sensibles à p11 et qui contrôlent la récompense. |
Dans le NAc, les neurones moyens épineux de la voie directe sont responsables de l’effet désensibilisant de p11 Différents sous-types cellulaires dans le NAc modulent la réponse comportementale aux drogues. Ainsi, l’activation des neurones moyens épineux de la voie directe (exprimant le DRD1) par optogénétique augmente la réponse de préférence de place conditionnée à la cocaïne, alors que l’activation des neurones de la voie indirecte (exprimant DRD2) la réduit [13]. Pour distinguer entre ces sous-types, nous avons développé un vecteur viral permettant l’expression d’un ARN interférent de type shARN dirigé spécifiquement contre p11 uniquement dans les cellules exprimant la Cre recombinase (via l’excision d’une cassette stop comme décrit précédemment). Ce virus a été injecté dans le NAc des souris transgéniques DRD1-Cre ou DRD2-Cre [24]. Après vérification (1) d’une infectivité équivalente des neurones moyens épineux des voies directe et indirecte par ce virus, et (2) de l’invalidation sélective de p11 dans les cellules exprimant Cre, nous avons procédé à l’étude comportementale de la réponse des souris à la cocaïne dans le test de place conditionnée. La perte de p11 dans les neurones moyens épineux de la voie directe (DRD1) a un effet de sensibilisation aux effets appétitifs de la cocaïne similaire à celui qui est observé lors de l’invalidation de p11 dans l’ensemble du NAc (Figure 1) [23]. Ces résultats soulèvent la question de la plasticité de l’expression de p11 dans les phases ultérieures du processus d’addiction. En particulier, il sera important d’étudier si le niveau de p11 reste bas pendant le sevrage et si son expression change suite à une rechute. |
Conclusions et perspectives thérapeutiques L’ensemble de ces travaux ont permis d’identifier la protéine p11 comme une cible thérapeutique pour des affections fréquemment associées telles que l’addiction et la dépression. Nous avons identifié le NAc comme un site ciblé de façon privilégiée par ces deux pathologies, tout en distinguant deux voies de contrôle : un déficit de p11 dans les interneurones cholinergiques produit des effets dépressifs, alors qu’un déficit de p11 dans les neurones moyens épineux de la voie directe augmente la sensibilité à la cocaïne. Ainsi, l’ensemble de ces travaux renforcent l’hypothèse selon laquelle la comorbidité entre la dépression et l’addiction s’explique par des mécanismes moléculaires et des circuits anatomiques partagés. Toute intervention visant à stimuler la production de p11 dans le NAc pourrait s’avérer bénéfique pour les deux pathologies, d’autant plus lorsqu’elles se manifestent ensemble. Par exemple, nos travaux ouvrent la voie à de nouvelles approches thérapeutiques pour la dépression majeure résistante aux pharmacothérapies [25]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Grant BF. Comorbidity between DSM-IV drug use disorders and major depression: results of a national survey of adults . J Subst Abuse. 1995; ; 7 : :481.–497. 2.
Kessler RC, Berglund P, Demler O, et al. The epidemiology of major depressive disorder: results from the National comorbidity survey replication (NCS-R) . JAMA. 2003; ; 289 : :3095.–3105. 3.
Swendsen JD, Merikangas KR. The comorbidity of depression and substance use disorders . Clin Psychol Rev. 2000; ; 20 : :173.–189. 4.
Vialou V. Dépression et régulation de l’activité dopaminergique . Med Sci (Paris). 2013; ; 29 : :473.–477. 5.
Volman SF, Lammel S, Margolis EB, et al. New insights into the specificity and plasticity of reward and aversion encoding in the mesolimbic system . J Neurosci. 2013; ; 33 : :17569.–76. 6.
Hyman SE, Malenka RC, Nestler EJ. Neural mechanisms of addiction: the role of reward-related learning and memory . Annu Rev Neurosci. 2006; ; 29 : :565.–598. 7.
Russo SJ, Nestler EJ. The brain reward circuitry in mood disorders . Nat Rev Neurosci. 2013; ; 14 : :609.–625. 8.
Der-Avakian A, Markou A. The neurobiology of anhedonia and other reward-related deficits . Trends Neurosci. 2012; ; 35 : :68.–77. 9.
Bewernick BH, Hurlemann R, Matusch A, et al. Nucleus accumbens deep brain stimulation decreases ratings of depression and anxiety in treatment-resistant depression . Biol Psychiatry. 2010; ; 67 : :110.–116. 10.
Kuhn J, Moller M, Treppmann JF, et al. Deep brain stimulation of the nucleus accumbens and its usefulness in severe opioid addiction . Mol Psychiatry. 2014; ; 19 : :145.–146. 11.
Aouizerate B, Martin-Guehl C, Cuny E, et al. Stimulation cérébrale profonde du striatum ventral dans le traitement du trouble obsessionnel-compulsif avec dépression majeure . Med Sci (Paris). 2005; ; 21 : :811.–813. 12.
Zhou FM, Wilson CJ, Dani JA. Cholinergic interneuron characteristics and nicotinic properties in the striatum . J Neurobiol. 2002; ; 53 : :590.–605. 13.
Lobo MK, Covington HE 3rd, Chaudhury D, et al. Cell type-specific loss of BDNF signaling mimics optogenetic control of cocaine reward . Science. 2010; ; 330 : :385.–390. 14.
Hikida T, Kimura K, Wada N, et al. Distinct roles of synaptic transmission in direct and indirect striatal pathways to reward and aversive behavior . Neuron. 2010; ; 66 : :896.–907. 15.
Bertran-Gonzalez J, Bosch C, Maroteaux M, et al. Opposing patterns of signaling activation in dopamine D1 and D2 receptor-expressing striatal neurons in response to cocaine and haloperidol . J Neurosci. 2008; ; 28 : :5671.–5685. 16.
Svenningsson P, Chergui K, Rachleff I, et al. Alterations in 5-HT1B receptor function by p11 in depression-like states . Science. 2006; ; 311 : :77.–80. 17.
Warner-Schmidt JL, Flajolet M, Maller A, et al. Role of p11 in cellular and behavioral effects of 5-HT4 receptor stimulation . J Neurosci. 2009; ; 29 : :1937.–1946. 18.
Svenningsson P, Kim Y, Warner-Schmidt J, et al. p11 and its role in depression and therapeutic responses to antidepressants . Nat Rev Neurosci. 2013; ; 14 : :673.–680. 19.
Alexander B, Warner-Schmidt J, Eriksson T, et al. Reversal of depressed behaviors in mice by p11 gene therapy in the nucleus accumbens . Sci Transl Med. 2010; ; 2 : :54.ra76. 20.
Warner-Schmidt JL, Schmidt EF, Marshall JJ, et al. Cholinergic interneurons in the nucleus accumbens regulate depression-like behavior . Proc Natl Acad Sci USA. 2012; ; 109 : :11360.–5. 21. Le Moine C, Tison F, Bloch B. D2 dopamine receptor gene expression by cholinergic neurons in the rat striatum . Neurosci Lett. 1990; ; 117 : :248.–252. 22.
Nelson AB, Hang GB, Grueter BA, et al. A comparison of striatal-dependent behaviors in wild-type and hemizygous Drd1a and Drd2 BAC transgenic mice . J Neurosci. 2012; ; 32 : :9119.–9123. 23.
Arango-Lievano M, Schwarz JT, Vernov M, et al. Cell-type specific expression of p11 controls cocaine reward . Biol Psychiatry. 2014; ; 76 : :794.–801. 24.
Gong S, Doughty M, Harbaugh CR, et al. Targeting Cre recombinase to specific neuron populations with bacterial artificial chromosome constructs . J Neurosci. 2007; ; 27 : :9817.–9823. 25.
Chen G, Twyman R, Manji HK. p11 and gene therapy for severe psychiatric disorders: a practical goal? Sci Transl Med. 2010; ; 2 : :54ps1.. 26. Dugué GP, Tricoire L. Principes et applications de l’optogénétique en neuroscience . Med Sci (Paris). 2015; ; 31 : :291.–303. 27.
Vandecasteele M, Senova YS, Palfi S, Dugué GP. Potentiel thérapeutique de la neuromodulation optogénétique . Med Sci (Paris). 2015; ; 31 : :404.–416. |



