| |
| Med Sci (Paris). 2015 June; 31(6-7): 589–591. Published online 2015 July 7. doi: 10.1051/medsci/20153106005.Une mutation hétérozygote de SH3BP2 amplifie la réponse inflammatoire à l’infection des macrophages dans un modèle de chérubisme chez la souris Marcel Deckert1,2* and Virginie Prod’Homme1,2 1Centre méditerranéen de médecine moléculaire (C3M), Inserm, U1065, équipe microenvironnement, signalisation et cancer, bâtiment universitaire ARCHIMED, 151, route Saint Antoine de Ginestière, 06204Nice Cedex 03, France 2Université de Nice Sophia Antipolis, faculté de médecine, laboratoire d’excellence Signalife, 06103Nice, France MeSH keywords: Protéines adaptatrices de la transduction du signal, Animaux, Chérubinisme, Modèles animaux de maladie humaine, Hétérozygote, Infection, Inflammation, Macrophages, Souris, Souris knockout, Mutation faux-sens, génétique, immunologie, anatomopathologie |
Des mutations de SH3BP2 à l’origine du chérubisme Le chérubisme est une dysplasie cranio-faciale rare, caractérisée par un élargissement symétrique de la partie inférieure du visage qui donne au patient une apparence semblable à celle des chérubins de la Renaissance. Cette maladie génétique est transmise de manière autosomique dominante. Les patients présentent une érosion importante des os de la mâchoire dans lesquels s’accumulent des kystes fibreux remplis de cellules multinucléées géantes de type ostéoclaste. Les lésions apparaissent dans la petite enfance, entre 2 et 5 ans, et progressent jusqu’à la puberté pour régresser presque complètement à l’âge adulte. Cette maladie reste bénigne mais engendre des troubles importants de la face et de la dentition, associés à des problèmes esthétiques et psychologiques qui nécessitent une intervention chirurgicale dans les cas sévères. La majorité des mutations associées au chérubisme affectent l’exon 9 du gène SH3BP2 codant pour 3BP2 ou SH3BP2 (Abl SH3 binding protein 2). Ces mutations conduisent au changement d’un unique acide aminé dans la séquence R415SPPDG420 de 3BP2 [1]. 3BP2 est une protéine adaptatrice que nous avions identifiée comme un partenaire de la protéine tyrosine kinase SYK [2] et d’autres molécules de signalisation comme les kinases SRC et les facteurs d’échange nucléotidique VAV. Ainsi, 3BP2 est impliquée dans l’activation de programmes transcriptionnels et cellulaires (comme le remodelage du réseau d’actine) via l’engagement de multiples récepteurs dans les réponses leucocytaires [3], la différenciation des ostéoclastes [4] et le remodelage osseux [1]. L’étiologie du chérubisme est longtemps restée inconnue, mais le développement de modèles chez la souris a permis d’importants progrès dans la compréhension des facteurs déclencheurs de cette maladie énigmatique. Le knock-in des mutations P416R et G418R (respectivement P418R et G420R chez l’homme) dans le gène Sh3bp2 montre qu’un seul allèle mutant n’est pas suffisant pour déclencher la maladie chez la souris. Les souris mutantes homozygotes développent cependant une ostéoporose sévère et une inflammation systémique, avec des niveaux élevés de TNF-α (tumor necrosis factor) sérique, résultant d’une hyperactivation des voies de signalisation dépendantes des kinases SRC et SYK et du facteur de transcription NFATc1 (nuclear factor of activated T-cells) dans les macrophages et les ostéoclastes. Ainsi, ces modèles définissent le chérubisme comme une maladie héréditaire auto-inflammatoire médiée par les cellules myéloïdes, et confèrent à la mutation du gène Sh3bp2 un rôle moteur dans cette maladie [5, 6]. Une avancée importante dans la compréhension du chérubisme est venue du laboratoire du Dr Rottapel, qui a identifié l’inter-action entre 3BP2 et la poly(ADP-ribosyl)polymérase tankyrase comme une étape clé dans la pathogenèse de la maladie [7]. La fixation de tankyrase sur le motif RSPPDG de la protéine 3BP2 sauvage, en catalysant la poly(ADP-ribosyl)ation (PARylation) de 3BP2, entraîne sa polyubiquitination par RNF146 (ring finger protein 146), une E3 ubiquitine ligase dépendante de la PARylation des protéines. Cette séquence de modifications post-traductionnelles est suivie de la dégradation de 3BP2 par le protéasome, assurant ainsi l’homéostasie protéique de 3BP2. Dans le chérubisme, ce mécanisme est défectueux car les mutations ponctuelles du motif RSPPDG de 3BP2 abolissent son interaction avec tankyrase, avec pour conséquence une accumulation des protéines 3BP2 mutantes à l’origine du syndrome auto-inflammatoire observé [6, 7]. |
La mutation de SH3BP2 amplifie la réponse des macrophages aux stimulus infectieux De nombreuses questions restaient néanmoins sans réponse quant à l’étiologie exacte de la maladie chez l’homme. En particulier, comment expliquer la différence de transmissibilité de la maladie entre l’homme (autosomique dominante) et la souris (autosomique récessive) ? L’existence de pathologies buccales, comme les parodontites, associées à une inflammation locale et des pertes osseuses [8], nous a conduits à émettre l’hypothèse de l’existence de facteurs déclencheurs additionnels chez l’homme, n’existant pas chez les souris élevées en conditions stériles. Pour tester cette hypothèse, nous avons étudié la réponse inflammatoire à divers agents microbiens dans notre modèle de souris chérubiques et dans des souris déficientes en 3BP2 (souris knock-out Sh3bp2). Ces modèles génétiques nous ont permis de démontrer un rôle important de 3BP2 dans la réponse inflammatoire des macrophages aux pathogènes. La production de cytokines inflammatoires comme l’IL(interleukine)-6, l’IL-12 et le TNF-α, est dramatiquement réduite in vivo et in vitro dans les macrophages déficients en 3BP2 en réponse à divers stimulus microbiens agonistes des TLR (toll like receptor) ou d’autres récepteurs n’appartenant pas à cette famille. Les macrophages déficients en 3BP2 présentent également une phagocytose défectueuse. Au niveau biochimique, nous avons montré que 3BP2 est nécessaire à l’activation de protéines de signalisation qui interviennent dans la réponse des macrophages à l’infection. À l’inverse, comme chez l’homme, les macrophages de souris possédant un seul allèle de chérubisme (souris Sh3bp2
WT/G418R) ont une hypersensibilité aux agents infectieux in vivo et in vitro, en termes d’activation des voies de signalisation conduisant à la production de cytokines inflammatoires et au remodelage de l’actine. De façon remarquable, l’administration par voie orale de LPS (lipopolysaccharide), un agoniste de TLR-4, induit une réponse inflammatoire exacerbée dans les souris chérubiques hétérozygotes. Nos travaux suggèrent donc que le microenvironnement infectieux local et les signaux de danger microbiens (PAMP), associés à une mutation chérubique hétérozygote de 3BP2, peuvent déclencher une réaction inflammatoire pathologique conduisant au chérubisme [6] (Figure 1). À noter que l’inflammation stérile produite en l’absence de germes microbiens par l’homozygotie des mutations Sh3bp2 P416R et G418R est réduite en l’absence de la protéine MYD88, essentielle à l’activation des macrophages par les TLR et les motifs moléculaires associés aux dommages cellulaires (DAMP), suggérant que les signaux issus des dommages tissulaires peuvent également contribuer au développement du chérubisme, du moins chez la souris [6, 9].
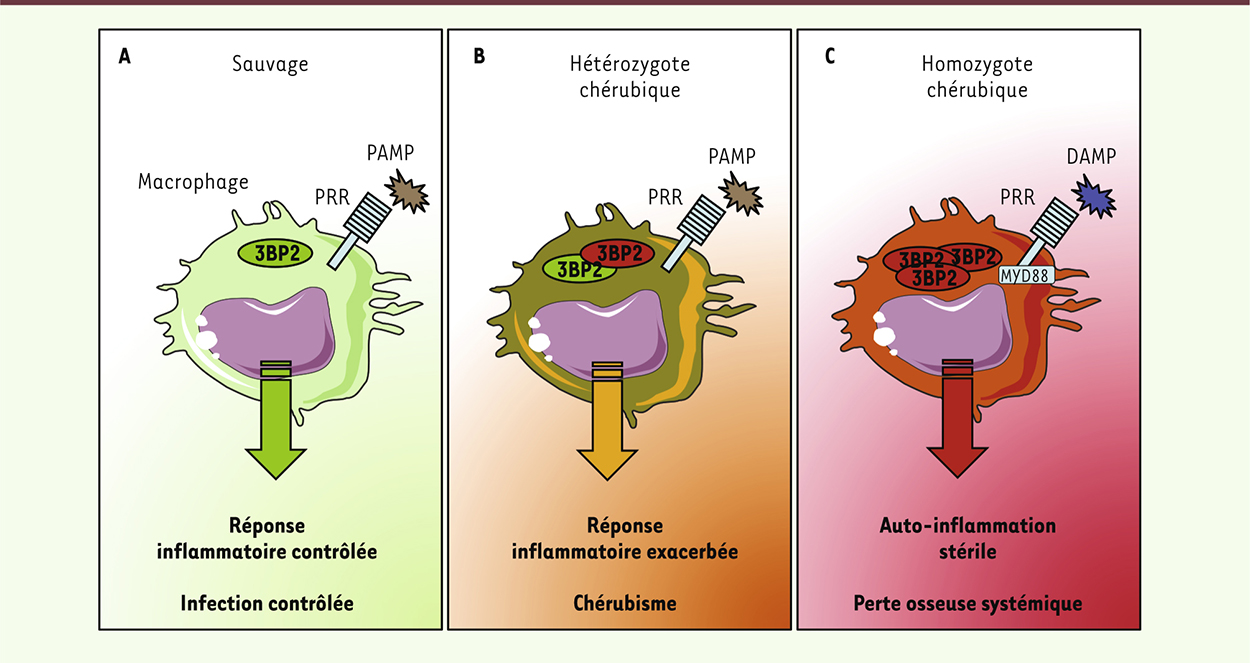
 | Figure 1.
La mutation de 3BP2 dans le chérubisme amplifie la réponse inflammatoire des macrophages. A. Dans un contexte sauvage, 3BP2 participe à la réponse des macrophages aux stimulus infectieux (motifs moléculaires associés aux pathogènes, PAMP) via des récepteurs de reconnaissance de motifs moléculaires (PRR) pour déclencher une réaction inflammatoire permettant de contrôler l’infection. B. Dans un modèle de chérubisme chez la souris, la présence d’un allèle mutant de Sh3bp2 amplifie la réaction inflammatoire des macrophages aux pathogènes, indiquant que, chez l’homme, les stimulus infectieux pourraient localement déclencher les événements pathologiques conduisant à la maladie. C. Dans un contexte homozygote qui n’existe que chez la souris, l’accumulation de protéines 3BP2 mutées déclenche une auto-inflammation stérile dépendante de la signalisation MYD88, suggérant que les motifs moléculaires associés aux dommages cellulaires (DAMP) participent aussi au développement du chérubisme. |
|
Conclusion et perspectives Définir la nature des stimulus, infectieux ou tissulaires, qui coopèrent avec les mutations de 3BP2 pour déclencher localement l’auto-inflammation pathologique à l’origine du chérubisme permettra de mieux comprendre les mécanismes moléculaires et cellulaires à l’origine de cette maladie génétique rare, et, en particulier, d’identifier précisément les multiples voies de signalisation mises en jeu. Le ciblage pharmacologique de ces voies représente clairement une stratégie thérapeutique prometteuse, comme l’atteste une étude récente [10]. Alternativement, il sera également intéressant de déterminer si le traitement des infections buccales chez le jeune patient atteint de chérubisme peut atténuer le développement de la maladie. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Reichenberger EJ, Levine MA, Olsen BR, et al. The role of SH3BP2 in the pathophysiology of cherubism . Orphanet J Rare Dis. 2012; ; 7 : :S5.. 2.
Deckert M, Tartare-Deckert S, Hernandez J, et al. Adaptor function for the Syk kinases-interacting protein 3BP2 in IL-2 gene activation . Immunity. 1998; ; 9 : :595.–605. 3.
Deckert M. L’adaptateur 3BP2. Quelle place pour cette protéine dans la signalisation des leucocytes ? Med Sci (Paris). 2006; ; 22 : :1081.–1086. 4.
GuezGuez A, Prod’homme V, Mouska X, et al. 3BP2 Adapter protein is required for receptor activator of NFkappaB ligand (RANKL)-induced osteoclast differentiation of RAW264.7 cells. . J Biol Chem. 2010; ; 285 : :20952.–20963. 5.
Ueki Y, Lin CY, Senoo M, et al. Increased myeloid cell responses to M-CSF and RANKL cause bone loss and inflammation in SH3BP2 cherubism mice . Cell. 2007; ; 128 : :71.–83. 6.
Prod’Homme V, Boyer L, Dubois N, et al. Cherubism allele heterozygosity amplifies microbe-induced inflammatory responses in murine macrophages . J Clin Invest. 2015; ; 125 : :1396.–1400. 7.
Levaot N, Voytyuk O, Dimitriou I, et al. Loss of Tankyrase-mediated destruction of 3BP2 is the underlying pathogenic mechanism of cherubism . Cell. 2011; ; 147 : :1324.–1339. 8.
Graves DT, Li J, Cochran DL. Inflammation and uncoupling as mechanisms of periodontal bone loss . J Dent Res. 2011; ; 90 : :143.–153. 9.
Yoshitaka T, Mukai T, Kittaka M, et al. Enhanced TLR-MYD88 signaling stimulates autoinflammation in SH3BP2 cherubism mice and defines the etiology of cherubism . Cell Rep. 2014; ; 8 : :1752.–1766. 10.
Kadlub N, Vazquez MP, Galmiche L, et al. The calcineurin inhibitor tacrolimus as a new therapy in severe cherubism . J Bone Miner Res. 2014; ; 30 : :878.–885. |