| |
| Med Sci (Paris). 2015 June; 31(6-7): 597–600. Published online 2015 July 7. doi: 10.1051/medsci/20153106008.Mécanismes fondamentaux de formation de fibres amyloïdes par la protéine α-synucléine dans la maladie de Parkinson Modélisation quantitative Céline Galvagnion1* and Alexander K. Buell1 1Department of Chemistry, University of Cambridge, Lensfield Road, Cambridge, CB2 1EW, Royaume-Uni MeSH keywords: Amyloïde, Humains, Techniques in vitro, Lipides, Modèles moléculaires, Maladie de Parkinson, Agrégats de protéines, Agrégation pathologique de protéines, alpha-Synucléine, composition chimique, métabolisme, pharmacocinétique, pharmacologie, anatomopathologie, effets des médicaments et substances chimiques, physiologie |
Alpha-synucléine et maladie de Parkinson Le mauvais repliement des protéines et leur agrégation sont à l’origine de nombreuses maladies dont les maladies neurodégénératives, telles la maladie d’Alzheimer et la maladie de Parkinson, et le diabète de type 2 [1]. La maladie de Parkinson touche 6,3 millions de personnes dans le monde, dont 1,2 millions en Europe et 140 000 en France1. L’une des caractéristiques de cette maladie est le dépôt d’agrégats formés par la protéine alpha-synucléine (α-syn) [2, 15]. α-syn est une petite protéine (14 kDa) présynaptique dont le rôle précis n’est pas encore établi, mais qui semble jouer un rôle dans la plasticité synaptique, plus particulièrement dans la fusion des vésicules synaptiques avec la membrane plasmique des terminaisons présynaptiques des neurones, et dans la libération de neurotransmetteurs dans l’espace intersynaptique [3]. α-syn existe sous deux formes in vivo, une forme intrinsèquement désordonnée, en solution, et une forme repliée en hélice alpha quand elle est liée aux membranes. L’équilibre entre ces deux formes joue un rôle pour la fonction d’α-syn [3]. De plus, la protéine interagit avec un grand nombre de surfaces in vitro, par exemple des nanoparticules, surfactants et bicouches lipidiques (vésicules), et son interaction avec ces surfaces peut moduler la cinétique de formation de fibres amyloïdes par α-syn [4, 5]. Enfin, il a été récemment montré qu’α-syn peut former des fibres incorporant des lipides [6]. |
Mécanisme d’agrégation d’alpha-synucléine : notre approche expérimentale Aucune description quantitative du mécanisme d’agrégation d’α-syn n’est disponible à ce jour, contrairement au travail récemment accompli pour le peptide Aβ, dont la formation de fibres amyloïdes est liée à la maladie d’Alzheimer [7, 8]. Une telle analyse serait pourtant indispensable à une meilleure compréhension, non seulement des événements précoces, mais aussi de la propagation de la maladie et des effets de chaperons ou d’autres molécules sur le mécanisme et la cinétique d’agrégation de la protéine. Dans le but de répondre à cette question, nous avons utilisé des systèmes minimalistes pour étudier le comportement de la protéine in vitro en présence de petites vésicules lipidiques ou de faibles quantités de fibres. Nous avons combiné deux approches : une approche expérimentale, dans laquelle l’influence des différents réactifs (α-syn, lipides et fibres) sur la cinétique de formation de fibres amyloïdes était systématiquement étudiée, et une approche théorique, fondée sur l’analyse cinétique de nos données expérimentales, ce qui a permis d’élaborer un modèle du mécanisme d’agrégation de la protéine ainsi que la détermination des vitesses des étapes les plus importantes du mécanisme. |
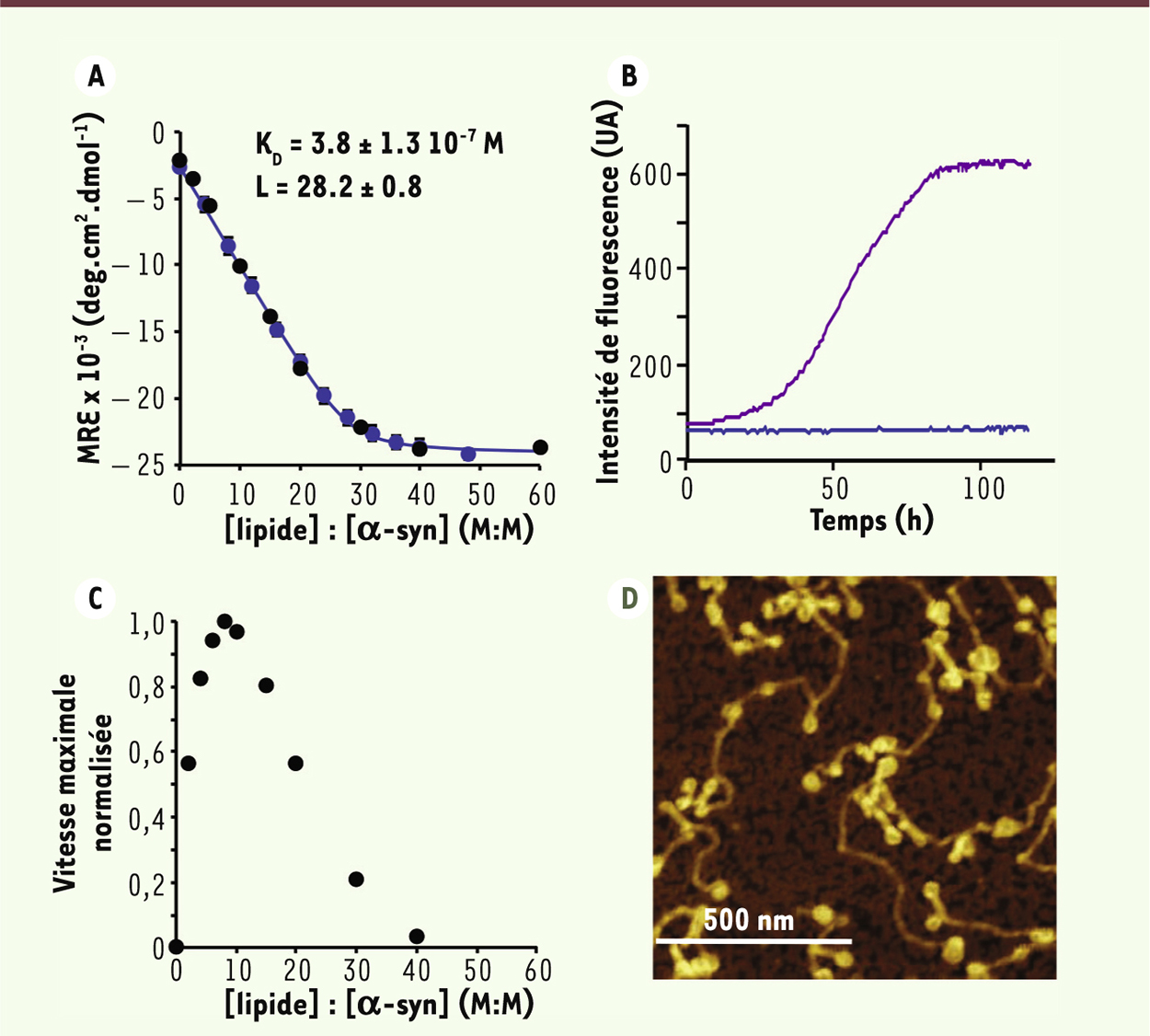
Mécanisme d’agrégation d’alpha-synucléine : nos découvertes Le rapport lipide : protéine module la cinétique de formation de fibres amyloïdes par α-syn Pour décrire quantitativement le mécanisme d’agrégation d’α-syn en présence de vésicules, nous avons d’abord caractérisé la liaison entre la protéine et les vésicules, de façon à pouvoir estimer la concentration des deux principaux réactifs (α-syn libre en solution et α-syn liée aux lipides) pour chaque rapport lipide : protéine [ 9]. En particulier, α-syn se lie aux lipides avec une affinité sub-micromolaire, et 28 molécules de lipide sont impliquées dans la liaison avec une molécule d’α-syn (Figure 1A).
 | Figure 1.
Modulation de la vitesse de formation de fibres amyloïdes d’alpha-synucléine par les vésicules lipidiques. A. Variation de l’ellipticité moyenne par acide aminé ( mean residue ellipticity, MRE) en fonction du rapport lipide : protéine (mole : mole, M : M). La concentration d’α-syn est de 20 μM et 50 μM pour les courbes bleue et noire, respectivement. B. Variation de l’intensité de la fluorescence de la molécule thioflavine-T (ThT) en fonction du temps lorsqu’α-syn (140 μM) est incubée en l’absence (courbe bleue), ou en présence de vésicules lipidiques (60 μM lipide). Note : l’intensité de la fluorescence de ThT est proportionnelle à la masse de fibres présentes en solution. C. Évolution de la vitesse maximale de formation des fibres amyloïdes en fonction du rapport lipide : protéine pour une concentration de protéine fixe de 50 μM. D. Image, mesurée par le microscope à force atomique, de fibres amyloïdes formées par α-syn après incubation de la protéine (200 μM) en présence de lipides (600 μM). Figures adaptées avec permission de © Nature publishing group [ 9]. |
Il est intéressant de noter qu’en l’absence de surfaces hydrophobes et d’agitation, α-syn ne s’agrège pas, même à des concentrations de l’ordre du millimolaire à température ambiante, bien que des fibres déjà formées croissent dans ces conditions [10]. Dans la majorité des études publiées, l’agrégation d’α-syn est étudiée sous agitation et il est maintenant établi que l’interface air-eau [11] ou les parois du récipient de réaction jouent le rôle de la surface où se passe la nucléation. Dans nos études, nous travaillons en l’absence de perturbation mécanique de façon à limiter les artéfacts créés par l’agitation, comme la fragmentation et le recyclage de noyaux formés à l’interface air-eau en solution. En présence de vésicules lipidiques, l’agrégation de la protéine est observée (Figure 1 B-D) et la vitesse d’agrégation est largement dépendante du rapport lipide : protéine (Figure 1C) [9]. En effet, la formation de fibres n’est observée ni en l’absence de vésicules (lipide : protéine = 0,
Figure 1
B-C), ni en présence d’un excès de vésicules (lipide : protéine > 40,
Figure 1C
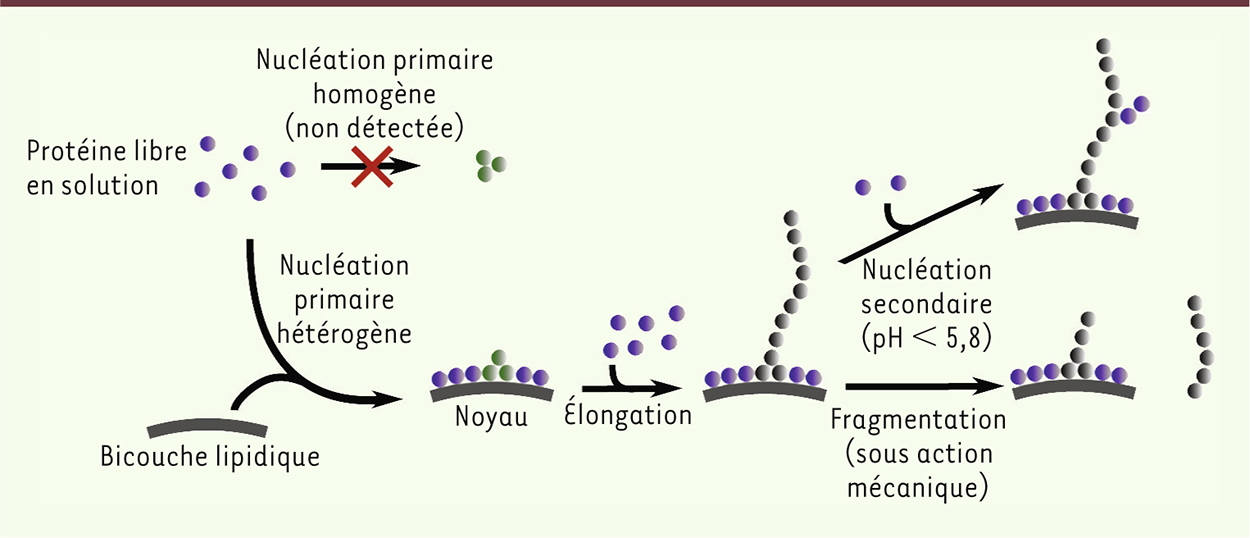
). De plus, lorsque des fibres d’α-syn sont incubées en présence d’un excès de lipides (lipide : protéine > 40), la faible concentration de protéine monomérique en équilibre avec les fibres est absorbée à la surface des vésicules, ce qui déplace l’équilibre vers la forme liée aux lipides, conduisant à la dissociation des fibres. Ces observations permettent de rationaliser la modulation de la cinétique de formation de fibres d’α-syn par les lipides jusqu’ici observée dans la littérature. Ainsi, pour des rapports lipide : protéine en dessous d’une valeur critique minimale, les réactifs limitant de la réaction d’agrégation sont les vésicules, sans lesquelles il n’y a pas de nucléation, alors que pour des rapports lipide : protéine supérieurs à une valeur critique maximale, toutes les molécules d’α-syn sont absorbées à la surface des vésicules et il ne reste plus de monomère libre en solution ; ce dernier devient le réactif limitant, sans lequel il n’y a pas de croissance des noyaux. Les vésicules induisent la formation de fibres amyloïdes en stimulant le taux de nucléation par plus de 3 ordres de grandeur L’analyse cinétique de la réaction d’agrégation de protéines révèle les étapes microscopiques déterminantes pour la réaction ainsi que leur vitesse respective. En bref, la réaction de formation de fibres amyloïdes commence par l’étape de nucléation, au cours de laquelle un nombre n c de monomères s’assemblent pour former un noyau à partir duquel une fibre peut s’allonger par l’addition successive de monomères individuels (étape d’élongation ou de croissance) [ 16]. Dans le cas d’α-syn, la réaction de formation de fibres amyloïdes en présence de vésicules peut dépendre de deux réactifs : la protéine libre en solution et la protéine liée aux vésicules. Nous avons donc mesuré la vitesse de la réaction de formation des fibres amyloïdes en faisant varier systématiquement, soit la concentration de la protéine libre en solution, soit celle de la protéine liée aux vésicules. À partir de l’ensemble de nos données biophysiques, nous avons ensuite considéré le modèle le plus simple pour décrire nos données, qui consiste en une première étape de nucléation à la surface des vésicules (nucléation primaire hétérogène) suivie d’une étape d’élongation (Figure 2) [9]. Ce modèle décrit très bien l’ensemble de nos données et offre pour la première fois une description quantitative de l’effet de la présence des vésicules sur la cinétique de formation de fibres d’α-syn. Celui-ci consiste en l’accélération par plus de 3 ordres de grandeur du taux de nucléation, en comparaison de la réaction en l’absence de lipides.
 | Figure 2.
Schéma du mécanisme d’agrégation d’a -syn proposé à partir des résultats obtenus par nos deux études [ 9, 10] Figure adaptée avec permission de © Nature publishing group [ 9]. |
Les conditions chimiques et physiques de la réaction d’agrégation déterminent si les fibres d’α-syn peuvent se multiplier Dans le cas des maladies d’Alzheimer et de Parkinson, Braak a montré que la pathologie commence dans une région précise du cerveau (notamment le bulbe olfactif pour la maladie de Parkinson), puis se propage à l’ensemble du cerveau lors de l’évolution de la maladie [ 12]. De plus, l’observation de corps de Lewy 2 dans des précurseurs neuronaux issus de cellules souches embryonnaires dix ans après leur transplantation chez des patients atteints de la maladie de Parkinson renforce l’hypothèse de la propagation d’agrégats d’une cellule neuronale à une autre [ 13]. Pour étudier les phénomènes de propagation et multiplication de fibres in vitro, nous avons incubé de très faibles quantités de fibres (nanomolaire) en présence d’un large excès d’α-syn monomérique (micromolaire) [ 10]. À pH neutre et en l’absence d’agitation, le principal phénomène observé est la croissante lente de fibres via l’addition de protéine monomérique une à une. En revanche, à pH légèrement plus acide (pH < 5,8), un autre phénomène, appelé nucléation secondaire, qui entraîne la multiplication exponentielle du nombre de fibres en solution, domine la cinétique de formation de fibres. Il consiste en la multiplication autocatalytique de fibres via la formation de nouveaux noyaux à la surface de fibres. Plus précisément, nous avons montré que la vitesse de la réaction de nucléation secondaire augmente d’au moins 4 ordres de grandeur lorsque le pH diminue de 7,4 à 5,5, une variation qui peut être observée à l’intérieur d’endosomes lors de leur maturation [ 14]. Il est important de noter que, dans ces conditions de pH acide, la présence d’une seule fibre au sein d’un endosome est potentiellement suffisante pour transformer l’intégralité des molécules de protéine α-syn monomériques présentes en fibres amyloïdes. |
Nos deux études expérimentales systématiques [9, 10] nous ont permis de mettre en évidence les deux étapes fondamentales du mécanisme de formation de fibres amyloïdes par la protéine α-syn, processus lié à la maladie de Parkinson. Tout d’abord, nous avons montré que les vésicules lipidiques induisent l’étape d’agrégation d’α-syn en stimulant le taux de nucléation par au moins 3 ordres de grandeur. Le fait que l’engagement de cette étape soit observé uniquement pour de faibles rapports lipide : protéine est particulièrement intéressant dans la mesure où le doublement et le triplement du gène d’α-syn, qui entraînent une surproduction de la protéine in vivo, sont des facteurs génétiques liés à l’apparition précoce de la maladie de Parkinson chez les patients porteurs de ces mutations [17]. Ensuite, nous avons découvert qu’à pH légèrement acide, les fibres d’α-syn ont un taux de prolifération autocatalytique très élevé, ce qui pourrait jouer un rôle dans la propagation de la pathologie dans la maladie de Parkinson. Bien que ces expériences aient été conduites dans des conditions très différentes de celles qui prévalent dans une cellule neuronale, nous sommes convaincus qu’une compréhension fondamentale du mécanisme d’agrégation d’α-syn est un prérequis indispensable à une meilleure compréhension de la maladie, ainsi qu’à la mise en place de tests diagnostiques précoces et de thérapies efficaces. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Knowles TP, Vendruscolo M, Dobson CM. The amyloid state and its association with protein misfolding diseases . Nat Rev Mol Cell Biol. 2014; ; 15 : :384.–396. 2.
Spillantini MG, Schmidt ML, Lee VM, et al. Alpha-synuclein in Lewy bodies . Nature. 1997; ; 388 : :839.–840. 3.
Bellucci A, Zaltieri M, Navarria L, et al. From alpha-synuclein to synaptic dysfunctions: new insights into the pathophysiology of Parkinson’s disease . Brain Res. 2012; ; 1476 : :183.–202. 4.
Fink AL. The aggregation and fibrillation of alpha-synuclein . Acc Chem Res. 2006; ; 39 : :628.–634. 5.
Grey M, Dunning CJ, Gaspar R, et al. Acceleration of alpha-synuclein aggregation by exosomes . J Biol Chem. 2015; ; 290 : :2969.–2982. 6.
Hellstrand E, Nowacka A, Topgaard D, et al. Membrane lipid co-aggregation with alpha-synuclein fibrils . PLoS One. 2013; ; 8 : :e77235.. 7.
Cohen SI, Linse S, Luheshi LM, et al. Proliferation of amyloid-beta42 aggregates occurs through a secondary nucleation mechanism . Proc Natl Acad Sci USA. 2013; ; 110 : :9758.–9763. 8.
Cohen SI, Arosio P, Presto J, et al. A molecular chaperone breaks the catalytic cycle that generates toxic Abeta oligomers . Nat Struct Mol Biol. 2015; ; 22 : :207.–213. 9.
Galvagnion C, Buell AK, Meisl G, et al. Lipid vesicles trigger alpha-synuclein aggregation by stimulating primary nucleation . Nat Chem Biol. 2015; ; 11 : :229.–234. 10.
Buell AK, Galvagnion C, Gaspar R, et al. Solution conditions determine the relative importance of nucleation and growth processes in alpha-synuclein aggregation . Proc Natl Acad Sci USA. 2014; ; 111 : :7671.–7676. 11.
Campioni S, Carret G, Jordens S, et al. The presence of an air-water interface affects formation and elongation of alpha-synuclein fibrils . J Am Chem Soc. 2014; ; 136 : :2866.–2875. 12.
Braak H, Del Tredici K, Rub U, et al. Staging of brain pathology related to sporadic Parkinson’s disease . Neurobiol Aging. 2003; ; 24 : :197.–211. 13.
Brundin P, Li JY, Holton JL, et al. Research in motion: the enigma of Parkinson’s disease pathology spread . Nat Rev Neurosci. 2008; ; 9 : :741.–745. 14.
Gruenberg J. The endocytic pathway: a mosaic of domains . Nat Rev Mol Cell Biol. 2001; ; 2 : :721.–730. 15.
Corti O, Brice A. La maladie de Parkinson : que nous apprennent les gènes responsables des formes familiales ? Med Sci (Paris). 2003; ; 19 : :613.–619. 16.
Cohen SI, Vendruscolo M, Dobson CM, et al. From macroscopic measurements to microscopic mechanisms of protein aggregation . J Mol Biol. 2012; ; 421 : :160.–171. 17.
Singleton AB, Farrer M, Johnson J, et al. alphasynuclein locus triplication causes Parkinson’s disease . Science. 2003; ; 302 : :841.. |