| |
| Med Sci (Paris). 2015 June; 31(6-7): 604–606. Published online 2015 July 7. doi: 10.1051/medsci/20153106010.Modulateurs de transport nucléaire Traitement prometteur contre la sclérose en plaques Olivier Herbin1* and Jeffery D. Haines2 1Department of medicine/clinical immunology, the immunology institute, Icahn school of medicine at Mount Sinai, Mount Sinai School of Medicine, 1 Gustave L. Levy Place, box 1089, 10029New York, NY, États-Unis 2Department of neuroscience, Icahn school of medicine at Mount Sinai, New York, NY, États-Unis MeSH keywords: Transport nucléaire actif, Noyau de la cellule, Humains, Immunomodulation, Caryophérines, Thérapie moléculaire ciblée, Sclérose en plaques, Neuroprotecteurs, Récepteurs cytoplasmiques et nucléaires, Jeune adulte, effets des médicaments et substances chimiques, métabolisme, antagonistes et inhibiteurs, méthodes, traitement médicamenteux, pharmacologie, usage thérapeutique |
La sclérose en plaques (SEP) est une maladie auto-immune chronique du système nerveux central. L’inflammation induite par le système immunitaire conduit à une démyélinisation et une dégénérescence neuronale localisée, entraînant l’apparition ou l’aggravation de handicaps irréversibles. La SEP est la maladie neurologique la plus répandue chez les jeunes adultes, elle affecte plus de 2,3 millions de personnes dans le monde [1]. Il existe deux formes principales de la maladie : récurrente-rémittente et progressive. La forme récurrente-rémittente, la plus courante, se définit par des poussées qui induisent l’apparition de symptômes, entrecoupées de rémissions complètes ou partielles. La forme progressive peut être primaire ou secondaire (lorsqu’elle succède à la forme récurrente-rémittente). Elle se caractérise par une lente accumulation de handicaps, sans poussées ni remissions bien définies. Les médicaments actuels contre la SEP ciblent uniquement les mécanismes inflammatoires [2, 3], ils ne permettent pas de lutter contre la neurodégénéresence associée et sont particulièrement peu efficaces dans les formes progressives de la maladie. Il est donc crucial de développer de nouveaux traitements réduisant les dommages neuronaux. |
La protéine CRM1 est surexprimée dans le tissu cérébral des personnes atteintes de SEP Les échanges bidirectionnels entre le cytosol et le noyau des cellules sont contrôlés par deux types de protéines : les importines et les exportines, qui se lient aux molécules à transporter pour permettre leur passage à travers le pore nucléaire [4]. Les échanges nucléocytoplasmiques, équilibrés dans une cellule saine, peuvent être perturbés dans certaines pathologies, occasionnant une accumulation anormale de molécules dans le noyau ou le cytoplasme. Ainsi, des études antérieures ont suggéré qu’un transport nucléaire perturbé entraînait une altération des neurones dans plusieurs maladies neurologiques [5]. La molécule exportine 1 (CRM1 ; chromosome region maintenance 1, ou exportin1 ou Xpo1) a été identifiée comme essentielle au processus de neurodégénérescence associé à la SEP [6]. Nous nous sommes donc interrogés sur l’intérêt du ciblage de CRM1 comme potentielle stratégie thérapeutique contre la SEP. Nous avons d’abord comparé l’expression de CRM1 dans des lésions démyélinisées présentant d’importants dégâts axonaux, et des régions saines dans des biopsies de cerveaux de personnes atteintes de SEP progressive. CRM1 était nettement plus exprimée dans les régions lésées que dans les régions normales. En outre, l’analyse par western blot révéla une expression plus importante de CRM1 dans des extraits protéiques de substance grise provenant de patients atteints de SEP progressive, que dans les extraits provenant de patients contrôles, indiquant que des concentrations élevées de cette protéine sont associées à la SEP. Nous avons alors émis l’hypothèse selon laquelle l’inhibition de CRM1 pouvait avoir un effet protecteur dans cette maladie neurologique. Nous avons donc sélectionné deux inhibiteurs chimiques de CRM1 : KPT-276 et KPT-350, qui offrent plusieurs avantages : ils ne sont pas toxiques, traversent la barrière hémato-encéphalique et peuvent être administrés par voie orale [7]. |
Effet protecteur des inhibiteurs de CRM1 dans un modèle murin de sclérose en plaques Afin de tester le potentiel thérapeutique des inhibiteurs de CRM1, nous avons utilisé le modèle d’encéphalomyélite auto-immune expérimentale (EAE), un modèle murin très couramment employé pour étudier les mécanismes fondamentaux de la SEP et tester des candidats médicaments en phase préclinique. La maladie est induite par immunisation avec de la myéline totale ou des protéines de la myéline. La réaction immunitaire détruit les gaines de myéline entourant les axones. Les symptômes, continus et progressifs, s’installent en quelques jours, débutant par une atonie de la queue et pouvant aboutir à une paralysie complète de l’animal. Nous avons donc induit une encéphalomyélite auto-immune expérimentale chez des souris, puis administré KPT-276 ou KPT-350 une fois établie la perte de motricité des membres postérieurs. Alors qu’une paralysie complète s’installait chez les souris recevant le véhicule pharmaceutique1, les souris recevant KPT-276 ou KPT-350 évoluaient vers une rémission partielle de leurs symptômes. Le traitement préventif des souris (avant l’induction de l’encéphalomyélite) a également permis de retarder l’apparition des symptômes et d’en diminuer la gravité. |
Immunomodulation induite par les inhibiteurs de CRM1 Afin de comprendre comment les inhibiteurs de CRM1 permettent d’améliorer la progression de l’EAE, nous avons analysé l’infiltration des cellules immunitaires dans le système nerveux central des souris traitées et contrôles. Nous avons observé une réduction drastique des cellules inflammatoires, essentiellement lymphocytes B et T, chez les souris traitées avec KPT-276 ou KPT-350 par rapport aux animaux recevant le véhicule. L’analyse parallèle des cellules immunitaires en périphérie chez les souris traitées a montré une forte réduction des lymphocytes, mais également des cellules de la lignée myéloïde (monocytes, neutrophiles, cellules dendritiques). Ce résultat indique que les inhibiteurs de CRM1 induisent une immunomodulation qui ne se limite pas à un type leucocytaire particulier. |
Effet neuroprotecteur des inhibiteurs de CRM1 Nous avons fait une observation intéressante : chez les animaux ayant reçu les inhibiteurs de CRM1 au cours de l’EAE, les neurones étaient dépourvus de myéline, mais d’apparence toujours saine, alors que la démyélinisation entraîne habituellement la mort neuronale. L’expression de CRM1 étant ubiquitaire, nous nous sommes demandés si l’effet protecteur observé pouvait également être le résultat d’un effet direct sur les neurones. Afin de tester cette hypothèse, nous avons utilisé les propriétés neurocytotoxiques de l’acide kaïnique2 afin d’induire dans l’hippocampe une dégénérescence neuronale indépendante d’une réponse immunitaire [8]. Alors que chez les souris contrôles, l’acide kaïnique entraînait une dégénérescence neuronale, cet effet neurotoxique était bloqué chez les souris recevant KPT-276 ou KPT-350. Pour confirmer l’effet neuroprotecteur lié à l’inhibition de CRM1, nous avons ensuite utilisé un lentivirus contenant un petit ARN en épingle à cheveux capable de réduire l’expression de CRM1 dans des neurones en culture. Dans ces conditions, l’acide kaïnique était incapable d’induire la dégénérescence de ces neurones par comparaison avec les échantillons de neurones contrôles. |
Les cibles moléculaires des inhibiteurs de CRM1 Finalement, afin de déterminer les mécanismes moléculaires associés à l’effet neuroprotecteur des inhibiteurs de CRM1, nous avons utilisé la spectrométrie de masse pour analyser les molécules accumulées dans le cytoplasme de neurones rendus dégénérescents en culture. Parmi les molécules identifiées, nous avons sélectionné deux protéines - TAU et NRF2 - car possédant une séquence d’exportation nucléaire nécessaire à leur transport par les exportines et parce que leur localisation cytoplasmique a pu être confirmée par western blot sur des échantillons de neurones dégénérescents en culture ou provenant de souris EAE. TAU est une protéine impliquée dans la stabilisation des microtubules et son accumulation cytoplasmique entraîne une perturbation du cytosquelette. L’exportation de NRF2 dans le cytoplasme perturbe la réponse cellulaire au stress oxydant. Ainsi, ces résultats suggèrent que les inhibiteurs de CRM1 exercent un effet neuroprotecteur, en retenant TAU et NRF2 dans le noyau des neurones soumis à un stimulus neurodégénératif, grâce au maintien de l’intégrité du cytosquelette neuronal et en luttant plus efficacement contre le stress oxydant (Figure 1).
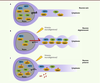 | Figure 1.
Mécanismes de neuroprotection par les inhibiteurs de CRM1. A. CRM1 permet l’export nucléaire de TAU et NRF2 contribuant à une distribution nucléocytoplasmique équilibrée dans un neurone sain. B. Un stimulus neurodégénératif (acide kaïnique, glutamate, démyélinisation) induit une accumulation de TAU et NRF2 dans le cytoplasme, entraînant la mort du neurone. C. KPT empêche CRM1 de se lier à TAU et NRF2, limitant leur accumulation dans le cytoplasme et favorisant la protection neuronale. |
|
Bénéfices des inhibiteurs de CRM1 par rapport aux thérapies actuelles Dans cette étude, nous avons montré que les inhibiteurs de CRM1 limitent fortement la progression de handicaps dans un modèle préclinique de SEP. Cette protection provient d’un double effet : (1) limitation de l’agression par le système immunitaire, et (2) réduction de la mort des neurones « stressés ». Ainsi, les inhibiteurs de CRM1 semblent avoir un avantage sur les traitements actuels qui ne ciblent que les processus inflammatoires. Cependant, pour évaluer les bénéfices chez l’homme, des études d’efficacité et d’innocuité chez des personnes atteintes de maladies démyélinisantes sont maintenant nécessaires. Enfin, le développement de thérapies visant à remyéliniser les neurones, en association avec l’inhibition de CRM1, pourrait fournir un traitement particulièrement efficace contre la SEP. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions le Dr Sarah Moyon pour sa lecture critique du manuscrit. Nous remercions également la Mount Sinai School of Medicine (OH) pour l’attribution du prix Helmsley, la Société canadienne de la sclérose en plaques pour l’attribution d’une bourse et le Fonds de la recherche en santé du Québec (JDH) pour son soutien financier.
|
Footnotes |
1.
Compston A, Coles A. Multiple sclerosis . Lancet. 2008; ; 372 : :1502.–1517. 2.
Michel L, Larochelle C, Prat A. Update on treatments in multiple sclerosis . Presse Med. 2015; ; 44 : :e137.–e151. 3.
Louapre C, Maillart E, Papeix C, Lubetzki C. Nouveautés thérapeutiques et stratégies émergentes dans la sclérose en plaques . Med Sci (Paris). 2013; ; 29 : :1105.–1110. 4.
Fried H, Kutay U. Nucleocytoplasmic transport: taking an inventory . Cell Mol Life Sci. 2003; ; 60 : :1659.–1688. 5.
Dormann D, Rodde R, Edbauer D, et al. ALS-associated fused in sarcoma (FUS) mutations disrupt transportin-mediated nuclear import . EMBO J. 2010; ; 29 : :2841.–2857. 6.
Kim JY, Shen S, Dietz K, et al. HDAC1 nuclear export induced by pathological conditions is essential for the onset of axonal damage . Nat Neurosci. 2010; ; 13 : :180.–189. 7.
Haines JD, Herbin O, de La Hera B, et al. Nuclear export inhibitors avert progression in preclinical models of inflammatory demyelination . Nat Neurosci. 2015; ; 18 : :511.–520. 8.
Bloss EB, Hunter RG. Hippocampal kainate receptors . Vitam Horm. 2010; ; 82 : :167.–184. |