| |
| Med Sci (Paris). 2015 August; 31(8-9): 720–722. Published online 2015 September 4. doi: 10.1051/medsci/20153108006.Les antiplaquettaires : quoi de neuf ? Cécile Oury,1* Souad Rahmouni,2 and Patrizio Lancellotti1,3 1GIGA-sciences cardiovasculaires, département de cardiologie, Université de Liège, avenue de l’Hôpital1, Sart Tilman, B-4000Liège, Belgique 2Unité d’immunologie et maladies infectieuses, GIGA-transduction du signal, Université de Liège, 4000Liège, Belgique 3GVM Care and Research, E.S. Health Science Foundation, Lugo (RA), Italie MeSH keywords: Humains, Antiagrégants plaquettaires, usage thérapeutique |
Les antiplaquettaires actuels : indications et limitations L’activation et l’agrégation des plaquettes jouent un rôle central dans la formation des thrombi causée par la rupture des plaques d’athérome sur la paroi des artères. Ce phénomène, appelé athérothrombose, se manifeste cliniquement par un syndrome coronaire aigu - pouvant évoluer vers l’infarctus du myocarde -, un accident vasculaire cérébral ischémique ou une artériopathie oblitérante des membres inférieurs. Les plaquettes représentent une cible thérapeutique de choix dans la prise en charge de ces maladies athérothrombotiques [1]. Les médicaments antiplaquettaires ont prouvé leur efficacité et, combinés à la chirurgie et aux mesures hygiéno-diététiques, ont contribué à limiter la morbidité et la mortalité associées à ces maladies. Les ventes mondiales d’antiplaquettaires se sont élevées à plus de 11 milliards d’euros en 2010. Porté par le vieillissement de la population, la mondialisation et l’accès grandissant aux soins des populations des pays émergents, le marché des antiplaquettaires ne cesse de croître. Malgré une action bénéfique incontestable pour les patients, les antiplaquettaires les plus utilisés, l’aspirine et les antagonistes du récepteur P2Y12 (clopidogrel) [11] et de l’intégrine αIIbβ3 [12], ont pour principal inconvénient d’entraîner des saignements, ce qui limite considérablement leur utilisation. De plus, d’autres limitations sont progressivement apparues, exprimées pharmacologiquement par le vocable « résistance » et cliniquement par la survenue de complications thrombotiques [2]. Ainsi, malgré les progrès des 20 dernières années dans sa prévention et son traitement, l’athérothrombose demeure, en raison de ses principales complications telles que l’infarctus du myocarde et l’accident vasculaire cérébral, la première cause de décès dans le monde et une cause majeure de morbidité, d’invalidité et de coûts [3, 4]. Le risque résiduel chez les patients survivant à un premier évènement aigu reste très élevé (mortalité à 5 ans de 20 %) [5]. Plusieurs tentatives récentes pour améliorer l’approche pharmacologique de la thérapie anti-athérothrombotique ont échoué ou ont entraîné des effets secondaires inacceptables. Aujourd’hui, il semble évident que des approches thérapeutiques innovantes sont la clé du progrès. Ces approches thérapeutiques devraient prendre davantage en considération le rapport risque/bénéfice des interventions antithrombotiques, et devraient être adaptées aux caractéristiques propres de l’individu (médecine personnalisée). De plus, les cofacteurs ou comorbidités associés à l’athérothrombose, tels que, par exemple, les maladies rénales chroniques, les troubles respiratoires du sommeil ou encore les maladies parodontales chroniques, devraient faire l’objet de plus d’attention. |
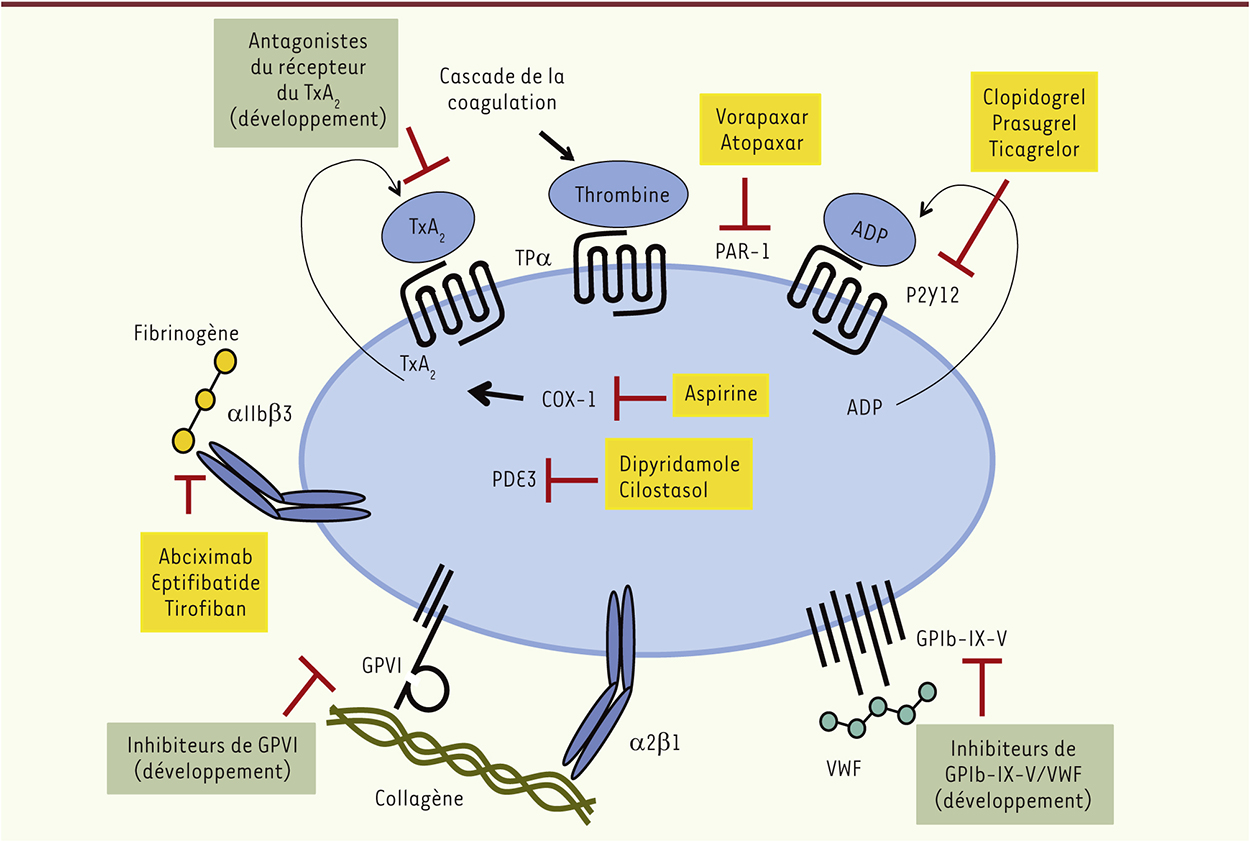
Les nouveaux antiplaquettaires De nouveaux inhibiteurs du récepteur de l’ADP, P2Y12 [11], sont actuellement disponibles : le prasugrel (une prodrogue de la classe des thiénopyridines) et le ticagrelor (cyclo-pentyl-triazolo-pyrimidine, un antagoniste direct du récepteur) (Figure 1) [9]. Ils ont été développés pour pallier les limitations et problèmes de résistance liés au clopidogrel. Ces nouvelles molécules ont un mode d’action plus rapide et sont plus efficaces que le clopidogrel chez les patients atteints de syndromes coronaires aigus, mais ils provoquent aussi plus de saignements. Dans le but d’implémenter les approches antithrombotiques existantes, l’inhibition d’autres voies majeures de l’activation plaquettaire (non ciblées par l’aspirine, les inhibiteurs de P2Y12 ou les antagonistes de l’αIIbβ3) fait l’objet de recherches importantes. Ainsi, le vorapaxar, un inhibiteur du récepteur de la thrombine PAR-1, a récemment été approuvé par la FDA (Food and drug administration) pour diminuer le risque d’évènements thrombotiques chez les patients ayant subi un infarctus du myocarde ou un évènement artériel périphérique [10]. Des antagonistes du récepteur du thromboxane A2 sont actuellement en développement (Terutroban, EV-077) [13], mais il semblerait que ceux-ci ne sont pas plus avantageux que l’aspirine utilisée à faible dose (en termes d’efficacité et d’effets secondaires). Il n’existe actuellement aucun médicament qui cible les récepteurs d’adhésion des plaquettes au collagène, composant majeur de la matrice sous-endothéliale, ou au facteur von Willebrand (VWF). Plusieurs molécules sont en développement. Elles comprennent notamment : (1) un aptamère dirigé contre le domaine A1 du VWF, inhibant sa liaison à son récepteur GPIb (ARC-1779) ; (2) le caplacizumab (ALX-0081), un fragment d’anticorps bivalent humanisé (nanobody) ciblant le domaine A1 du VWF ; (3) l’anfibatide, un composé extrait du venin de vipère capable d’inhiber GPIb. Les stratégies explorées pour inhiber la voie du collagène incluent des composés qui déplètent le récepteur GPVI (glycoprotéine VI, récepteur du collagène) de la surface des plaquettes, des anticorps bloquants, ou encore des dérivés peptidiques qui se lient au collagène prévenant ainsi son interaction avec le VWF (Revacept) [10].
 | Figure 1.
Les antiplaquettaires actuels (cadres jaunes) et en développement (cadres verts). L’inhibition de la fonction plaquettaire pour une approche thérapeutique antithrombotique implique l’utilisation de composés capables d’inhiber l’agrégation (antagonistes de l’intégrine αIIbβ3, récepteur du fibrinogène), l’adhésion aux matrices sous-endothéliales (collagène, facteur von Willebrand [VWF]), ou les voies majeures de l’amplification de l’activation/agrégation (récepteurs de l’ADP, P2Y12 ; de la thrombine, PAR-1 ; et du thromboxane A2 [TxA2], TPα ; et la cyclooxygénase-1, COX-1). L’inhibition de la phosphodiestérase PDE3 augmente les taux d’AMP cyclique dans les plaquettes, ce qui inhibe leur activation induite par l’ADP. |
|
DUSP3 : une cible potentielle pour des antiplaquettaires novateurs Les projets de notre équipe de recherche visent à explorer des voies thérapeutiques innovantes grâce à une meilleure compréhension des mécanismes moléculaires de l’activation et de l’agrégation des plaquettes. Récemment, les protéines tyrosine phosphatases ont émergé en tant que régulateurs critiques des fonctions plaquettaires [6]. Notre étude publiée dans la revue Circulation révèle, pour la première fois, l’implication d’une phosphatase à double spécificité, appelée DUSP3 (dual specificity protein phosphatase 3), dans la signalisation des plaquettes et dans la thrombose artérielle [7]. Cette phosphatase est fortement exprimée dans les plaquettes humaines et murines. Les plaquettes des souris dont le gène codant pour la phosphatase DUSP3 a été invalidé (DUSP3-knock-out, KO) présentent un défaut sélectif d’agrégation et de sécrétion quand elles sont activées via le récepteur du collagène GPVI et via le récepteur CLEC-2 (C-type lectin-like receptor 2). Les souris DUSP3-KO sont plus résistantes à l’embolie pulmonaire induite par injection intraveineuse de collagène et d’adrénaline que les souris sauvages. Par ailleurs, chez la souris, la formation du thrombus induite par une lésion de l’endothélium de l’artère carotide par le chlorure de fer est fortement altérée en l’absence de DUSP3. Néanmoins, le temps de saignement1 des souris DUSP3-KO est identique à celui des souris sauvages, indiquant que l’absence de DUSP3 préserve l’hémostase primaire. Au niveau moléculaire, l’absence de DUSP3 altère la phosphorylation sur tyrosine de la protéine kinase Syk et réduit en conséquence la phosphorylation de la phospholipase Cγ-2 et les flux calciques. Le criblage d’une banque de plus de 300 000 petites molécules nous a permis d’identifier une molécule capable d’inhiber spécifiquement l’activité phosphatase de DUSP3 et l’agrégation de plaquettes humaines en réponse au collagène et à la rhodocytine (un agoniste sélectif de CLEC-2), mimant ainsi le déficit de DUSP3 dans les souris. Notre étude démontre, dès lors, qu’une phosphatase impliquée dans la signalisation plaquettaire peut être la cible d’inhibiteurs pharmacologiques dotés de propriétés antithrombotiques. Nos résultats chez la souris suggèrent que l’inhibition de DUSP3 pourrait prévenir les événements thrombotiques sans pour autant augmenter le risque hémorragique. Notre travail ouvre la voie à l’élaboration de nouvelles stratégies antithrombotiques qui cibleraient les protéines tyrosine phosphatases plaquettaires, et qui pourraient s’avérer plus sûres et plus efficaces que les traitements actuels [8]. |
Les défis de l’industrie pharmaceutique L’industrie pharmaceutique doit aujourd’hui surmonter des défis majeurs : l’explosion des coûts de recherche et développement et un environnement réglementaire de plus en plus contraignant, où la seule démonstration de la « non-infériorité » d’un nouvel agent par rapport au traitement conventionnel ne suffit plus à obtenir l’autorisation de mise sur le marché. À ces difficultés s’ajoutent les pressions des agences de santé nationales qui, soucieuses de contenir leurs dérives budgétaires, voient dans la baisse du prix des médicaments et la taxation accrue des industriels de puissants leviers d’action. Dans un contexte de tensions, le retour sur investissement est plus que jamais incertain et la prise de risque doit être mûrement réfléchie. Tout l’enjeu est d’identifier des pistes innovantes susceptibles de mener à des candidats médicaments aux modes d’actions originaux et ayant une réelle valeur ajoutée clinique. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
C.O. et S.R. sont chercheurs qualifiés du FRS-FNRS (Fonds national pour la recherche scientifique, Belgique).
|
Footnotes |
1.
Michelson AD. Antiplatelet therapies for the treatment of cardiovascular disease . Nat Rev Drug Discov. 2010; ; 9 : :154.–169. 2.
Franchi F, Angiolillo DJ. Novel antiplatelet agents in acute coronary syndrome . Nat Rev Cardiol. 2015; ; 12 : :30.–47. 3.
Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the global burden of disease study 2010 . Lancet. 2012; ; 380 : :2095.–2128. 4.
Nichols M, Townsend N, Scarborough P, Rayner M. Cardiovascular disease in Europe 2014: epidemiological update . Eur Heart J. 2014; ; 35 : :2950.–2959. 5.
Fox KA, Carruthers KF, Dunbar DR, et al. Underestimated and under-recognized: the late consequences of acute coronary syndrome (GRACE UK-Belgian study) . Eur Heart J. 2010; ; 31 : :2755.–2764. 6.
Senis YA. Protein-tyrosine phosphatases: a new frontier in platelet signal transduction . J Thromb Haemost. 2013; ; 11 : :1800.–1813. 7.
Musumeci L, Kuijpers MJ, Gilio K, et al. Dual-specificity phosphatase 3 deficiency or inhibition limits platelet activation and arterial thrombosis . Circulation. 2015; ; 131 : :656.–668. 8.
Tautz L, Senis YA, Oury C, Rahmouni S. Perspective: tyrosine phosphatases as novel targets for antiplatelet therapy . Bioorg Med Chem. 2015; ; 23 : :2786.–2797. 9.
Cattaneo M. New P2Y(12) inhibitors . Circulation. 2010; ; 121 : :171.–179. 10.
Ungerer M, Munch G. Novel antiplatelet drugs in clinical development . Thromb Haemost. 2013; ; 110 : :868.–875. 11.
Boeynaems JM, Communi D, Suarez N, et al. Les récepteurs P2Y des nucléotides extracellulaires : du clonage à la physiologie . Med Sci (Paris). 2002; ; 18 : :965.–973. 12.
Collet JP, Choussat R, Montalescot G. L’agrégation plaquettaire et ses inhibiteurs dans les syndromes coronariens aigus . Med Sci (Paris). 2004; ; 20 : :291.–297. 13.
Verbeuren TJ. Terutroban et récepteurs TP endothéliaux dans l’athérogenèse . Med Sci (Paris). 2006; ; 22 : :437.–443. |