| |
| Med Sci (Paris). 2015 August; 31(8-9): 730–733. Published online 2015 September 4. doi: 10.1051/medsci/20153108010.Le VIH-1 pilote la migration des macrophages Christel Vérollet,1,2** Shanti Souriant,1,2 Brigitte Raynaud-Messina,1,2 and Isabelle Maridonneau-Parini1,2* 1CNRS UMR 5089 ; IPBS (Institut de pharmacologie et de biologie structurale), BP64182, 205, route de Narbonne, 31077Toulouse Cedex 04, France 2Université de Toulouse ; UPS ; IPBS ; F-31077Toulouse, France MeSH keywords: Mouvement cellulaire, VIH-1 (Virus de l'Immunodéficience Humaine de type 1), Humains, Macrophages, Podosomes, pathogénicité, physiologie, virologie |
Le VIH-1, un virus qui utilise les macrophages pour pénétrer dans les tissus Le virus de l’immunodéficience humaine (VIH) est responsable du syndrome de l’immunodéficience acquise (Sida). Il cible majoritairement les cellules du système immunitaire (lymphocytes T CD4 et monocytes/macrophages), grâce auxquelles il peut disséminer dans l’organisme [1, 2]. Alors qu’il exerce un effet cytotoxique dans les lymphocytes T, il est bien toléré dans les macrophages. Les traitements actuels (trithérapie antivirale) permettent de contrôler la charge virale et de diminuer considérablement la mortalité due à l’infection, mais ils ne permettent pas l’élimination complète du virus. Un des problèmes est la difficulté à éliminer certaines cellules infectées, appelées réservoirs viraux [11]. L’existence de ces réservoirs oblige les patients à être traités tout au long de leur vie. Une sous-population minoritaire de lymphocytes T CD4 « mémoire », et les macrophages, font partie de ces réservoirs [3]. Les macrophages infectés présents dans les tissus sont peu accessibles aux traitements, et ont une durée de vie très longue. Leur accumulation dans certains tissus, dont le cerveau, est corrélée à la sévérité de la maladie. Aussi, une stratégie thérapeutique qui inhiberait l’infiltration des macrophages infectés dans les tissus constituerait une avancée majeure. Nous avons donc étudié l’effet du VIH-1 sur la migration des macrophages, et mis en évidence (article récemment publié dans Blood [2]) une reprogrammation des capacités migratoires des macrophages infectés. |
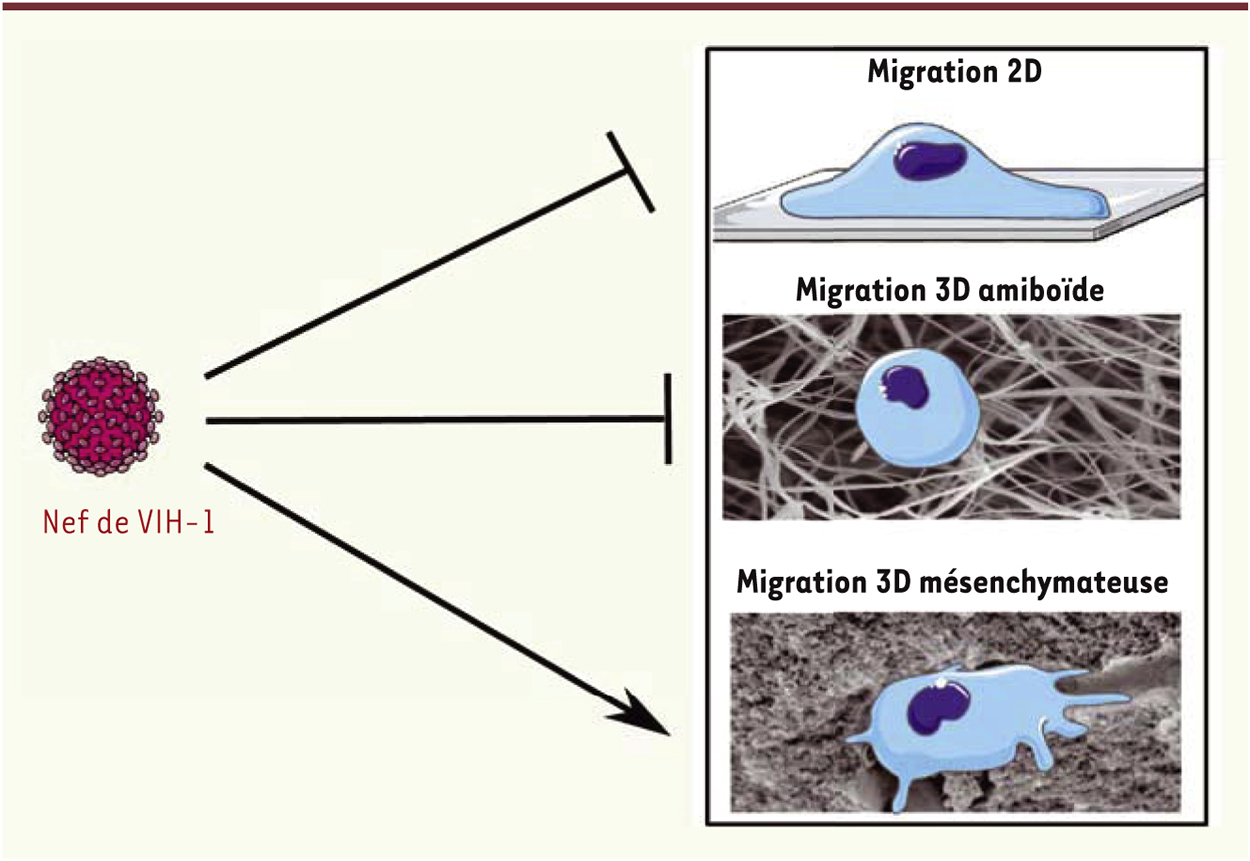
Le virus reprogramme les capacités migratoires des macrophages et favorise leur infiltration tissulaire L’accumulation de macrophages infectés dans certains tissus pourrait être expliquée par une modification de leurs propriétés migratoires et contribuer ainsi à la dissémination du virus notamment dans des régions difficilement accessibles aux traitements [3]. In vivo, les cellules migrent dans des environnements en deux dimensions (2D) (le long des parois vasculaires par exemple) mais également, et le plus souvent, dans des environnements en 3D. Alors que la migration en 2D a été largement caractérisée en termes de mécanismes moléculaires et de morphologie cellulaire, notre équipe a été pionnière dans l’étude de la migration des macrophages humains en 3D. Nous avons montré que le mode migratoire utilisé est déterminé par l’architecture de la matrice extracellulaire dans laquelle se trouvent les macrophages [4–6, 12]. Dans des environnements poreux, les macrophages utilisent le mode migratoire amiboïde communément utilisé par l’ensemble des leucocytes. Ce mode migratoire, qui implique la voie de signalisation ROCK, est rapide et caractérisé par des cellules rondes qui se faufilent entre les pores de la matrice. Dans des matrices moins poreuses, les macrophages ont la capacité d’utiliser un autre type de migration, appelé migration mésenchymateuse. Au cours de cette migration, les cellules évoluent lentement et leur morphologie est allongée ; les macrophages sécrètent des protéases pour dégrader la matrice, ils digèrent la matrice et la compactent afin de se créer un passage aussi appelé tunnel [4, 5]. Dans un travail récent [2], nous avons montré in vitro que l’infection des macrophages humains par le VIH-1 inhibe leur migration en 2D et leur migration 3D amiboïde mais que, en revanche, le mode migratoire mésenchymateux est stimulé. Dans le cas des lymphocytes T CD4, qui migrent uniquement selon le mode amiboïde, l’infection inhibe leur migration [1, 7]. C’est la protéine virale Nef, un facteur de virulence majeur du VIH-1, qui reprogramme à la fois la migration des cellules T [7] et celle des macrophages [2] (Figure 1). Les conséquences de ces modifications dans les macrophages ont été étudiées in vivo, en utilisant des souris transgéniques (Tg) exprimant Nef sous contrôle du promoteur du gène codant pour CD4 [8]. Des tumeurs cutanées ont été induites chez ces souris pour étudier le recrutement de macrophages issus des monocytes sanguins. Le nombre de macrophages associés à la tumeur dans les souris Tg Nef est significativement plus élevé que dans les tumeurs des souris non transgéniques. Les tissus tumoraux sont fréquemment caractérisés par une densification et une rigidification, dans lesquels nous prédisons que la migration mésenchymateuse devrait être prédominante [4]. Notre hypothèse actuelle consiste à penser que les tissus plutôt lâches, dans lesquels la migration amiboïde est majoritaire, seront faiblement colonisés par des macrophages infectés. En revanche, les tissus denses, dans lesquels les macrophages utilisent une migration mésenchymateuse, seront massivement infiltrés. Cette hypothèse est confortée par nos résultats chez des souris invalidées génétiquement pour un gène impliqué dans la conversion de la migration amiboïde en migration mésenchymateuse. En effet, chez ces animaux, on observe une inhibition importante du nombre de macrophages ayant infiltré des tumeurs [9]. On peut donc suggérer que la reprogrammation des modes migratoires des macrophages pourrait permettre au virus de disséminer préférentiellement dans certains tissus chez les patients. Ainsi, à l’aide du modèle de souris Tg Nef, nous avons montré que le nombre de macrophages dans le rein, le foie et les muqueuses intestinales est plus important que chez des souris témoins [2]. Or, on retrouve un nombre important de macrophages dans ces tissus chez les patients infectés ou chez des macaques infectés par le VIS (virus de l’immunodéficience simienne). Nous n’avons pas de données à ce jour concernant les caractéristiques physiques de ces tissus. Il devrait toutefois être possible de prédire, une fois ces caractéristiques connues, les tissus qui seront préférentiellement colonisés par les macrophages infectés. L’exploration de ces questions constitue un projet majeur de notre équipe.
 | Figure 1.
Effet du VIH-1 sur la migration des macrophages. L’infection des macrophages par le VIH-1 inhibe la migration 2D et la migration 3D amiboïde (dans des matrices poreuses), et elle augmente la migration 3D mésenchymateuse (dans des matrices denses), via Nef. |
|
La protéine Nef du VIH-1 cible les podosomes et contrôle ainsi la migration des macrophages La protéine virale Nef est capable de modifier le cytosquelette d’actine des lymphocytes T et, ainsi, leur migration [7]. Nous avons donc étudié l’effet de Nef sur la structure d’actine principale des macrophages : les podosomes. Les podosomes sont des structures dynamiques impliquées dans l’adhérence, la détection des propriétés mécaniques de l’environnement (mechano-sensing), la dégradation de la matrice extracellulaire, et la migration mésenchymateuse des macrophages [4, 6, 10]. Nous avons fait deux observations : (1) l’infection par le VIH-1 stabilise et augmente la taille des podosomes, qui constituent l’unique structure d’adhérence des macrophages. Comme l’adhérence est un processus essentiel dans la migration en 2D et qu’elle est augmentée après infection, les effets sur les podosomes permettent probablement d’expliquer l’inhibition de la migration en 2D. (2) Le VIH-1 influence l’organisation spatiale des podosomes, qui forment préférentiellement des superstructures appelées rosettes de podosomes (Figure 2) ou belts. Comme nous avons déjà montré que cette organisation des podosomes favorise la protéolyse de la matrice [6] et que les macrophages infectés ont des capacités accrues à dégrader la matrice [2], les modifications de l’organisation des podosomes induites par le VIH-1 pourraient, au moins en partie, expliquer l’augmentation de la migration 3D mésenchymateuse. Ces effets du VIH-1 sur les podosomes sont régis par Nef et impliquent à la fois l’activation par Nef de la tyrosine kinase Hck et la phosphorylation de WASP (Wiskott Aldrich syndrome protein), un substrat de Hck qui favorise la polymérisation d’actine aux podosomes. Ces deux protéines sont des acteurs majeurs de la migration mésenchymateuse [4]. Ainsi, en affectant les podosomes, le VIH-1 contrôle les capacités migratoires des macrophages : il réduit la migration 2D et améliore la migration 3D mésenchymateuse [2]. Enfin, concernant l’effet de l’infection sur la migration amiboïde des macrophages, nous nous sommes basés sur les travaux réalisés sur les lymphocytes T, qui rapportent une inhibition par Nef de la migration amiboïde via l’augmentation du niveau de phosphorylation de la cofiline [7]. Dans les macrophages infectés, la phosphorylation de la cofiline n’est pas modifiée [2] et le mécanisme par lequel Nef inhibe la migration amiboïde reste à caractériser.
 | Figure 2.
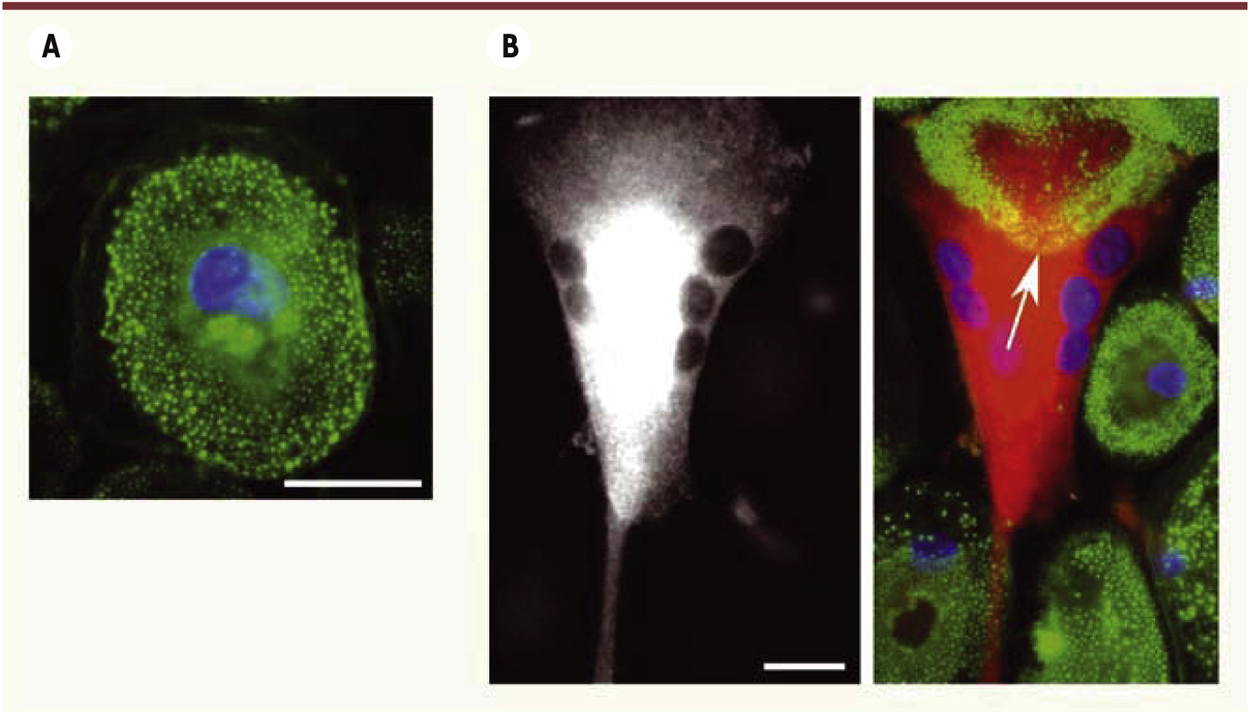
Modification de l’organisation des podosomes des macrophages par le VIH-1. Images d’immunofluorescence de macrophages humains non infectés (A) et infectés par le VIH-1 (B). Marquage de la protéine virale p24 (rouge), des noyaux (bleu) et de l’actine polymérisée (vert) qui se concentre dans les podosomes. Contrairement aux cellules non infectées dans lesquelles les podosomes sont généralement éparpillés (A), les podosomes s’organisent en rosettes dans les cellules infectées (B, flèche blanche). Barre d’échelle : 10 µm. |
En conclusion, cette étude a mis en évidence pour la première fois qu’un pathogène peut, en ciblant les podosomes, contrôler la migration cellulaire. |
Ce travail a permis d’identifier certains des mécanismes mis en place par le VIH-1 pour reprogrammer les modes migratoires des macrophages. En favorisant le mode migratoire mésenchymateux, et en inhibant la migration 2D et la migration amiboïde, le VIH-1 pourrait conduire les macrophages à envahir préférentiellement certains tissus de l’hôte. Ainsi, la modification de la migration des macrophages par le VIH-1 pourrait être vue comme une stratégie du virus pour se propager de façon ciblée dans l’organisme. De plus, la connaissance des voies de signalisation impliquées (en particulier la voie Hck/WASP) permet d’entrevoir de nouvelles perspectives de thérapie basées sur l’inhibition de la migration des macrophages. Cette stratégie thérapeutique pourrait s’appliquer aussi bien à l’infection par le VIH-1 qu’à d’autres pathologies telles que les cancers ou les inflammations chroniques, pour lesquelles une infiltration tissulaire des macrophages peut entraîner une aggravation de la maladie. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions nos collègues qui ont participé aux travaux sur la migration des macrophages infectés, ainsi que les plates-formes du réseau d’imagerie T.R.I. Genotoul (Toulouse réseau imagerie) et le plateau de biothérapie-vectorologie-ingénierie cellulaire (BiVIC) de Toulouse. Ces travaux ont été financés par le centre national de la recherche scientifique (CNRS), l’Agence nationale de recherche sur le Sida et les hépatites virales (ANRS 2010-061, ANRS 2014-049), Sidaction (AI-22-1-01892), la Fédération pour la recherche médicale (FRM DEQ 2011 0421312), l’Agence nationale de la recherche (ANR 2010-01301 et ANR Macronano ANR14-CE11-0020-02) et la Communauté européenne pour le programme HEALTH-F4-2011-282095-Tarkinaid.
|
1.
Murooka TT, Deruaz M, Marangoni F, et al. HIV-infected T cells are migratory vehicles for viral dissemination . Nature. 2012; ; 490 : :283.–287. 2.
Verollet C, Souriant S, Bonnaud E, et al. HIV-1 reprograms the migration of macrophages . Blood. 2015; ; 125 : :1611.–1622. 3.
Carter CA, Ehrlich LS. Cell biology of HIV-1 infection of macrophages . Annu Rev Microbiol. 2008; ; 62 : :425.–443. 4.
Maridonneau-Parini I. Control of macrophage 3D migration: a therapeutic challenge to limit tissue infiltration . Immunol Rev. 2014; ; 262 : :216.–231. 5.
Van Goethem E, Poincloux R, Gauffre F, et al. Matrix architecture dictates three-dimensional migration modes of human macrophages: differential involvement of proteases and podosome-like structures . J Immunol. 2010; ; 184 : :1049.–1061. 6.
Wiesner C, Le Cabec V, El Azzouzi K, et al. Podosomes in space: macrophage migration and matrix degradation in 2D and 3D settings . Cell Adh Migr. 2014; ; 8 : :179.–191. 7.
Stolp B, Reichman-Fried M, Abraham L, et al. HIV-1 Nef interferes with host cell motility by deregulation of Cofilin . Cell Host Microbe. 2009; ; 6 : :174.–186. 8.
Hanna Z, Kay DG, Rebai N, et al. Nef harbors a major determinant of pathogenicity for an AIDS-like disease induced by HIV-1 in transgenic mice . Cell. 1998; ; 95 : :163.–175. 9.
Gui P, Labrousse A, Van Goethem E, et al. Rho/ROCK pathway inhibition by CDK inhibitor p27kip1 participates in the onset of macrophage 3D-mesenchymal migration . J Cell Sci. 2014; ; 127 : :4009.–4023. 10.
Labernadie A, Bouissou A, Delobelle P, et al. Protrusion force microscopy reveals oscillatory force generation and mechanosensing activity of human macrophage podosomes . Nat Commun. 2014; ; 5 : :5343.. 11.
Schwartz C, Le Douce V, Cherrier T, et al. Un virus tapi dans l’ombre : les bases moléculaires de la latence du VIH-1. Partie I : la physiologie de la latence du VIH-1 . Med Sci (Paris). 2010; ; 26 : :159.–164. 12.
Le Cabec V, Van Goethem E. Romain Guiet R, Maridonneau-Parini I. La migration des phagocytes : tour d’horizon . Med Sci (Paris). 2011; ; 27 : :1112.–1120. |