| |
| Med Sci (Paris). 2015 August; 31(8-9): 735–741. Published online 2015 September 4. doi: 10.1051/medsci/20153108011.Les pores oméga Une voie de perméation alternative au sein des canaux ioniques Adrien Moreau1 and Mohamed Chahine1,2* 1Centre de recherche de l’Institut universitaire en santé mentale de Québec, 2601 chemin de la Canardière, Québec, QC, G1J 2G3Canada 2Département de médecine, université Laval, Québec, QC, G1K 7P4Canada |
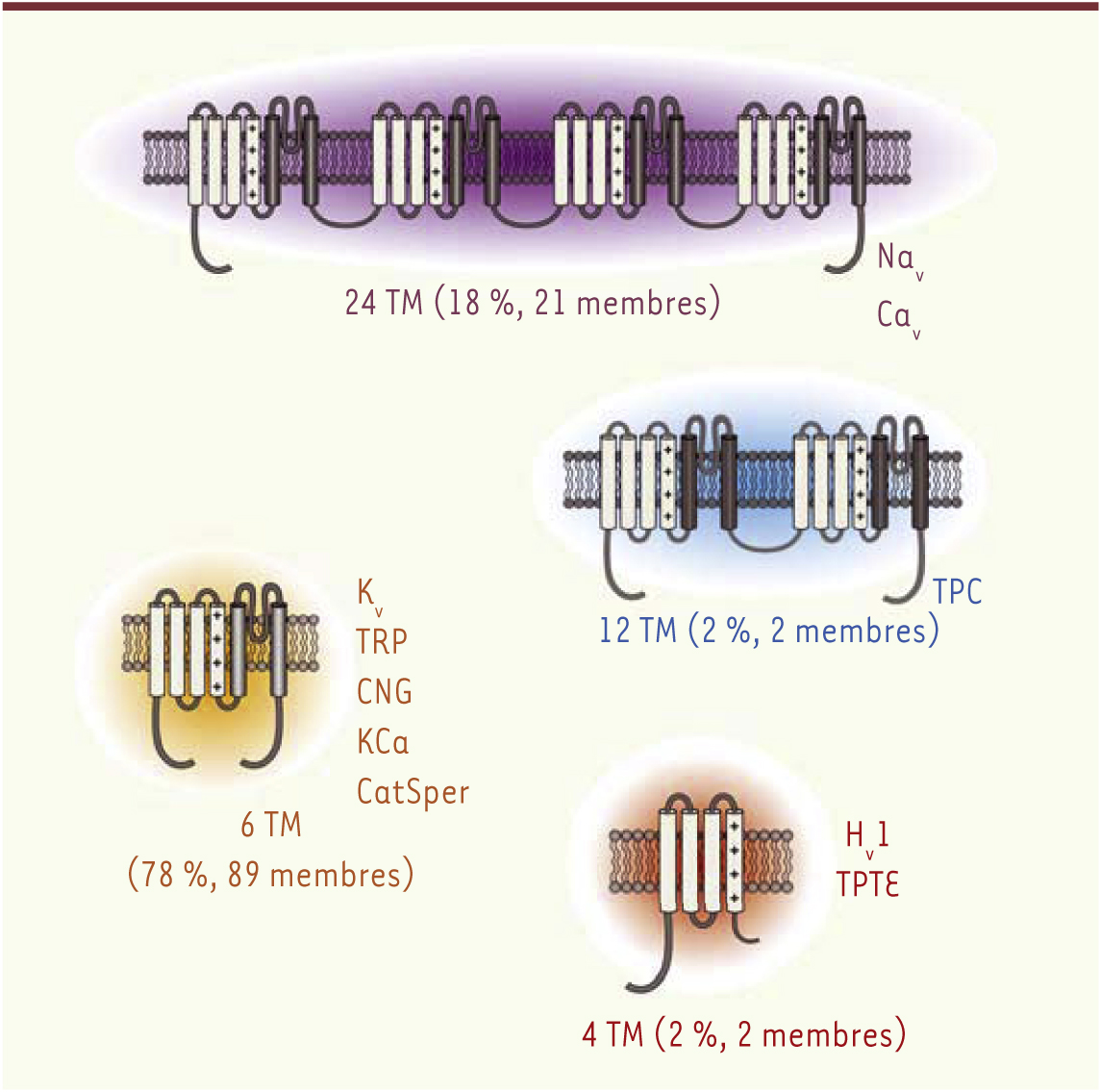
Depuis leur identification au début des années 1950, les canaux ioniques ont été associés à de nombreuses fonctions physiologiques grâce aux travaux pionniers de Hodgkin et Huxley [1]. Ces protéines membranaires assurent l’intégrité des signaux électriques au niveau cellulaire, permettant la transmission de l’influx nerveux, ou encore la contraction musculaire. Parmi l’ensemble des canaux ioniques, il est possible de distinguer la superfamille des canaux ioniques activés par le voltage (voltage-gated ion channels, VGIC). Les VGIC peuvent être subdivisés en 4 familles : les canaux à 4 segments transmembranaires (TM) [38], 6 TM, 12 TM et 24 TM (Figure 1). Malgré des différences structurales, l’ensemble de ces familles possèdent un domaine assurant le passage physiologique des ions, nommé le domaine du pore, généralement formé de 8 segments transmembranaires qui s’assemblent pour constituer un canal (Figure 1). Les VGIC se composent également de domaines senseurs de voltage (voltage sensor domains, VSD), leur conférant leur sensibilité aux variations du potentiel de membrane. La structure tridimensionnelle du canal conduit à la formation d’un pore qui s’associe à plusieurs domaines VSD. Ces derniers sont chacun constitués de 4 segments transmembranaires (S1 à S4). Le mouvement du segment S4 possédant de 3 à 7 charges positives (apportées par des arginines et des lysines) induit un changement de conformation du pore aboutissant à son ouverture, et donc au passage des ions. Récemment, plusieurs études ont montré que des modifications du VSD peuvent générer une autre voie pour le passage des ions appelée pore oméga. L’objectif de cette revue est de présenter le concept de pore oméga, ses propriétés biophysiques ainsi que son potentiel pathologique.
 | Figure 1.
Répartition des protéines présentant un domaine senseur de voltage (VSD). L’ensemble des protéines présentant un VSD peut être subdivisé en 4 familles principales : les membres à 24 segments TM (représentés en violet), 12 segments TM (représentés en bleu), 6 segments TM (représentés en orange), 4 segments TM (représentés en rouge). Le VSD, toujours composé de 4 segments TM, est représenté par les segments gris clair. À l’opposé, le domaine du pore habituellement associé aux VSD est représenté par les segments gris foncé. |
|
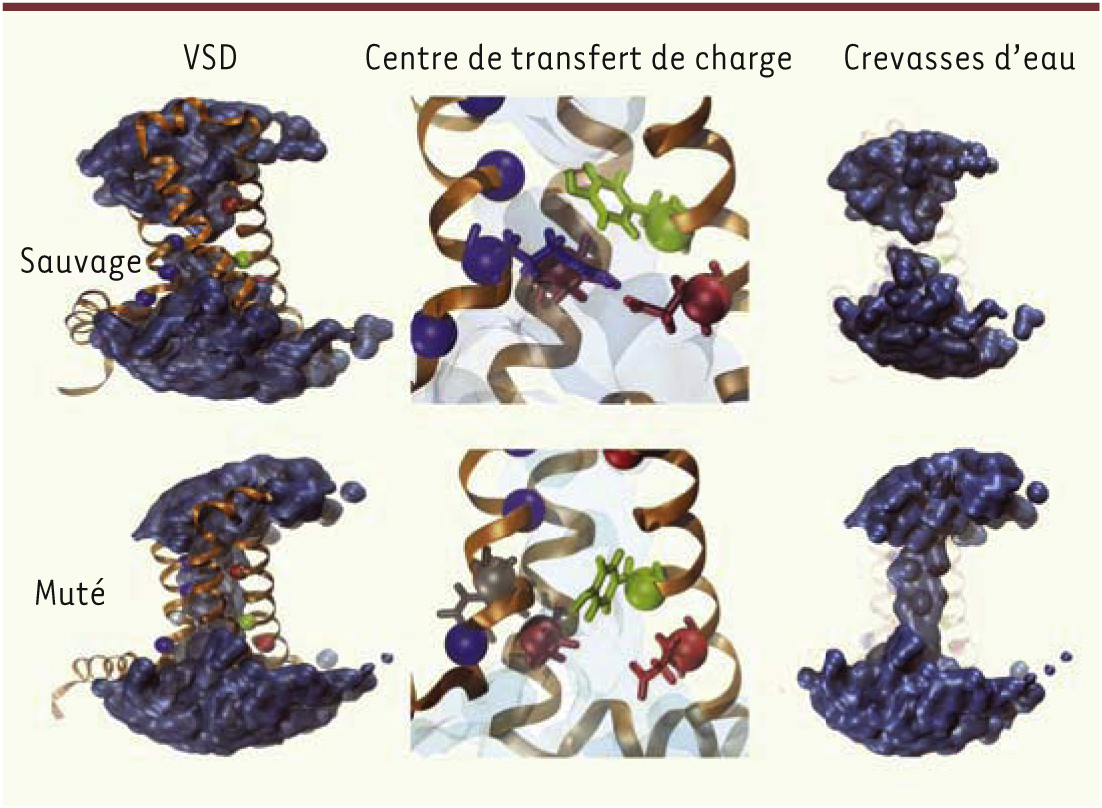
Découverte et propriétés des pores oméga Lors d’une étude portant initialement sur les mécanismes responsables de la sensibilité au voltage, Starace et ses collaborateurs ont découvert l’existence d’une voie de perméation alternative directement à l’intérieur du domaine senseur de voltage (VSD), une structure habituellement non conductrice [2, 3]. En effet, par la substitution d’arginines par des histidines au sein du VSD du canal potassique Shaker, les auteurs ont observé, de façon fortuite, le passage spécifique de protons, transportés par le mouvement du segment transmembranaire S4 sous l’effet du voltage. Par opposition au pore alpha, physiologique, cette nouvelle voie de perméation sera plus tard nommée pore oméga [4] ou « gating pore » [5]. En réponse à une variation du potentiel membranaire, le segment S4 des VSD se déplace, tel un dipôle au sein d’un champ électrique. Les segments S1 à S3, quant à eux, forment une structure beaucoup plus rigide, habituellement comparée à des piliers, qui assurent la stabilité du segment S4 [6]. Leur fonction est d’autant plus importante qu’ils comportent également une structure hautement conservée parmi les VSD appelée « gating charge transfer center » (GCTC). Le GCTC est constitué d’un résidu aromatique au niveau du segment S2 ainsi que de deux acides aminés chargés négativement localisés dans les segments S2 et S3 [7]. Cette structure particulière forme des liaisons hydrogène avec les charges positives situées au niveau du segment S4. Le GCTC permet aussi la formation d’un septum hydrophobe au sein du VSD, isolant ainsi deux crevasses d’eau de part et d’autre de la membrane qui forme alors une structure ressemblant à un sablier au sein du VSD (Figure 2) [8].
 | Figure 2.
Structure tridimensionnelle du domaine senseur de voltage (VSD) et création d’un pore oméga. Structure tridimensionnelle du VSD du domaine I des canaux Nav1.5 sauvages (haut) et mutés (R225W, bas) dans un état partiellement activé (état β). Les segments protéiques sont représentés en orange et le volume occupé par l’eau en bleu. Les acides aminés participant au centre de transfert de charge (GCTC) sont représentés par des sphères bleues pour les charges positives (au niveau du segment S4), rouges pour les charges négatives (au niveau des segments S2 et S3), et vertes pour l’acide aminé aromatique conservé (au niveau du segment S2). La colonne de gauche représente l’ensemble du VSD alors que pour les colonnes du centre et de droite, le segment S1 a été supprimé dans un objectif de clarté. La colonne du centre met en lumière les interactions étroites entre les charges positives du segment S4 et le GCTC. Ces interactions permettent la formation d’un septum hydrophobe au centre du VSD isolant les crevasses d’eau de part et d’autre de la membrane (colonne de droite). Dans le cadre d’une mutation (ici, R225W), les interactions entre le S4 et le GCTC sont rompues, ce qui cause la jonction des crevasses d’eau et donc l’ouverture d’un pore oméga. |
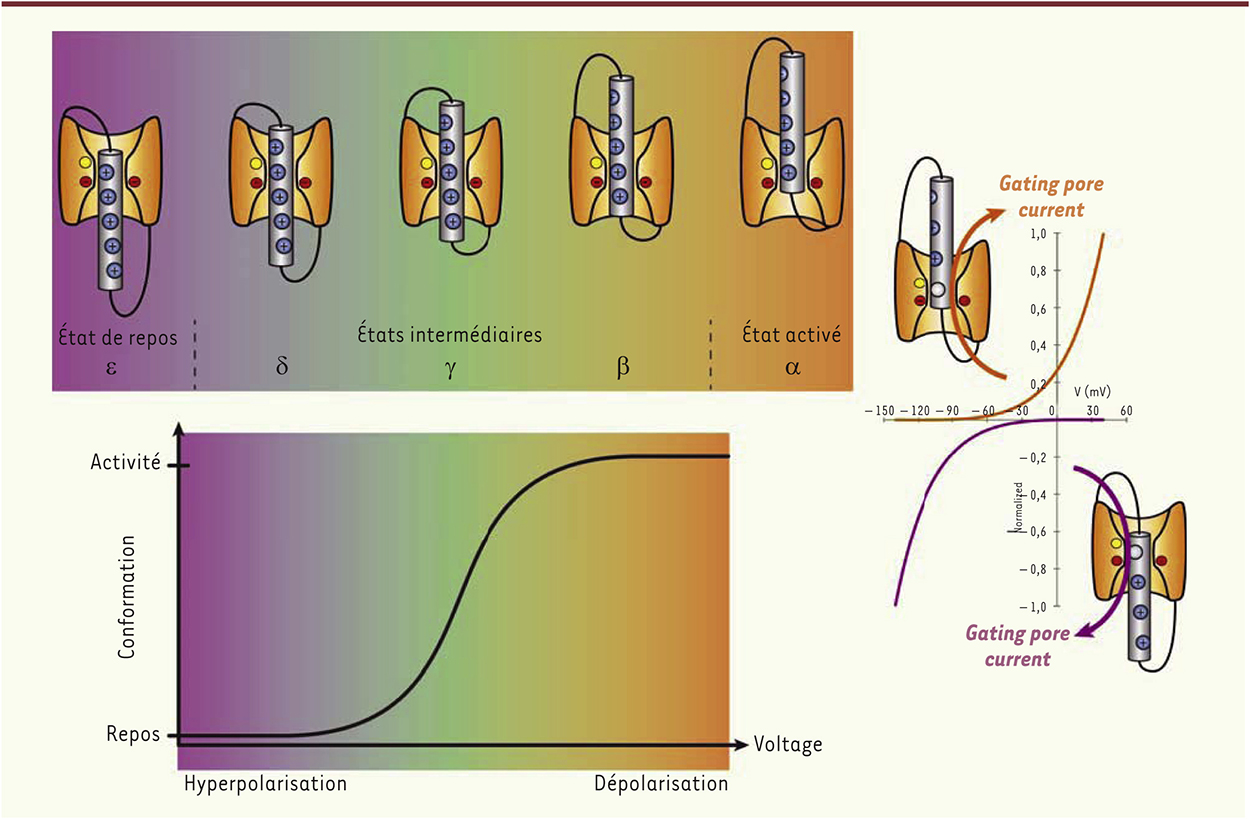
Dans un contexte de fonctionnement physiologique, les interactions étroites entre le GCTC et le S4 stabilisent la position du segment S4 au sein du VSD dans différents états [6, 9, 10]. À l’état de repos, le segment S4 se situe en position « basse », position dans laquelle une arginine localisée du côté extracellulaire interagit avec le GCTC. Sous l’effet d’une dépolarisation, chaque charge positive du S4 interagit séquentiellement avec le GCTC avant d’atteindre l’état activé, dans lequel le segment S4 se retrouve en position haute. Dans cette position, une charge positive du S4, localisée du côté intracellulaire, interagit avec le GCTC [11, 12] (Figure 3).
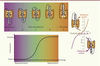 | Figure 3.
États principaux et intermédiaires du domaine senseur de voltage (VSD) et conduction du pore oméga. Le VSD est habituellement observé dans deux états principaux en fonction du potentiel membranaire : l’état de repos (potentiel hyperpolarisé) et l’état activé (potentiel dépolarisé). Lors du processus d’activation, les charges positives du segment S4 interagissent de manière séquentielle avec le GCTC, ce qui a pour effet la création d’états intermédiaires du VSD (α, β, γ, δ, ε). En fonction de la localisation de la mutation dans le segment S4, le pore oméga peut être ouvert lorsque le potentiel est dépolarisé (mutations d’arginines proches du milieu intracellulaire) ou lorsque le potentiel est hyperpolarisé (mutations d’arginines proches du milieu extracellulaire). Au sein du GCTC, les charges négatives hautement conservées sont représentées en rouge alors que le résidu aromatique est représenté en jaune. Les charges (+) au niveau des segments S4 représentent les résidus chargés positivement. Gating pore current : courant oméga. |
Ainsi, la mutation d’une charge positive au niveau du S4 induit une déstabilisation et une rupture des interactions entre le segment S4 et le GCTC, provoquant ainsi la communication des crevasses d’eau et, par conséquent, la création d’une nouvelle voie de perméation de faible conductance, le pore oméga [6, 13, 14]. En fonction de la localisation de la mutation au niveau du S4, le pore oméga sera alors conducteur à l’état de repos ou à l’état activé. Dans le cas de mutations des charges positives les plus proches du milieu extracellulaire, l’absence de charge permet la jonction des crevasses d’eau lorsque le S4 est en position « basse », dite position de repos. Le pore oméga est alors perméable à des voltages hyperpolarisés (Figure 3). Inversement, dans le cas de mutations des charges positives les plus proches du milieu intracellulaire, l’absence de charge permet la jonction des crevasses d’eau lorsque le S4 est en position « haute » ou activée. Le pore oméga est alors perméable à des voltages dépolarisés (Figure 3). De par la nature et la localisation des pores oméga, leurs propriétés biophysiques sont intimement liées aux propriétés des VSD. Aussi, les cinétiques d’activation d’un pore oméga (inférieures à 1 ms), tout comme celles de sa fermeture, dépendent directement de la cinétique de mouvement du S4 [6, 13]. Ces pores ne présentent pas de mécanisme d’inactivation et leurs cinétiques de fermetures dépendent encore des cinétiques de mouvement du segment S4. À ce jour, deux sous-types de pores oméga peuvent être distingués en fonction de leur sélectivité. Il y a, d’une part, les pores sélectifs aux cations et, d’autre part, ceux sélectifs aux protons. Ces derniers sont issus de la substitution spécifique d’une charge positive par une histidine, qui agit alors comme un accepteur de protons et assure leur passage sélectif. Dans le cas de substitution de charges positives par d’autres acides aminés, les séquences de sélectivité publiées semblent indiquer à ce jour que ces pores oméga correspondraient à des pores étroits avec de faibles sites de liaison [14, 15]. De ce fait, ces séquences favoriseraient le passage des larges cations (Cs+ > K+ > Na+) pouvant être plus facilement déshydratés. |
Implications pathologiques des pores oméga D’un point de vue fondamental, les pores oméga ont été initialement étudiés en vue d’approfondir la compréhension des mécanismes senseurs de voltage. Ils se sont aussi révélés être de puissants outils d’évaluation de la position des segments S4 au sein des VSD, permettant ainsi d’affiner les connaissances de la structure propre à ces domaines [16]. La connaissance de ces mécanismes a permis d’appréhender un certain nombre de pathologies selon un angle nouveau. La paralysie périodique hypokaliémique (hypoPP) est la première pathologie associée à la création d’un pore oméga. L’hypoPP a été décrite pour la première fois en 1941 [17] par des symptômes d’attaques de paralysie en condition de faible kaliémie (< 3 mEq/l). Ces attaques sont notamment déclenchées par l’exercice, les repas riches en hydrates de carbone, le froid, la fièvre ou encore le stress [18, 19]. À ce jour, les mutations mises en cause impliquent majoritairement les canaux Cav1.1 (60 %) et Nav1.4 (10 %) (Tableau I). Ces canaux calciques et sodiques sont tous deux impliqués dans la genèse des potentiels d’action musculaires assurant la contraction du muscle. L’étude de ces mutations a révélé une importante diversité de leurs conséquences sur la biophysique des canaux avec des effets sur la densité de courant, les cinétiques d’activation ou encore l’inactivation des canaux calciques et sodiques [20–22]. L’importante hétérogénéité de ces défauts biophysiques (gain et perte de fonction) a abouti à la recherche d’un mécanisme pathologique unificateur. Ainsi, en 2007, deux équipes ont identifié la création d’un pore oméga formé à la suite de la mutation d’une arginine au niveau du segment S4 des canaux Nav1.4 [23, 24]. Bien que la majorité des mutations identifiées à ce jour soient localisées au niveau des canaux Cav1.1, l’étude du pore oméga au sein de ces canaux est très restreinte. La faible conductance de cette voie de perméation alternative (quelques femto Siemens à quelques centaines de femto Siemens), associée à une expression limitée des canaux Cav dans des systèmes de surexpression, qu’il s’agisse d’ovocytes de xénope ou de lignées cellulaires mammifères, rendent l’étude de cette voie de perméation difficile. Ainsi, à ce jour, il n’existe qu’une seule preuve de la création pathologique d’un tel pore au sein des canaux Cav1.1 [25]. Afin de pallier les difficultés expérimentales, les auteurs ont eu recours à la création d’une souris transgénique en vue d’enregistrer le pore oméga directement dans des myotubes fraîchement dissociés [25].
Tableau I.
| Canal ionique |
Mutation |
Localisation |
Pathologie associée |
| Nav1.1 |
R859C |
R1, S4/DII |
Épilepsie |
| R865G |
R3, S4/DII |
|
| Nav1.2 |
R223Q |
R3, S4/DI |
Épilepsie |
| R1312T |
R4, S4/DIII |
| R1319Q |
R6, S4/DIII |
|
| Nav1.4 |
R222Q/W |
R2, S4/DI |
| R669H |
R1, S4/DII |
| R672H/G/S/C |
R2, S4/DII |
| R1129Q |
R1, S4/DIII |
HypoPP |
| R1132Q |
R2, S4/DIII |
| R1135H/C |
R3, S4/DIII |
| D1420G |
S3/DIV |
| R675G/Q/W |
R3, S4/DII |
NormoPP |
| R225W |
R3, S4/DI |
PP |
|
| Nav1.5 |
I141V |
S1/DI |
DCM |
| S216L |
R0, S4/DI |
| R219H |
R1, S4/DI |
| T220I |
S4, DI |
| R222Q |
R2, S4/DI |
| R225W |
R3, S4/DI |
| R814W/Q |
R3, S4/DII |
| D1275N |
S3/DIII |
| V1279I |
S3/DIII |
| D1595H |
S3/DIV |
|
| Nav1.9 |
R225C |
R2, S4/DI |
Douleur |
|
| Cav1.1 |
R528H/G |
R1, S4/DII |
HypoPP |
| R897S |
R1, S4/DIII |
| R900S |
R2, S4/DIII |
| R1239H/G |
R2, S4/DIV |
| R1242G |
R3, S4/DIV |
NormoPP |
| R174W |
R4, S4/DI |
Hyperthermie maligne |
|
| Cav2.1 |
R192Q |
R0, S4/DI |
FHM |
| R195Q |
R1, S4/DI |
| R583Q |
R1, S4/DII |
| R1346Q |
R1, S4/DIII |
| R1661H |
R1, S4/DIV |
| R1664Q |
R2, S4/DIV |
| R1667W |
R3, S4/DIV |
|
| Kv3.1 |
R320H |
R4, S4 |
PNH |
|
| Kv3.3 |
R420H |
R3, S4 |
Ataxie |
| R423H |
R4, S4 |
|
| Kv7.2 |
R207W/Q |
R4, S4 |
PNH |
Mutations localisées au sein d’un VSD et associées au développement d’une canalopathie. HypoPP : paralysie périodique hypokaliémique ; normoPP : paralysie périodique normokaliémique ; PP : paralysie périodique ; DCM : cardiomyopathie dilatée associée à diverses arythmies ; FHM : migraine hémiplégique familiale ; PNH : hyperexcitabilité nerveuse périphérique. |
Bien que les conséquences exactes de cette fuite cationique demeurent inconnues, le pore oméga constitue à l’heure actuelle le mécanisme pathologique couramment admis pour les paralysies périodiques normo- et hypokaliémique. La perméation d’ions au sein du VSD pourrait provoquer un déséquilibre ionique important, notamment par le biais de l’activation des différents échangeurs Na/Ca ou Na/H par exemple [13]. Ce phénomène pourrait entraîner une légère élévation du potentiel membranaire tout en déstabilisant le fonctionnement de certains canaux potassiques (Kir), amplifiant ainsi l’élévation du potentiel de membrane vers des potentiels plus dépolarisés. Les attaques de paralysie résulteraient alors de l’entrée des canaux Nav dans un état inactivé, avec pour conséquence l’incapacité à déclencher un potentiel d’action et donc l’abolition de toute contraction musculaire. Récemment, plusieurs mutations similaires au niveau des segments S4 des canaux Nav1.5 (homologue cardiaque des canaux Nav1.4) ont été identifiées [13, 26] (Tableau I). Les patients porteurs de ces mutations présentent un phénotype clinique atypique associé à une atteinte structurale du cœur, se manifestant par une dilatation des cavités cardiaques, ainsi que par diverses arythmies. Bien que les phénotypes cliniques observés chez les patients porteurs de ces mutations soient similaires, les premières études biophysiques de ces mutations ont décrit, étonnamment, des altérations biophysiques divergentes du pore alpha [27–29]. Certaines mutations telles que R222Q et R225P induisaient un gain de fonction biophysique (augmentation de la densité de courant, décalage des potentiels de demi-activation et demi-inactivation) [27, 29, 30]. À l’opposé, une mutation R225W induisait une perte de fonction (diminution de la densité de courant, modification des cinétiques d’activation et d’inactivation, décalage des potentiels de demi-activation et demi-inactivation) [28, 30]. Récemment, la caractérisation biophysique d’une mutation R219H n’a révélé aucun défaut des propriétés biophysiques classiquement associées à des gains ou pertes de fonction de Nav1.5 [31]. De manière similaire à l’hypoPP au regard des effets divergents induits par les nombreuses mutations répertoriées et de leur localisation au niveau de la protéine, les études se sont focalisées sur la recherche d’un mécanisme pathologique unificateur indépendant de la conductance sodique. La caractérisation biophysique de la mutation R219H a ainsi révélé l’existence d’un pore oméga sélectif au proton, activé par l’hyperpolarisation [31]. Cette voie de perméation alternative a par la suite été identifiée dans le contexte de deux autres mutations (R222Q et R225W) [30] provoquant l’apparition d’un pore sélectif aux cations activés par la dépolarisation. L’implication pathologique du pore oméga a aussi été révélée au niveau neuronal. En effet, la création d’un pore oméga a été constatée dans le cadre de l’hyperexcitabilité nerveuse périphérique [32] qui est une pathologie neuromusculaire provoquant notamment une hyperexcitabilité musculaire, la survenue de crampes ou encore de tremblements [33]. Des mutations R207W et R207Q du gène KCNQ2 qui code les canaux Kv7.2 ont été identifiées chez des patients atteints d’hyperexcitabilité nerveuse périphérique [34, 35]. Ces canaux, en s’associant avec les canaux Kv7.3, forment le courant M, responsable notamment de la régulation du potentiel de membrane neuronal. Dans l’objectif de contourner les difficultés expérimentales telles qu’une faible expression, les auteurs ont utilisé les canaux Kv7.4, homologues des canaux Kv7.2. Ainsi, l’étude de la mutation de la 4e arginine du segment S4 des canaux Kv7.4 a révélé l’existence d’un courant oméga cationique activé par la dépolarisation [32]. Il est donc possible de postuler qu’un courant similaire potentiellement pathologique ait pu aussi être créé dans le cas des mutations R207W et R207Q au niveau du segment S4 des canaux Kv7.2, retrouvées initialement chez des patients atteints d’hyperexcitabilité nerveuse périphérique [34, 35]. |
Le pore oméga, une cible thérapeutique universelle à considérer ? Le domaine senseur de voltage est une structure partagée par l’ensemble des canaux ioniques dépendants du voltage (Figure 1), soit environ 140 structures. Ce nombre conséquent impliquerait théoriquement l’existence de 140 cibles potentielles pour la création d’un pore oméga. Au vu de la distribution tissulaire de l’ensemble des VGIC ainsi que de la diversité des fonctions physiologiques modulées par ces canaux, les pathologies impliquant la création d’un pore oméga pourraient donc être largement sous-estimées à l’heure actuelle (Tableau I). En plus des paralysies périodiques, des arythmies cardiaques associées à la dilatation et l’hyperexcitabilité nerveuse périphérique, la création d’une telle voie de perméation est déjà suspectée dans d’autres pathologies telles que la susceptibilité à l’hyperthermie maligne, l’ataxie, la migraine hémiplégique familiale, l’épilepsie ou encore la douleur [6, 36]. Néanmoins, bien que le VSD soit une structure très conservée dans la famille des VGIC, les études tendent à démontrer que chaque VSD possède ses propres particularités. Il apparaît de plus en plus difficile d’émettre des généralités et de considérer la création d’un pore oméga en se basant uniquement sur la localisation d’une mutation. Par exemple, des travaux sur les canaux Nav1.4 ont mis en évidence qu’une simple mutation ne permettait pas systématiquement l’ouverture de la voie de perméation alternative selon le VSD considéré. Ainsi, plusieurs mutations peuvent être nécessaires pour créer un pore oméga au sein du 4e domaine des canaux Nav1.4 [16]. À ce jour, la grande majorité des pores oméga caractérisés sont des pores créés à la suite des mutations du segment S4. Cependant, des études montrent que des pores similaires peuvent apparaître à la suite de la mutation de résidus au sein des segments S1 à S3 [37]. Les caractéristiques biophysiques (activation, conductance, sélectivité ionique) de telles voies de perméation demeurent néanmoins inconnues. |
Le dogme associant une seule et unique voie de perméation sélective par canal ionique apparaît aujourd’hui révolu. Le domaine senseur de voltage est une structure protéique conservée et répandue assurant la détection des variations de voltage environnant et donc la régulation fine du fonctionnement des canaux ioniques ou encore de phosphatases. La mutation de charges positives au niveau du segment S4 provoque l’ouverture d’une nouvelle voie de perméation alternative pour laquelle aucun bloqueur universel n’a été découvert à ce jour. Devant l’augmentation certaine du nombre de pathologies associées à la création d’un pore oméga, de telles substances se révèleraient sans aucun doute utiles et nécessaires. Parallèlement, cela placerait le VSD au rang de nouvelle cible thérapeutique novatrice et prometteuse dont les applications sont très larges puisque la modulation du VSD pourrait aussi être employée dans le traitement de nombreuses canalopathies. L’intérêt grandissant porté aux VSD permet ainsi la mise en lumière de cette structure dans le développement de nouvelles substances dont le potentiel est très grand, tant dans la spécificité que dans la finesse de la régulation de ces VSD. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Hodgkin AL, Huxley AF. A quantitative description of membrane current and its application to conduction and excitation in nerve . J Physiol. 1952; ; 117 : :500.–544. 2.
Starace DM, Bezanilla F. A proton pore in a potassium channel voltage sensor reveals a focused electric field . Nature. 2004; ; 427 : :548.–553. 3.
Starace DM, Stefani E, Bezanilla F. Voltage-dependent proton transport by the voltage sensor of the Shaker K+ channel . Neuron. 1997; ; 19 : :1319.–1327. 4.
Tombola F, Pathak MM, Isacoff EY. Voltage-sensing arginines in a potassium channel permeate and occlude cation-selective pores . Neuron. 2005; ; 45 : :379.–388. 5.
Sokolov S, Scheuer T, Catterall WA. Ion permeation through a voltage-sensitive gating pore in brain sodium channels having voltage sensor mutations . Neuron. 2005; ; 47 : :183.–189. 6.
Moreau A, Gosselin-Badaroudine P, Chahine M. Molecular biology and biophysical properties of ion channel gating pores . Q Rev Biophys. 2014; ; 47 : :364.–388. 7.
Tao X, Lee A, Limapichat W, et al. A gating charge transfer center in voltage sensors . Science. 2010; ; 328 : :67.–73. 8.
Delemotte L, Klein ML, Tarek M. Molecular dynamics simulations of voltage-gated cation channels: insights on voltage-sensor domain function and modulation . Front Pharmacol. 2012; ; 3 : :97.. 9.
Jensen MO, Jogini V, Borhani DW, et al. Mechanism of voltage gating in potassium channels . Science. 2012; ; 336 : :229.–233. 10.
Tarek M, Delemotte L. Omega currents in voltage-gated ion channels: what can we learn from uncovering the voltage-sensing mechanism using MD simulations? Acc Chem Res. 2013; ; 46 : :2755.–2762. 11.
Amaral C, Carnevale V, Klein ML, Treptow W. Exploring conformational states of the bacterial voltage-gated sodium channel NavAb via molecular dynamics simulations . Proc Natl Acad Sci USA. 2012; ; 109 : :21336.–21341. 12.
Delemotte L, Tarek M, Klein ML, et al. Intermediate states of the Kv1.2 voltage sensor from atomistic molecular dynamics simulations . Proc Natl Acad Sci USA. 2011;; 108 : :6109.–6114. 13.
Moreau A, Gosselin-Badaroudine P, Chahine M. Biophysics, pathophysiology, and pharmacology of ion channel gating pores . Front Pharmacol. 2014; ; 5 : :53.. 14.
Delemotte L, Treptow W, Klein ML, Tarek M. Effect of sensor domain mutations on the properties of voltage-gated ion channels: molecular dynamics studies of the potassium channel Kv1.2 . Biophys J. 2010; ; 99 : :L72.–L74. 15.
Khalili-Araghi F, Tajkhorshid E, Roux B, Schulten K. Molecular dynamics investigation of the omega-current in the Kv1.2 voltage sensor domains . Biophys J. 2012; ; 102 : :258.–267. 16.
Gosselin-Badaroudine P, Delemotte L, Moreau A, et al. Gating pore currents and the resting state of Nav1.4 voltage sensor domains . Proc Natl Acad Sci USA. 2012;; 109 : :19250.–19255. 17.
Talbott JH. Periodic paralysis: a clinical syndrome . Medicine (Baltimore). 1941; ; 20 : :85.–143. 18.
Cannon SC. Pathomechanisms in channelopathies of skeletal muscle and brain . Annu Rev Neurosci. 2006; ; 29 : :387.–415. 19.
Sung CC, Cheng CJ, Lo YF, et al. Genotype and phenotype analysis of patients with sporadic periodic paralysis . Am J Med Sci. 2012; ; 343 : :281.–285. 20.
Jurkat-Rott K, Mitrovic N, Hang C, et al. Voltage-sensor sodium channel mutations cause hypokalemic periodic paralysis type 2 by enhanced inactivation and reduced current . Proc Natl Acad Sci USA. 2000; ; 97 : :9549.–9554. 21.
Lapie P, Goudet C, Nargeot J, et al. Electrophysiological properties of the hypokalaemic periodic paralysis mutation (R528H) of the skeletal muscle alpha 1s subunit as expressed in mouse L cells . FEBS Lett. 1996; ; 382 : :244.–248. 22.
Morrill JA, Brown RH Jr, Cannon SC. Gating of the L-type Ca channel in human skeletal myotubes: an activation defect caused by the hypokalemic periodic paralysis mutation R528H . J Neurosci. 1998; ; 18 : :10320.–10334. 23.
Sokolov S, Scheuer T, Catterall WA. Gating pore current in an inherited ion channelopathy . Nature. 2007; ; 446 : :76.–78. 24.
Struyk AF, Cannon SC. A Na+ channel mutation linked to hypokalemic periodic paralysis exposes a proton-selective gating pore . J Gen Physiol. 2007; ; 130 : :11.–20. 25.
Wu F, Mi W, Hernandez-Ochoa EO, et al. A calcium channel mutant mouse model of hypokalemic periodic paralysis . J Clin Invest. 2012; ; 122 : :4580.–4591. 26.
Gosselin-Badaroudine P, Moreau A, Chahine M. Nav 1.5 mutations linked to dilated cardiomyopathy phenotypes: is the gating pore current the missing link? Channels (Austin). 2014; ; 8 : :90.–94. 27.
Beckermann TM, McLeod K, Murday V, et al. Novel SCN5A mutation in amiodarone-responsive multifocal ventricular ectopy-associated cardiomyopathy . Heart Rhythm. 2014; ; 11 : :1446.–1453. 28.
Bezzina CR, Rook MB, Groenewegen WA, et al. Compound heterozygosity for mutations (W156X and R225W) in SCN5A associated with severe cardiac conduction disturbances and degenerative changes in the conduction system . Circ Res. 2003; ; 92 : :159.–168. 29.
Mann SA, Castro ML, Ohanian M, et al. R222Q SCN5A mutation is associated with reversible ventricular ectopy and dilated cardiomyopathy . J Am Coll Cardiol. 2012; ; 60 : :1566.–1573. 30.
Moreau A, Gosselin-Badaroudine P, Delemotte L, et al. Gating pore currents are defects in common with two Nav1.5 mutations in patients with mixed arrhythmias and dilated cardiomyopathy . J Gen Physiol. 2015; ; 145 : :93.–106. 31.
Gosselin-Badaroudine P, Keller DI, Huang H, et al. A proton leak current through the cardiac sodium channel is linked to mixed arrhythmia and the dilated cardiomyopathy phenotype . PLoS One. 2012; ; 7 : :e38331.. 32.
Miceli F, Vargas E, Bezanilla F, Taglialatela M. Gating currents from Kv7 channels carrying neuronal hyperexcitability mutations in the voltage-sensing domain . Biophys J. 2012; ; 102 : :1372.–1382. 33.
Jurkat-Rott K, Lerche H, Weber Y, Lehmann-Horn F. Hereditary channelopathies in neurology . Adv Exp Med Biol. 2010; ; 686 : :305.–334. 34.
Dedek K, Kunath B, Kananura C, et al. Myokymia and neonatal epilepsy caused by a mutation in the voltage sensor of the KCNQ2 K+ channel . Proc Natl Acad Sci USA. 2001; ; 98 : :12272.–12277. 35.
Wuttke TV, Jurkat-Rott K, Paulus W, et al. Peripheral nerve hyperexcitability due to dominant-negative KCNQ2 mutations . Neurology. 2007; ; 69 : :2045.–2053. 36.
Figueroa KP, Minassian NA, Stevanin G, et al. KCNC3: phenotype, mutations, channel biophysics: a study of 260 familial ataxia patients . Hum Mutat. 2010; ; 31 : :191.–196. 37.
Campos FV, Chanda B, Roux B, Bezanilla F. Two atomic constraints unambiguously position the S4 segment relative to S1 and S2 segments in the closed state of Shaker K channel . Proc Natl Acad Sci USA. 2007; ; 104 : :7904.–7909. 38.
Chahine M, Blanchet J, El Chemaly A, Bois P. Un canal sans pore ? La structure primaire d’un canal perméable aux protons enfin dévoilée . Med Sci (Paris). 2006; ; 22 : :930.–932. |