| |
| Med Sci (Paris). 2015 August; 31(8-9): 748–755. Published online 2015 September 4. doi: 10.1051/medsci/20153108013.Migration et pathogénicité des lymphocytes T CD8 dans les maladies du système nerveux central Guillaume Martin-Blondel,1,2,3 Béatrice Pignolet,2,4 and Roland S. Liblau2,3* 1Département des maladies infectieuses et tropicales, hôpital universitaire de Toulouse, France 2Inserm U1043, CNRS UMR 5282, centre de physiopathologie Toulouse-Purpan, hôpital Purpan, place du Docteur Baylac, 31024Toulouse, France 3Université Toulouse III, Toulouse, F-31000, France 4Département des neurosciences, hôpital universitaire de Toulouse, France |
Les interactions entre le système nerveux central (SNC) et le système immunitaire adaptatif ont pour but de contrôler les agents pathogènes neurotropes tout en limitant le développement de réponses inflammatoires potentiellement délétères (Figure 1). Les lymphocytes T CD8 (LT CD8) sont des cellules effectrices de l’immunité adaptative impliquées plus particulièrement dans la destruction des cellules infectées ou tumorales. La réponse des LT CD8 dans le système nerveux central est habituellement déclenchée par l’activation en périphérie de lymphocytes T spécifiques qui migrent ensuite à ce niveau pour, selon le contexte, contrôler un agent pathogène ou générer des dommages tissulaires (Figure 2). Nous aborderons dans cette revue les modalités de migration des LT CD8 vers le système nerveux central, avant de détailler les situations physiopathologiques impliquant ces lymphocytes.
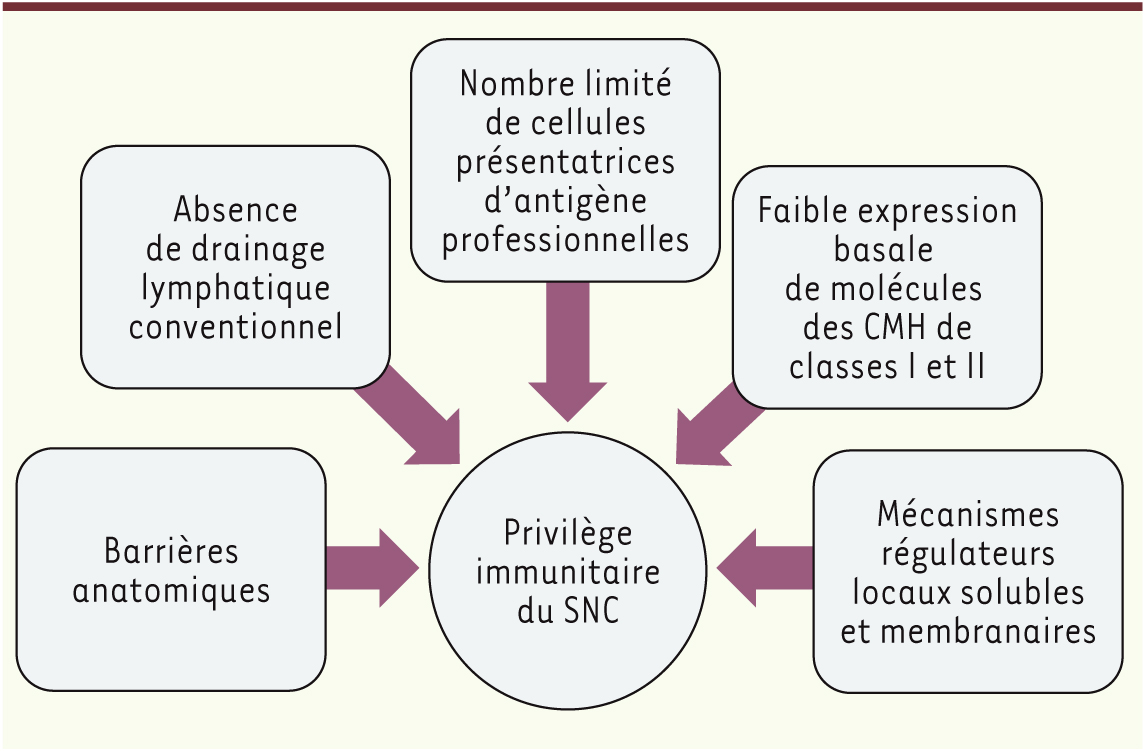
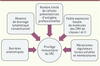 | Figure 1.
Privilège immunitaire relatif du système nerveux central. Afin d’éviter la survenue de dommages tissulaires liés à une réponse inflammatoire inappropriée, le parenchyme cérébral bénéficie d’un privilège immunitaire relatif permettant de contrôler activement les réponses immunitaires, tout en permettant une surveillance immunologique. |
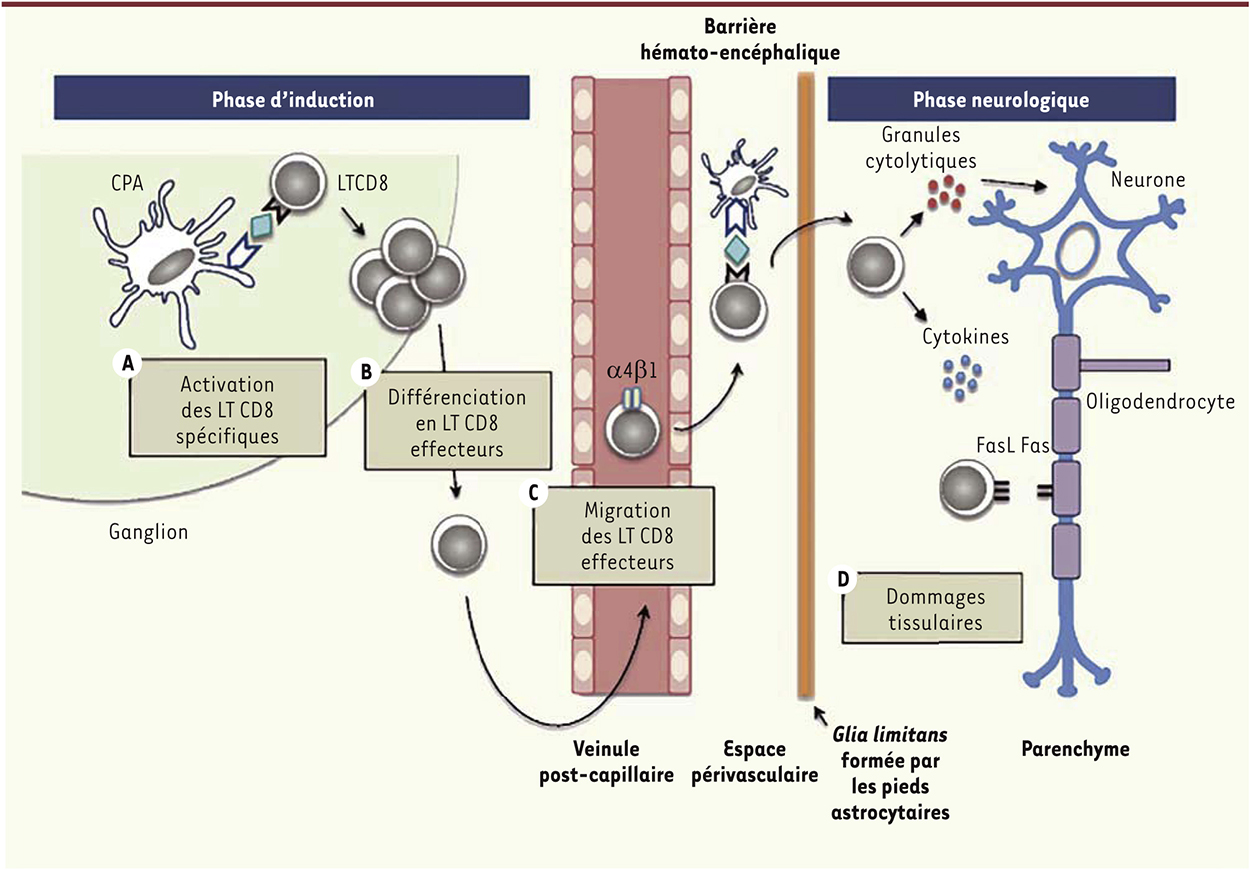
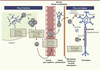 | Figure 2.
Développement de réponses lymphocytaires T CD8 affectant le système nerveux central. Après activation (A), les LT CD8 prolifèrent, se différencient en LT CD8 effecteurs (B) et acquièrent les outils moléculaires nécessaires à leur migration à travers la barrière hémato-encéphalique (BHE) (C) puis la glia limitans, avant de pénétrer le parenchyme cérébral et d’induire des dommages tissulaires (D). |
|
Mécanismes impliqués dans la migration des LT CD8 vers le système nerveux central La migration des cellules immunitaires vers le système nerveux central nécessite le franchissement des barrières anatomiques entourant ce dernier, et notamment de la barrière hémato-encéphalique (BHE). Ce processus complexe comprend plusieurs étapes successives faisant intervenir l’interaction séquentielle entre les leucocytes et les cellules endothéliales via des molécules d’adhésion (sélectines et intégrines1) et leurs ligands respectifs. Les principales molécules impliquées dans la migration des lymphocytes T CD4 (LT CD4) vers le système nerveux central sont connues. Il s’agit de la P-sélectine, des intégrines α4β1 et αLβ2 et de leurs ligands endothéliaux respectifs PSGL-1 (P-selectin glycoprotein ligand-1), VCAM-1 (vascular cell adhesion molecule) et ICAM-1 (intercellular adhesion molecule), ainsi que des récepteurs de chimiokines comme CCR5, CCR7 (C-C chemokine receptor type 5, 7) et CXCR4 (C-X-C chemokine receptor type 4) [1]. Les mécanismes qui gouvernent les différentes étapes de la migration des LT CD8 dans le système nerveux central sont en revanche encore mal connus (Tableau I). Dans un modèle murin, un rôle essentiel de PSGL-1 a été suggéré dans le recrutement des LT CD8. En effet, les capacités de roulement et d’arrêt ferme, au niveau de l’endothélium, de LT CD8 circulants, isolés de patients développant une première poussée de sclérose en plaques (SEP), sont diminuées lorsque PSGL-1 est inhibé [2]. La migration des LT CD8 dépend aussi de l’intégrine α4 et de son ligand VCAM-1 [3]. Des résultats encore non publiés, obtenus dans notre laboratoire, confirment ces résultats et montrent que l’intégrine α4 (et très vraisemblablement l’hétérodimère α4β1) représente une molécule d’adhésion majeure lors des processus de migration des LT CD8 vers le parenchyme cérébral.
Tableau I.
| Étapes de la migration vers le SNC |
Les molécules exprimées par les LT CD4 (et leurs ligands) |
Les molécules exprimées par les LT CD8 (et leurs ligands) |
| Attachement/roulement |
PSGL-1 et TIM-1 (P-sélectine) |
PSGL-1 (P-sélectine) |
|
|
CCR7 (CCL19, CCL21) |
|
| Activation |
CXCR4 (CXCL12) |
? |
|
CCR5 (CCL3, CCL4, CCL5) |
|
|
|
α4β1 (VCAM-1, JAM-B, fibronectine) |
PSGL-1 (P-sélectine) |
| Arrêt et adhésion |
αLβ2 (ICAM-1) |
Intégrine α4 (VCAM-1) |
|
MCAM (laminines α4) |
Autre ? |
|
|
Crawling (rampement) |
αLβ2 (ICAM-1) |
? |
|
|
Interactions homophiliques PECAM-1, CD99 et JAM-A, -B et -C |
|
|
CD6 (ALCAM) |
|
| Diapédèse |
αLβ2 (JAM-A) |
CCR2 (sécrétion de CCL2 favorisée par la P-glycoprotéine) |
|
α4β1 (JAM-B) |
|
|
αMβ2 (JAM-C) |
|
|
α6β1 (laminines α4) |
|
Comparaison des principales molécules d’adhésion impliquées dans la migration des LT CD4 et des LT CD8 vers le système nerveux central. ALCAM : activated leukocyte cell adhesion molecule ; JAM : junctional adhesion molecule ; MCAM : melanoma cell adhesion molecule ; TIM-1 : T cell immunoglobulin and mucin domain-1 ; PECAM-1 : platelet/endothelial cell adhesion molecule ; PSGL-1 : P-selectin glycoprotein ligand-1 ; VCAM-1 : vascular cell adhesion molecule ; ICAM-1 : intercellular adhesion molecule ; CCR5, CCR7 : C-C chemokine receptor type 5, 7 ; CXCR4 : C-X-C chemokine receptor type 4.
|
La P-glycoprotéine, qui est exprimée par les cellules endothéliales, participe également, après l’étape d’adhésion, à la diapédèse des LT CD8 vers le système nerveux central [4]. Cependant, on ne sait pas si ces lymphocytes doivent, ou non, être réactivés par des cellules présentatrices d’antigène présentes au niveau des espaces périvasculaires, avant la pénétration du parenchyme du système nerveux central, comme c’est le cas pour les LT CD4. |
Pathogénicité des LT CD8 au sein du système nerveux central Le rôle pathogénique des LT CD8 au sein du système nerveux central a été mis en évidence dans différentes situations physiopathologiques allant de maladies inflammatoires comme la SEP, au syndrome inflammatoire de restauration immunitaire (SIRI) [37, 38] (→).
(→) Voir la Synthèse de Lisa Chakrabarti et Olivier Lortholary, m/s n° 1, janvier 2015, page 53 et celle de Guillaume Breton, m/s n° 3, mars 2010, page 281
Rôle des LT CD8 dans les maladies inflammatoires du système nerveux central La sclérose en plaques La sclérose en plaques (SEP) est une pathologie inflammatoire du système nerveux central caractérisée par la survenue de lésions multifocales associant démyélinisation, perte axonale, activation des cellules gliales, et infiltration par des cellules immunes [ 5, 39] ( →). Les antigènes induisant cette réponse immunitaire restent indéterminés mais pourraient correspondre à des autoantigènes d’origine myélinique. Pendant les phases précoces de constitution des lésions parenchymateuses, des LT CD4, des LT CD8 et des macrophages sont recrutés au niveau de la substance blanche du système nerveux central. L’inefficacité d’anticorps monoclonaux dirigés contre les LT CD4, chez les patients atteints de forme récurrente-rémittente de SEP 2, suggère l’implication d’autres populations lymphocytaires, notamment celle des LT CD8. Bien que controversées, certaines études mettent en évidence dans le sang de patients atteints de SEP, mais pas chez les sujets sains, une fréquence élevée de LT CD8 reconnaissant des antigènes myéliniques [ 6]. L’analyse du liquide céphalo-rachidien (LCR) de patients atteints de SEP montre un enrichissement en LT CD8 activés présentant le phénotype « effecteur-mémoire » CD45RA - CCR7 - et susceptibles d’être retenus dans les tissus et d’y exercer leurs fonctions effectrices [ 7]. Une prépondérance très nette des LT CD8 par rapport aux LT CD4 est aussi observée au sein des manchons périvasculaires et des lésions parenchymateuses de SEP [ 8]. Les LT CD8 sont capables de polariser leurs granules cytotoxiques vers des oligodendrocytes et des axones en cours de démyélinisation [ 9]. Enfin, des interactions entre des cellules présentatrices d’antigène (CPA) et des LT CD8 proliférants sont détectées en périphérie de lésions de SEP [ 10]. La plupart des cellules résidentes du système nerveux central comme les astrocytes, les neurones et les oligodendrocytes expriment, au moins dans un contexte inflammatoire, des molécules du complexe majeur d’histocompatibilité de classe I (CMH-I), et peuvent donc, théoriquement, être la cible des LT CD8 [ 11]. Contrastant avec la diversité du répertoire des LT CD4, plusieurs travaux concordants montrent le caractère oligoclonal des LT CD8 isolés du parenchyme cérébral [ 8]. L’ensemble de ces arguments, bien qu’indirects, étayent donc le rôle potentiel des LT CD8 dans la physiopathologie de la SEP.
(→) Voir la Synthèse de Céline Louapre et al., m/s n° 12, décembre 2013, page 1105
Autres pathologies inflammatoires du système nerveux central impliquant les LT CD8 • Les syndromes neurologiques paranéoplasiques Les syndromes neurologiques paranéoplasiques représentent un groupe rare et polymorphe de troubles neurologiques précédant ou accompagnant un cancer. Les syndromes neurologiques paranéoplasiques sont étroitement liés au développement d’une réponse immunitaire antitumorale dirigée contre des antigènes communs aux cellules cancéreuses et au système nerveux, appelés antigènes onconeuronaux. Cette réponse est responsable de dommages tissulaires du système nerveux central [ 12]. Parmi les syndromes neurologiques paranéoplasiques, le plus fréquent et le mieux documenté est le syndrome anti-Hu. Il survient principalement chez des patients atteints d’un cancer du poumon à petites cellules exprimant l’antigène onconeuronal Hu. Les antigènes intracellulaires Hu sont exprimés constitutivement par les neurones, et également par les cellules tumorales. L’existence dans le sang d’une réponse lymphocytaire T CD8 cytotoxique vis-à-vis de l’antigène Hu reste débattue [ 13], mais l’analyse histologique des lésions cérébrales au cours du syndrome anti-Hu montre que les infiltrats inflammatoires sont majoritairement composés de LT CD8, qui dominent dans les infiltrats parenchymateux et forment des agrégats localisés à proximité des neurones. Les LT CD4 restent, quant à eux, principalement confinés au niveau des espaces périvasculaires [ 14]. Un contingent de ces LT CD8 présentent une polarisation de leurs granules cytotoxiques vers les neurones et expriment à leur surface des molécules CD107a 3, témoins du relargage de leurs granules cytolytiques. La présence à la surface des cellules tumorales et des neurones de molécules du CMH-I, chez les patients présentant un syndrome anti-Hu, suggère que ces cellules pourraient être la cible des LT CD8. Une réponse immunitaire antitumorale, qui serait relayée par des LT CD8 cytotoxiques, pourrait contribuer à la mort neuronale et donc aux dommages du système nerveux central observés au cours du syndrome anti-Hu. • Le diabète insipide central Dans certains cas de diabète insipide central 4 qualifiés d’idiopathiques, les LT CD8 pourraient participer à la destruction des neurones hypothalamiques producteurs d’arginine-vasopressine. En effet, la présence d’infiltrats lymphocytaires T majoritairement composés de LT CD8 a été rapportée chez un patient présentant un diabète insipide central [ 15]. Dans un modèle murin, il a par ailleurs été montré que des LT CD8 autoréactifs étaient capables d’induire un diabète insipide par la destruction des neurones hypothalamiques producteurs d’arginine-vasopressine [ 16]. • L’encéphalite de Rasmussen L’encéphalite de Rasmussen est une pathologie pédiatrique rare caractérisée par l’existence d’infiltrats lymphocytaires uni-hémisphériques, de nodules microgliaux et d’une destruction neuronale à l’origine de manifestations épileptiques. Des LT CD8 ayant subi une expansion clonale prédominent au sein des infiltrats cellulaires [ 17]. Un contingent de ces lymphocytes est directement apposé à des neurones et à des astrocytes exprimant des molécules du CMH de classe I. Dans ce contexte pathologique, les 2 types de cellules - astrocytes et neurones - semblent être la cible des LT CD8 exprimant le granzyme B [ 17]. Cependant, dans cette affection, la spécificité antigénique des LT CD8 intraparenchymateux reste inconnue. Rôle des LT CD8 dans les maladies infectieuses du système nerveux central et le syndrome inflammatoire de restauration immunitaire Les réponses lymphocytaires T CD8 cytotoxiques sont essentielles à la protection de l’hôte contre des agents infectieux ayant un tropisme pour le système nerveux central. Les LT CD8 peuvent cependant également participer aux dommages tissulaires que l’on observe notamment au cours d’un syndrome inflammatoire de restauration immunitaire (SIRI) 5 (voir plus loin). Apport des modèles expérimentaux d’infection du système nerveux central L’utilisation de modèles expérimentaux murins a permis de préciser le rôle des LT CD8 et de la coopération de ces cellules avec des LT CD4 dans la clairance d’agents pathogènes responsables d’infections du système nerveux central, mais aussi de la genèse de dommages tissulaires collatéraux. Les LT CD8 sont ainsi essentiels à la clairance ou au contrôle de nombreux virus, comme le virus West Nile
6. L’infection de souris RAG-/-
(dépourvues de lymphocytes B et T) ou CD8-/-
(privées de lymphocytes T CD8) par le virus West Nile se traduit par une encéphalite virale létale qui est atténuée par un transfert adoptif de LT CD8 [ 18, 40] ( →). Toutefois, chez des souris immunocompétentes, la létalité de l’infection par ce virus, associée à l’infiltration du parenchyme cérébral par des LT CD8 activés, est atténuée lorsque ces lymphocytes sont éliminés par un anticorps monoclonal spécifique. Ceci illustre la complexité du rôle des LT CD8 dans cette infection virale. Les cellules peuvent en effet avoir un rôle protecteur mais également potentiellement délétère. D’autres modèles suggèrent ce rôle potentiellement délétère des LT CD8. Ainsi, des LT CD8 isolés de cerveaux de rats infectés par le Bornavirus 7, sont capables, in vitro, de reconnaître et de détruire spécifiquement les neurones infectés [ 11]. De même, dans le modèle d’infection par le virus de la chorioméningite lymphocytaire (LCMV), les LT CD8 cytotoxiques sont responsables des dommages tissulaires [ 19].
(→) Voir la synthèse de Marion Lanteri et al., m/s n° 4, avril 2011, page 382
Rôle des LT CD8 dans les syndromes inflammatoires de restauration immunitaire associés aux leucoencéphalopathies multifocales progressives Une réponse immunitaire anti-infectieuse est généralement bénéfique en permettant l’éradication ou le contrôle du pathogène. Toutefois, elle peut être inadaptée et participer directement à la création de lésions tissulaires délétères. Le SIRI, associé aux leucoencéphalopathies multifocales progressives (LEMP), en est une des illustrations. Le polyomavirus JC8 est un virus à ADN ubiquitaire infectant jusqu’à 68 % de la population humaine adulte [20]. Chez le sujet immunocompétent, le virus JC infecte de manière latente les cellules épithéliales rénales, les tissus lymphoïdes et les précurseurs hématopoïétiques. Les effecteurs de l’immunité cellulaire, et notamment les LT CD8, sont cruciaux pour le maintien de la latence de ce virus. Cependant, une immunodépression, liée à l’infection par le VIH ou à l’utilisation d’immunosuppresseurs ou de biothérapies, favorise la réactivation du virus JC. Le virus est ainsi à l’origine d’une infection lytique des oligodendrocytes, de l’apparition de lésions multifocales de démyélinisation de la substance blanche et du tableau clinique de leucoencéphalopathie multifocale progressive. Chez les patients présentant une SEP, traités par le natalizumab (un anticorps monoclonal ciblant la sous-unité d’intégrine α4 et inhibant la migration des lymphocytes T et des monocytes vers le SNC), le risque de réactivation du virus JC est particulièrement élevé avec plus de 400 cas de LEMP rapportés à ce jour [21, 39] (Tableau II). En l’absence de traitement antiviral efficace, la restauration des réponses immunitaires dirigées contre le virus JC représente donc la seule alternative thérapeutique. La détection dans le sang de LT CD8 spécifiques du virus est ainsi associée à un meilleur pronostic de la LEMP [22]. Toutefois, cette restauration immunitaire n’est pas toujours bénéfique et peut s’associer à la survenue d’un SIRI. Ce syndrome résulte de la survenue, chez des patients immunodéprimés porteurs d’une infection opportuniste patente ou latente, de manifestations inflammatoires associées à la restauration immunitaire. Cette pathologie inflammatoire émergente a été particulièrement décrite chez des patients infectés par le VIH ayant débuté un traitement antirétroviral (ARV), mais peut aussi survenir lors de la levée d’une immunosuppression médicamenteuse [37]. Les SIRI affectant le système nerveux central au cours d’infections par le virus JC, par Mycobacterium tuberculosis ou par Cryptococcus neoformans, sont associés à une morbidité et une mortalité importantes. La physiopathologie du SIRI est mal connue. Les connaissances actuelles privilégient cependant l’hypothèse d’une réponse immunitaire anti-infectieuse d’intensité exacerbée qui serait responsable de dommages collatéraux au sein de l’organe cible (Figure 3) [23]. Le début du traitement ARV chez des patients infectés par le VIH, et porteurs d’une leucoencéphalopathie multifocale progressive, est associé à la survenue d’une LEMP-SIRI (association des deux pathologies) dans 16,7 % (2,3 à 50,7 %) des cas [24]. L’interruption du traitement par natalizumab (habituellement suivie d’échanges plasmatiques visant à accélérer la clairance de l’anticorps) chez des patients traités pour une SEP et ayant développé une LEMP est, quant à elle, associée à la survenue d’une LEMP-SIRI chez la quasi-totalité des patients [25]. Les travaux qui comparent les lésions de LEMP-SIRI et celles de LEMP « classiques » montrent, dans les premières, la réduction du nombre de cellules infectées par le virus JC et soulignent la nette prédominance des LT CD8 au sein des infiltrats parenchymateux [26]. Un contingent de ces LT CD8 infiltrant le système nerveux central expriment du granzyme B, témoignant du caractère effecteur de ces lymphocytes qui sont apposés à des oligodendrocytes infectés par le virus JC. Cette colocalisation, ainsi que la polarisation des granules de granzyme B vers les cellules infectées, suggèrent qu’une partie de ces LT CD8 infiltrant le système nerveux central seraient capables d’exercer une cytotoxicité vis-à-vis des oligodendrocytes infectés par le virus. Les oligodendrocytes qui expriment des molécules du CMH de classe I après leur infection par le virus sont en effet capables de présenter des peptides viraux aux LT CD8 spécifiques. La détection dans le sang de LT CD8 spécifiques du virus JC est par ailleurs associée à une probabilité accrue de développer une LEMP-SIRI [27]. Ces données suggèrent ainsi que la restauration d’une réponse lymphocytaire T CD8 spécifique du virus JC pourrait, en détruisant les oligodendrocytes infectés, permettre de contrôler l’infection au détriment de dommages tissulaires collatéraux responsables du SIRI.
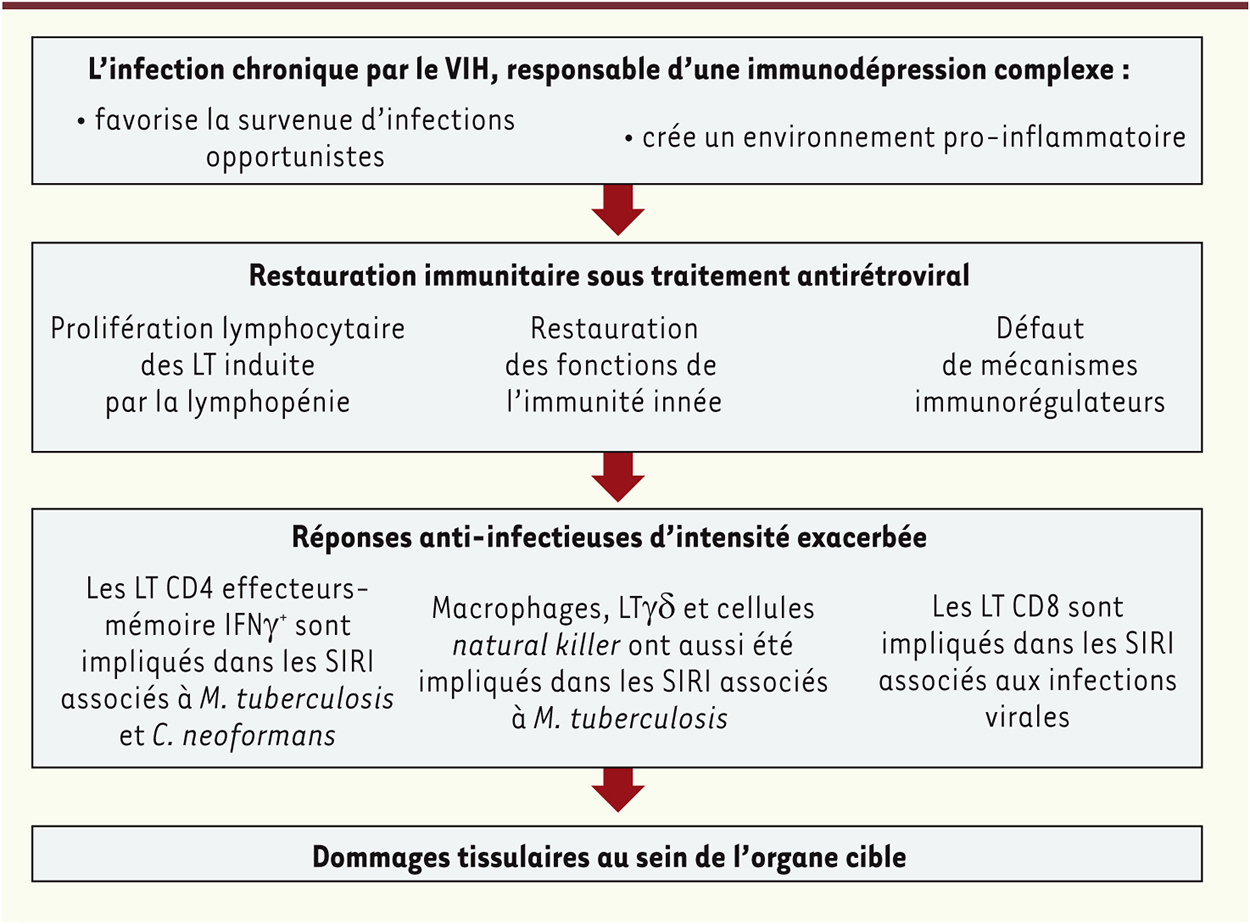
 | Figure 3.
Mécanismes physiopathologiques du SIRI. La compréhension actuelle des mécanismes générant le SIRI renforce l’idée d’une réponse immunitaire protectrice contrôlant la réplication du pathogène, mais dont l’intensité, exacerbée, est responsable de dommages tissulaires collatéraux. Les mécanismes effecteurs impliqués restent toutefois mal compris, notamment pour les SIRI secondaires à une infection virale (adapté de [ 23]). |
Tableau II.
|
|
Au cours de l’infection par le VIH à l’ère des traitements antirétroviraux |
Au cours d’un traitement par natalizumab pour sclérose en plaques |
|
LEMP*
|
Mécanismes |
Lymphopénie T CD4 induite par le VIH, et impact sur les fonctions lymphocytaires T CD8
Rôle activateur de la protéine Tat du VIH dans la réplication du virus JC |
Inhibition de la migration des lymphocytes T vers le SNC
Altération du répertoire des lymphocytes T
Diminution du nombre de cellules dendritiques au niveau des espaces périvasculaires
Mobilisation de précurseurs médullaires infectés de façon latente par le virus JC |
| Incidence |
1,3 à 3,3/1000/an |
0,09 à 11,1/1000/an |
| Formes inflammatoires** |
5 % |
40 % |
| Traitement |
Début d’un traitement antirétroviral |
Arrêt du natalizumab et échanges plasmatiques |
| Pronostic |
50 % de mortalité |
29 % de mortalité |
|
|
LEMP-SIRI
|
Mécanismes généraux |
Restauration des réponses immunitaires anti-virus JC après contrôle de la réplication du VIH |
Désaturation des sites de liaison d’α4β1 restaurant les capacités des lymphocytes accumulés en périphérie à migrer vers le SNC |
| Fréquence |
16,7 % (2,3-50,7) |
≈ 100 % |
| Délai de survenue |
Médiane de 7 semaines après le début du traitement antirétroviral |
2 à 3 mois après arrêt du natalizumab
2 à 3 semaines en cas d’échanges plasmatiques |
| Principaux diagnostics différentiels |
Évolution défavorable de la LEMP
Autre infection opportuniste |
Évolution défavorable de la LEMP
Poussée de SEP |
| Fréquence des prises de contraste IRM** |
9 à 57 % |
90 % |
| Composition cellulaire des infiltrats inflammatoires |
Nette dominance des LT CD8
Présence de lymphocytes B, de plasmocytes et de macrophages
Rares LT CD4 |
Infiltrats lymphocytaires T à prédominance de LT CD8 sur les LT CD4
Présence de lymphocytes B, de plasmocytes et de macrophages |
| Traitement |
Pas de recommandation
Corticothérapie réservée aux formes mettant en jeu le pronostic vital
Intérêt des antagonistes de CCR5 ? |
Corticothérapie intraveineuse à forte dose recommandée, suivie d’un relais oral
Intérêt des antagonistes de CCR5 ? |
| Pronostic |
Pas d’impact sur la mortalité due à la LEMP |
50 % des décès dus aux LEMP sous natalizumab |
Principales différences entre LEMP et LEMP-SIRI au cours de l’infection par le VIH ou d’un traitement par natalizumab pour sclérose en plaques. |
La prise en charge thérapeutique des LEMP-SIRI repose, pour les cas les plus sévères, sur la corticothérapie dont le potentiel effet délétère sur la restauration des réponses immunitaires spécifiques du virus a été montré [28]. Il faut noter que les LT CD8 ont également été impliqués dans les rares cas de SIRI associés à l’infection du système nerveux central par le parasite Toxoplasma gondii [29] ou par le VIH lui-même [30]. |
Perspectives thérapeutiques À ce jour, aucune des thérapeutiques récemment développées pour remédier à la SEP ne cible spécifiquement les LT CD8. L’alemtuzumab, un anticorps monoclonal anti-CD529, réduit significativement la fréquence des rechutes et l’apparition de nouvelles lésions chez les patients atteints de forme récurrente-rémittente de la maladie. Cet anticorps élimine, de façon globale et durable, tant les populations lymphocytaires T CD4 que CD8 et, de façon plus transitoire, les lymphocytes B. Le natalizumab a montré son efficacité dans le traitement de cette forme de SEP en réduisant le nombre de poussées et en limitant l’accumulation du handicap. Il affecte cependant la transmigration des lymphocytes T CD4 et CD8, des monocytes et des cellules dendritiques myéloïdes et plasmacytoïdes circulantes [31]. Le FTY72010, un agoniste des récepteurs du sphingosine-1 phosphate, qui inhibe de manière non spécifique la sortie des lymphocytes des ganglions lymphatiques et du thymus, a montré son efficacité au cours la SEP [32, 39]. Ainsi, l’identification de molécules spécifiquement impliquées dans la migration des LT CD8 générateurs d’encéphalites permettrait de bloquer leur recrutement vers le système nerveux central, tout en respectant la migration des cellules nécessaires à l’immunosurveillance du SNC, limitant ainsi le risque de développer une infection opportuniste associée, par exemple, à une déplétion lymphocytaire T CD8 profonde. Des approches thérapeutiques visant à moduler la réponse inflammatoire sans compromettre la restauration immunitaire sont nécessaires au cours du SIRI. Dans cette optique, il a été suggéré que les antagonistes de CCR5 puissent être bénéfiques dans la prévention et le traitement des LEMP-SIRI [33, 34]. CCR5 est un récepteur de chimiokines (principalement des C-C motif chemokines, CCL-3, -4 et -5) impliqué dans l’activation des lymphocytes T et leur migration vers les sites inflammatoires [35]. Les antagonistes de ce récepteur ont été initialement développés pour leurs propriétés antivirales permettant d’inhiber les interactions entre le VIH et CCR5, le principal corécepteur du virus. Parmi ces molécules, le maraviroc, un antagoniste compétitif du CCR5 qui est utilisé pour prévenir l’entrée du virus dans ses cellules cibles, a intégré l’arsenal thérapeutique contre ce virus. Nous avons récemment montré que 87 à 100 % des LT CD8 infiltrant les lésions de LEMP-SIRI expriment le récepteur CCR5, que ce soit au cours de l’infection par le VIH ou chez des patients traités par le natalizumab pour une SEP, confortant le rationnel de l’utilisation du maraviroc pour cette indication. Il est cependant nécessaire de réaliser des études cliniques permettant d’évaluer son intérêt thérapeutique dans ces indications [36]. |
Les LT CD8 ont un rôle fondamental dans le contrôle des agents infectieux neurotropes. Leur activation, si elle n’est pas régulée, ou leur autoréactivité, peuvent toutefois être responsables de dommages tissulaires délétères. Une attention croissante est portée à l’implication des LT CD8 dans les maladies inflammatoires du système nerveux central, et le développement de stratégies thérapeutiques ciblant les lymphocytes CD8 apparaît de plus en plus nécessaire. Les modalités de migration de ces lymphocytes vers le système nerveux central restent mal connues. L’identification des molécules impliquées dans cette migration pourrait permettre d’envisager une stratégie fondée sur un blocage plus sélectif des populations lymphocytaires T CD8 génératrices d’encéphalites. Ainsi, l’inhibition de CCR5 par des antagonistes déjà utilisés en pratique clinique pour le traitement de l’infection par le VIH pourrait représenter une perspective thérapeutique pertinente pour moduler la réponse inflammatoire au cours des LEMP-SIRI. L’intérêt des antagonistes de CCR5 dans d’autres pathologies inflammatoires du système nerveux qui impliquent les LT CD8 reste également à déterminer. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Engelhardt B, Ransohoff RM. Capture, crawl, cross: the T cell code to breach the blood-brain barriers . Trends Immunol. 2012; ; 33 : :579.–589. 2.
Battistini L, Piccio L, Rossi B, et al. CD8+ T cells from patients with acute multiple sclerosis display selective increase of adhesiveness in brain venules: a critical role for P-selectin glycoprotein ligand-1 . Blood. 2003; ; 101 : :4775.–4782. 3.
Na SY, Hermann A, Sanchez-Ruiz M, et al. Oligodendrocytes enforce immune tolerance of the uninfected brain by purging the peripheral repertoire of autoreactive CD8+ T cells . Immunity. 2012; ; 37 : :134.–146. 4.
Kooij G, Kroon J, Paul D, et al. P-glycoprotein regulates trafficking of CD8+ T cells to the brain parenchyma . Acta Neuropathol. 2014; ; 127 : :699.–711. 5.
Compston A, Coles A. Multiple sclerosis . Lancet. 2008; ; 372 : :1502.–1517. 6.
Crawford MP, Yan SX, Ortega SB, et al. High prevalence of autoreactive, neuroantigen-specific CD8+ T cells in multiple sclerosis revealed by novel flow cytometric assay . Blood. 2004; ; 103 : :4222.–4231. 7.
Jilek S, Schluep M, Rossetti AO, et al. CSF enrichment of highly differentiated CD8+ T cells in early multiple sclerosis . Clin Immunol. 2007; ; 123 : :105.–113. 8.
Babbe H, Roers A, Waisman A, et al. Clonal expansions of CD8+ T cells dominate the T cell infiltrate in active multiple sclerosis lesions as shown by micromanipulation and single cell polymerase chain reaction . J Exp Med. 2000; ; 192 : :393.–404. 9.
Neumann H, Medana IM, Bauer J, Lassmann H. Cytotoxic T lymphocytes in autoimmune and degenerative CNS diseases . Trends Neurosci. 2002; ; 25 : :313.–319. 10.
Serafini B, Rosicarelli B, Magliozzi R, et al. Dendritic cells in multiple sclerosis lesions: maturation stage, myelin uptake, and interaction with proliferating T cells . J Neuropathol Exp Neurol. 2006; ; 65 : :124.–141. 11.
Chevalier G, Suberbielle E, Monnet C, et al. Neurons are MHC class I-dependent targets for CD8 T cells upon neurotropic viral infection . PLoS Pathog. 2011; ; 7 : :e1002393.. 12.
Pignolet BS, Gebauer CM, Liblau RS. Immunopathogenesis of paraneoplastic neurological syndromes associated with anti-Hu antibodies: a beneficial antitumor immune response going awry . Oncoimmunology. 2013; ; 2 : :e27384.. 13.
De Beukelaar JW, Verjans GM, van Norden Y, et al. No evidence for circulating HuD-specific CD8+ T cells in patients with paraneoplastic neurological syndromes and Hu antibodies . Cancer Immunol Immunother. 2007; ; 56 : :1501.–1506. 14.
Bien CG, Vincent A, Barnett MH, et al. Immunopathology of autoantibody-associated encephalitides: clues for pathogenesis . Brain. 2012; ; 135 : :1622.–1638. 15.
Waki K, Yamada S, Ozawa Y, et al. A case of lymphocytic infundibuloneurohypophysitis: histophathological studies . Pituitary. 1999; ; 1 : :285.–290. 16.
Scheikl T, Pignolet B, Dalard C, et al. Cutting edge: neuronal recognition by CD8 T cells elicits central diabetes insipidus . J Immunol. 2012; ; 188 : :4731.–4735. 17.
Bien CG, Bauer J, Deckwerth TL, et al. Destruction of neurons by cytotoxic T cells: a new pathogenic mechanism in Rasmussen’s encephalitis . Ann Neurol. 2002; ; 51 : :311.–318. 18.
Brien JD, Uhrlaub JL, Nikolich-Zugich J. Protective capacity and epitope specificity of CD8+ T cells responding to lethal West Nile virus infection . Eur J Immunol. 2007; ; 37 : :1855.–1863. 19.
Pinschewer DD, Schedensack M, Bergthaler A, et al. T cells can mediate viral clearance from ependyma but not from brain parenchyma in a major histocompatibility class I- and perforin-independent manner . Brain. 2010; ; 133 : :1054.–1066. 20.
Brew BJ, Davies NW, Cinque P, et al. Progressive multifocal leukoencephalopathy and other forms of JC virus disease . Nat Rev Neurol. 2010; ; 6 : :667.–679. 21.
Bloomgren G, Richman S, Hotermans C, et al. Risk of natalizumab-associated progressive multifocal leukoencephalopathy . N Engl J Med. 2012; ; 366 : :1870.–1880. 22.
Du Pasquier RA, Kuroda MJ, Zheng Y, et al. A prospective study demonstrates an association between JC virus-specific cytotoxic T lymphocytes and the early control of progressive multifocal leukoencephalopathy . Brain. 2004; ; 127 : :1970.–1978. 23.
Martin-Blondel G, Delobel P, Blancher A, et al. Pathogenesis of the immune reconstitution inflammatory syndrome affecting the central nervous system in patients infected with HIV . Brain. 2011; ; 134 : :928.–946. 24.
Muller M, Wandel S, Colebunders R, et al. Immune reconstitution inflammatory syndrome in patients starting antiretroviral therapy for HIV infection: a systematic review and meta-analysis . Lancet Infect Dis. 2010; ; 10 : :251.–261. 25.
Vermersch P, Kappos L, Gold R, et al. Clinical outcomes of natalizumab-associated progressive multifocal leukoencephalopathy . Neurology. 2011; ; 76 : :1697.–1704. 26.
Martin-Blondel G, Bauer J, Cuvinciuc V, et al. In situ evidence of JC virus control by CD8+ T cells in PML-IRIS during HIV infection . Neurology. 2013; ; 81 : :964.–970. 27.
Marzocchetti A, Tompkins T, Clifford DB, et al. Determinants of survival in progressive multifocal leukoencephalopathy . Neurology. 2009; ; 73 : :1551.–1558. 28.
Antoniol C, Jilek S, Schluep M, et al. Impairment of JCV-specific T-cell response by corticotherapy: effect on PML-IRIS management? Neurology. 2012; ; 79 : :2258.–2264. 29.
Martin-Blondel G, Alvarez M, Delobel P, et al. Toxoplasmic encephalitis IRIS in HIV-infected patients: a case series and review of the literature . J Neurol Neurosurg Psychiatry. 2011; ; 82 : :691.–693. 30.
Gray F, Bazille C, Adle-Biassette H, et al. Central nervous system immune reconstitution disease in acquired immunodeficiency syndrome patients receiving highly active antiretroviral treatment . J Neurovirol. 2005; ; 11 ((suppl 3)) : :16.–22. 31.
Polman CH, O’Connor PW, Havrdova E, et al. A randomized, placebo-controlled trial of natalizumab for relapsing multiple sclerosis . N Engl J Med. 2006; ; 354 : :899.–910. 32.
Kappos L, Radue EW, O’Connor P, et al. A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis . N Engl J Med. 2010; ; 362 : :387.–401. 33.
Giacomini PS, Rozenberg A, Metz I, et al. Maraviroc and JC virus-associated immune reconstitution inflammatory syndrome . N Engl J Med. 2014; ; 370 : :486.–488. 34.
Martin-Blondel G, Cuzin L, Delobel P, et al. Is maraviroc beneficial in paradoxical progressive multifocal leukoencephalopathy-immune reconstitution inflammatory syndrome management? Aids. 2009; ; 23 : :2545.–2546. 35.
Molon B, Gri G, Bettella M, et al. T cell costimulation by chemokine receptors . Nat Immunol. 2005; ; 6 : :465.–471. 36.
Martin-Blondel G, Bauer J, Uro-Coste E, et al. Therapeutic use of CCR5 antagonists is supported by strong expression of CCR5 on CD8 T cells in progressive multifocal leukoencephalopathy-associated immune reconstitution inflammatory syndrome . Acta Neuropathol. 2015; ; 129 : :463.–465. 37.
Chakrabarti LA, Lortholary O. L’IRIS : une réaction inflammatoire paradoxale chez les patients traités simultanément pour une tuberculose et une infection par le VIH . Med Sci (Paris). 2015; ; 31 : :53.–59. 38.
Breton G. Syndrome inflammatoire de reconstitution immune . Med Sci (Paris). 2010; ; 26 : :281.–289. 39.
Louapre C, Maillart E, Papeix C, Lubetzki C. Nouveautés thérapeutiques et stratégies émergentes dans la sclérose en plaques . Med Sci (Paris). 2013; ; 29 : :1105.–1110. 40.
Lanteri MC, Diamond MS, Norris PJ, Busch MP. Infection par le virus West Nile chez l’homme. II. Aspects physiopathologiques et réponses immunitaires . Med Sci (Paris). 2011; ; 27 : :382.–386. |