La vision est assurée au sein de la rétine par deux types distincts de photorécepteurs possédant une morphologie caractéristique : les bâtonnets et les cônes. Les bâtonnets sont très sensibles à la lumière et fonctionnent à très basse luminance. Ils sont saturés à la lumière du jour. Les cônes sont à l’origine de la vision des couleurs, mais aussi de la vision des détails de jour. Ils possèdent trois sensibilités spectrales différentes chez l’homme et chez la plupart des primates. L’opsine des bâtonnets et les trois opsines des cônes (bleue, rouge et verte) sont des protéines membranaires qui comportent une liaison covalente avec un chromophore dérivé de la vitamine A. Celui-ci s’isomérise par capture de l’énergie produite par les photons incidents. L’isomérisation a lieu dans un espace central, défini par les sept hélices transmembranaires des opsines, et provoque un changement de conformation de la molécule d’opsine. Ce changement de conformation constitue un signal relayé par une protéine G, la transducine. La cascade enzymatique qui en découle hyperpolarise le photorécepteur. Ce signal est ensuite transmis aux autres neurones de la rétine via des neurotransmetteurs, dont en particulier le glutamate. Ce signal électrochimique est finalement décodé par les aires visuelles corticales après transfert via le nerf optique.
Le fonctionnement du système impose que les opsines soient enchâssées dans une bicouche lipidique de fluidité optimale. C’est la composition originale en lipides, comprenant des acides gras polyinsaturés, qui est responsable de cette fluidité permettant à l’opsine de se reconformer dans la membrane sous l’effet de la lumière. Ce dispositif optique présente cependant une contrepartie fâcheuse : le taux d’insaturation des acides gras est proportionnel à leur tendance à s’oxyder. Du fait de leur localisation au site de capture des photons, ces acides gras sont soumis quotidiennement à des réactions de photo-oxydation qui les dégradent progressivement. Une solution à ce problème pourrait être une régénération fréquente des photorécepteurs, mais ceux-ci étant des neurones post-mitotiques, ils ne se reproduisent pas. Afin de conserver la fonction des photorécepteurs, les lipides oxydés sont donc éliminés par phagocytose réalisée par l’épithélium pigmenté rétinien. C’est très certainement cette fonction qui a imposé une architecture particulière à la rétine au cours de l’évolution. Pour augmenter la sensibilité des photorécepteurs, les opsines sont en effet déployées dans des bicouches lipidiques qui s’empilent en disques membranaires, formant le segment externe du photorécepteur. C’est la forme de ce segment externe qui permet de distinguer les bâtonnets des cônes. Ce segment n’est pas placé vers la lumière, comme quiconque pourrait le penser intuitivement, mais à l’opposé du flux lumineux, tourné vers l’épithélium pigmenté rétinien. La lumière parcourt donc plusieurs couches de neurones de la rétine (la rétine interne) avant de frapper le chromophore.
Le segment avalé par les cellules de l’épithélium pigmenté est dégradé et certaines molécules le constituant, comme les acides gras, sont recyclées par les photorécepteurs. Le rythme d’élimination des segments externes est effréné : plus de 10% du segment externe des bâtonnets est éliminé chaque jour. Un mécanisme d’élimination identique serait à l’œuvre au sein des cônes [1]. Afin d’assurer la continuité du système, les segments externes sont renouvelés au même rythme soutenu. Ceci représente un coût énergétique astronomique pour les photorécepteurs, qui ne peuvent s’approvisionner directement dans la circulation sanguine puisque la rétine externe est avasculaire. Cette énergie est donc fournie par la circulation sanguine choroïdienne, via l’épithélium pigmenté rétinien (Figure 1). Cette circulation choroïdienne, qui a le débit le plus élevé de tout l’organisme, approvisionne les photorécepteurs en oxygène, nutriments et vitamine A.
| Figure 1.
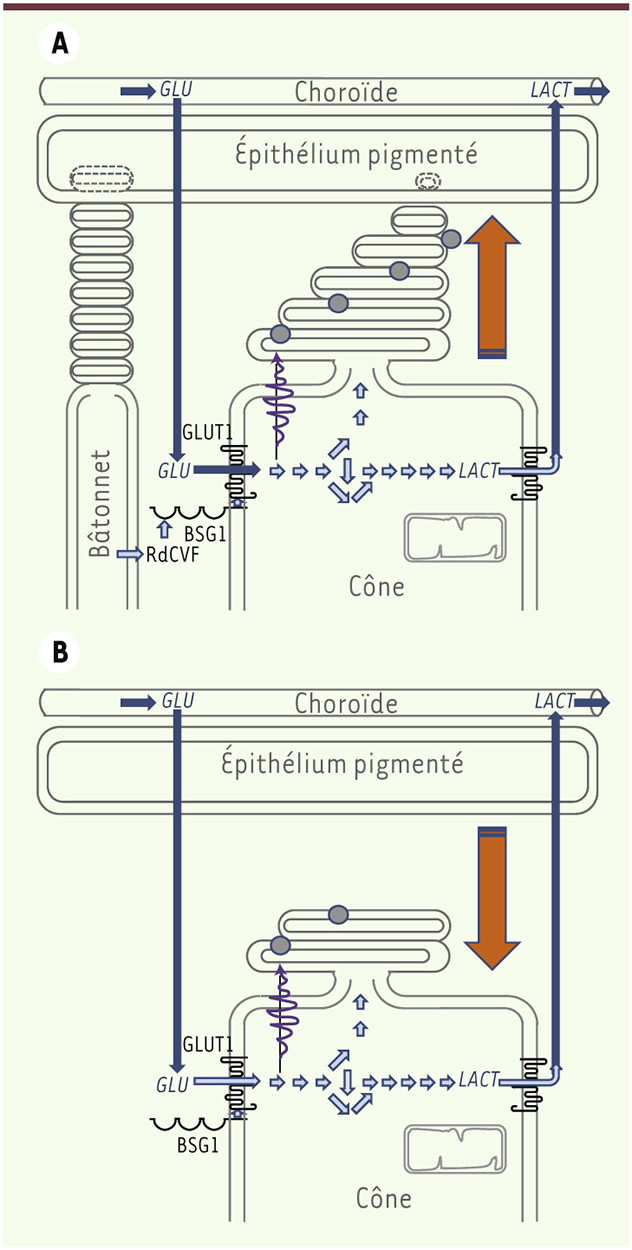
A. Dans la rétine saine, RdCVF, produit et sécrété par les bâtonnets, stimule la glycolyse aérobie qui participe au renouvellement du segment externe des cônes. B. Après dégénérescence des bâtonnets dans la rétine d’un patient atteint de rétinopathie pigmentaire, la perte d’expression de RdCVF qui en résulte provoque le raccourcissement du segment externe des cônes et la perte de la vision centrale conduisant à la cécité. |
Les photorécepteurs sont des capteurs ultraperformants : les bâtonnets peuvent détecter un photon unique. Mais ces capacités se font au prix d’une dépense énergétique extrême. Ainsi, le fait que certaines dégénérescences héréditaires asyndromiques des photorécepteurs soient causées par des mutations dans des gènes d’expression ubiquitaire, comme les facteurs d’épissage, s’explique sans doute par le fait que les photorécepteurs imposent à la machinerie d’expression protéique un rythme aux limites de sa capacité maximale. Pour la dégénérescence rétinienne héréditaire la plus prévalente, la rétinopathie pigmentaire, les 57 mutations identifiées à ce jour entrainent chacune la mort des photorécepteurs à bâtonnets1. Dans certains des cas, l’expression de ces gènes mutés est limitée aux bâtonnets, et la dégénérescence des cônes n’intervient que dans un deuxième temps, provoquant la cécité. Le mécanisme entraînant cette dégénérescence des cônes n’était pas encore compris et c’est cette question que nos travaux ont abordée ces dernières années, liant dans un même élan une recherche biologique et médicale. Nos premiers travaux avaient montré que la viabilité des cônes dépendait de molécules produites par les bâtonnets. Dès 2004, nous avions identifié un acteur de cette signalisation, le facteur de viabilité des cônes RdCVF, nommé en référence à son rôle « rod-derived cone viability factor » [2, 3]. Reste que comme RdCVF constituait le prototype d’une nouvelle famille, sa découverte n’éclairait en rien le mécanisme d’action sous-jacent. RdCVF est un produit d’épissage alternatif du gène NXNL1 (nucleoredoxin-like 1) qui code aussi pour une enzyme de type thiorédoxine qui protège les bâtonnets des dommages causés par le stress photo-oxydatif [4]. Les thiorédoxines sont essentielles à l’homéostasie redox car elles réduisent les groupements sulfures des cystéines oxydées dans les protéines. RdCVF ne possédant pas de domaine thiorédoxine fonctionnel, il nous a fallu chercher ailleurs. Les thiorédoxines sont toutes sécrétées, mais aucun récepteur de surface n’avait été identifié alors que des expériences préliminaires d’interaction indiquaient l’existence d’un site de liaison spécifique de RdCVF à la surface des cônes. Nous avons eu recours aux rétines de poulet pour identifier ce récepteur comme nous avions fait précédemment pour identifier RdCVF par criblage haut contenu [2]. Contrairement aux mammifères, chez lesquels les bâtonnets dominent du fait des mœurs nocturnes de leurs ancêtres, les oiseaux descendant des dinosaures ont une vision diurne et une majorité de photorécepteurs à cônes. Cet artifice biologique a grandement facilité l’identification par spectrométrie de masse d’une protéine, basigin-1 (BSG1), possédant un seul domaine transmembranaire interagissant avec RdCVF à la surface des cônes [5]. BSG1 est un épissage alternatif du gène BSG, spécifiquement exprimé par les photorécepteurs, qui possède un domaine extracellulaire additionnel impliqué dans sa liaison avec RdCVF [6]. L’inhibition de son expression par les cônes à l’aide d’ARN interférence bloquant les effets protecteurs de RdCVF, nous avions là le récepteur transmettant le signal de survie. BSG1 était encore récemment considéré comme un récepteur de surface orphelin, sans ligand identifié, ligand que nous avons maintenant trouvé, mais aussi malheureusement sans signalisation intracellulaire décrite [7]. Il nous a donc fallu identifier le partenaire de BSG1 par protéomique pour élucider le mécanisme d’action de RdCVF. BSG1 forme un complexe avec le transporteur du glucose GLUT1 (glucose transporter protein type 1) (codé par le gène SLC2A1) à la surface des cônes. RdCVF stimule le transport du glucose en augmentant, sans doute allostériquement, la vitesse (Vmax) d’entrée du glucose dans les cônes. Nous n’en étions pas à notre dernière surprise, car le glucose est métabolisé par les cônes par la glycolyse aérobie, comme les cellules cancéreuses. Otto Warburg qui fit initialement cette observation avait reconnu à son époque que la rétine faisait exception à cette règle, nous en connaissons aujourd’hui la raison. Le glucose est utilisé pour produire des métabolites par glycolyse, dont le glycérol-3-phosphate qui entre dans la composition des lipides des segments externes des cônes (Figure 1). Les bâtonnets, qui sont issus des cônes durant l’évolution [8], ont donc conservé jusqu’à nos jours cette interaction altruiste envers les cônes qui est à l’origine de la stratégie thérapeutique que nous conduisons aujourd’hui en clinique. Celle-ci repose sur la restauration de cette signalisation par administration de RdCVF par thérapie génique pour prévenir la dégénérescence secondaire des cônes, et donc maintenir la vision centrale chez les patients souffrant de rétinopathie pigmentaire indépendamment du gène, parmi les 57 connus, causant la maladie [9].