Les récepteurs couplés aux protéines G (RCPG), dont on compte plusieurs centaines de membres, représentent la plus grande famille de récepteurs membranaires1 [17]. Ils sont impliqués dans de nombreux processus pathologiques et représentent actuellement environ 30 % des cibles thérapeutiques médicamenteuses.
Les signaux résultant de l’activation des RCPG, et par conséquent leurs effets physiologiques, dépendent de leur densité à la surface cellulaire et de leur adressage dans des régions spécifiques de la membrane plasmique telles que les synapses pour les cellules neuronales. La plupart des données actuelles sur le trafic cellulaire des RCPG concernent leur internalisation (par endocytose) après qu’ils aient été activés par leurs ligands agonistes, leur recyclage ou leur orientation vers la voie de dégradation lysosomiale. En revanche, les mécanismes qui régulent l’export de ces récepteurs des compartiments de biosynthèse vers la surface cellulaire, sont beaucoup moins bien connus. En effet, il est généralement admis que les RCPG nouvellement synthétisés sont localisés dans des vésicules qui fusionnent avec la membrane plasmique sans contrôle particulier (voie de sécrétion non régulée). Cependant, de nombreuses observations indiquent que le trafic de ces récepteurs vers la surface cellulaire pourrait être régulé par des interactions avec certaines protéines et par des signaux extra-cellulaires. Des études récentes démontrent que pour de nombreux RCPG, une proportion importante des récepteurs est retenue dans des compartiments intracellulaires comme le réticulum endoplasmique (RE) ou l’appareil de Golgi [1]. Ces « réserves » peuvent être mobilisables vers la membrane plasmique en réponse à une stimulation physiologique qui nécessite une augmentation rapide de la réceptivité cellulaire [2, 3]. De plus, dans des expériences d’expression des RCPG dans des cellules modèles ne les exprimant pas naturellement (expression hétérologue), il a été montré que beaucoup d’entre eux nécessitent une association à des protéines d’escorte ou à des chaperons moléculaires pour être correctement exprimés à la surface. Les récepteurs olfactifs en sont un des exemples les plus connus et cette caractéristique a pendant longtemps empêché leur étude fonctionnelle in vitro [1]. Dans plusieurs pathologies humaines, comme le diabète insipide néphrogénique, la rétinite pigmentaire, l’obésité ou l’hypogonadisme, des mutations somatiques des RCPG [4] ou de protéines nécessaires à leur maturation [5], sont à l’origine d’un excès de rétention dans les compartiments intracellulaires. Ce défaut s’accompagne d’une altération de la réceptivité à la surface des cellules qui est directement responsable des effets pathologiques observés. Ces récepteurs séquestrés sont cependant potentiellement fonctionnels. Leur capacité de signalisation peut en effet être récupérée sous l’action de chaperons pharmacologiques, capables de franchir les membranes cellulaires et de se lier à eux pour favoriser leur adressage en surface [6, 7].
Un des RCPG les plus étudiés comme modèle de rétention intracellulaire est la sous-unité GB1 du récepteur métabotropique GABAB. Le GABA (acide gamma-amino butyrique) est le principal neuromédiateur inhibiteur du cerveau. Il contrôle de nombreuses fonctions sensorimotrices et cognitives. Les récepteurs GABAB sont des hétérodimères obligatoires composés de deux sous unités GB1 et GB2. Dans l’hétérodimère, GB1 lie le GABA, tandis que GB2 est responsable de l’activation de la protéine G ; en absence de formation de l’hétérodimère, il ne peut donc pas y avoir de récepteurs GABAB fonctionnels. La sous-unité GB1, exprimée seule, est retenue de manière constitutive dans le réticulum endoplasmique. Elle n’est libérée puis adressée vers la surface cellulaire que lors de son association avec GB2 [8]. Un signal de rétention de type RXR (arginine, acide aminé indifférent, arginine), présent au niveau de la queue cytoplasmique de GB1, doit être masqué après interaction avec GB2 pour permettre la libération de l’hétérodimère GABAB et son adressage vers la membrane plasmique. Ainsi, la mutation ou la délétion de ce motif, induisent une expression constitutive de GB1 à la surface cellulaire, indépendamment de la présence de GB2 [9]. Cependant, un des aspects de cette mécanistique de rétention de GB1 manquait : l’identification du partenaire moléculaire retenant GB1 au niveau du réticulum endoplasmique.
Nous avons récemment identifié ce partenaire. Il s’agit de PRAF2 (prenylated rab acceptor domain family member 2, aussi connue sous le nom de JM4), une protéine déjà connue mais dont la fonction biologique précise n’avait pas encore été découverte [10]. PRAF2 est un membre de la famille PRAF. Ces protéines, possédant 4 domaines transmembranaires, sont localisées principalement dans l’appareil de Golgi (PRAF1) ou le réticulum endoplasmique (PRAF2 et 3). PRAF1 a été caractérisée comme l’homologue de la protéine de levure Yip3, qui est impliquée dans le transport vésiculaire [11]. Dans le système nerveux central, PRAF1 interagit avec Piccolo, une protéine pré-synaptique des neurones de l’hippocampe [12]. PRAF3 (aussi connue sous les noms de JWA, GTRAP-3-18 ou Arl6-IP5) a été initialement décrite comme un régulateur négatif de l’expression de surface du transporteur du glutamate EEAC1 [13].
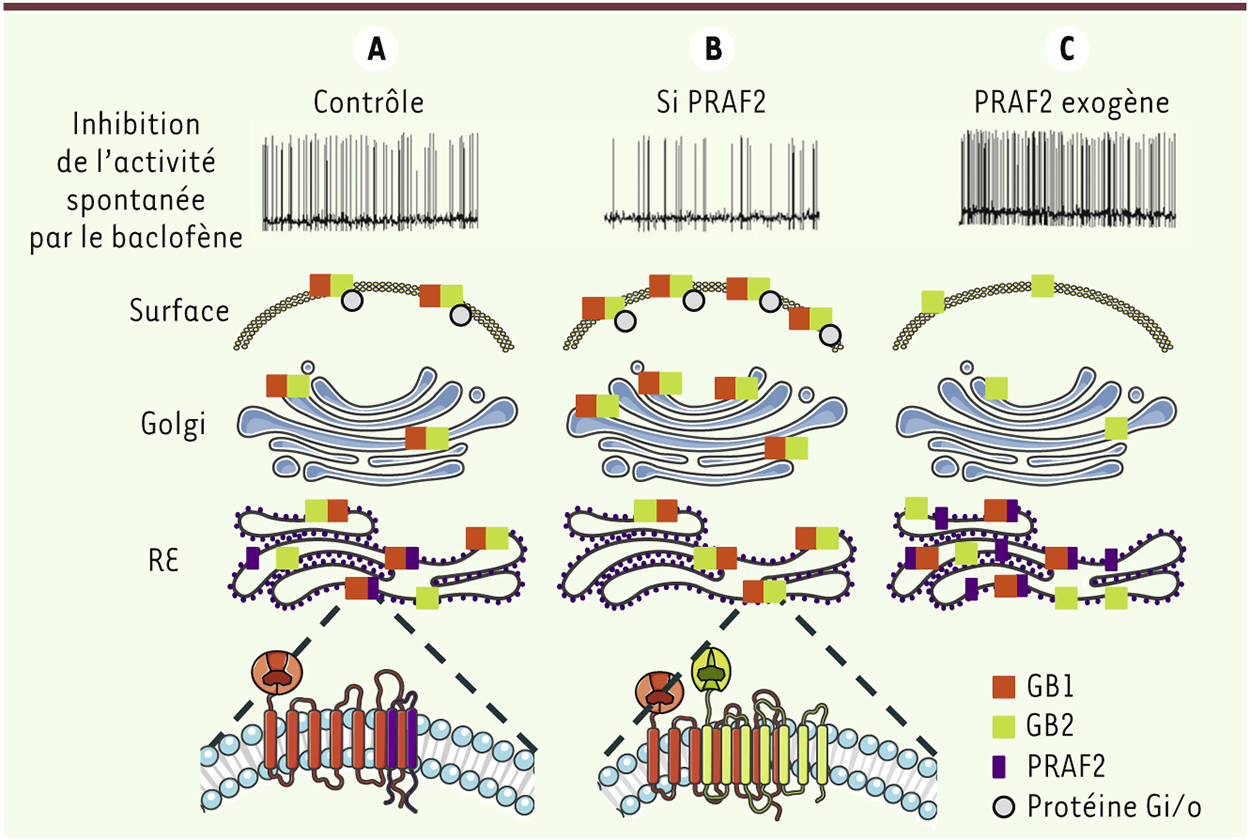
PRAF2 interagit avec la sous-unité GB1 de GABAB, au niveau du motif RXR. Nous avons montré que la surexpression de PRAF2 dans les neurones de l’hippocampe empêchait l’expression des récepteurs GABAB au niveau de la membrane plasmique. GB1 s’accumule dans le réticulum endoplasmique, PRAF2 s’opposant à sa libération induite par GB2. La variation d’expression de surface du récepteur qui en résulte, dans le cas d’une expression exogène de PRAF2, est corrélée à un effet fonctionnel marqué. Ainsi, les neurones exprimant plus (par expression exogène) ou moins (par interférence ARN) de PRAF2, sont respectivement moins, ou plus, sensibles aux agonistes du GABAB (Figure 1). De façon remarquable, la surexpression de PRAF2 dans un noyau moteur du cerveau (l’aire tegmentale ventrale) induit un comportement hyperactif chez les souris, dû à une diminution de récepteurs GABAB à la surface des neurones dopaminergiques ; en l’absence de récepteurs GABAB inhibiteurs, l’effet moteur dopaminergique est libéré [10]. Ce changement comportemental n’est pas sans rappeler celui observé chez les enfants hyperactifs. Il est d’ailleurs intéressant de noter que l’hyperactivité des souris surexprimant PRAF2 est également normalisée, comme chez les enfants hyperactifs, par l’amphétamine ou le méthylphénidate (Ritaline®) (données non publiées). Il est probable que les variations d’expression de PRAF2 soient associées à d’autres maladies humaines impliquant les récepteurs GABAB. La présence de PRAF2 est notamment diminuée chez des patients alcooliques [14] ou dans un modèle de rats génétiquement sélectionnés pour leur préférence de l’alcool (données non publiées). Cette diminution a été observée dans l’hippocampe, une structure du cerveau impliquée dans la mémoire et l’apprentissage, dont le dysfonctionnement peut conduire à des comportements compulsifs. Il est donc possible que la diminution de PRAF2 dans cette structure soit à l’origine de l’augmentation de l’expression de surface des récepteurs GABAB dans les neurones et participe aux modifications comportementales pouvant conduire à un excès de consommation d’alcool2 [18] (→). Inversement, du fait de l’absence d’inhibition tonique exercée par les récepteurs GABAB sur les neurones, la surexpression de PRAF2 dans cette même structure pourrait induire des crises spontanées d’épilepsie ou d’anxiété [15, 16]. De nombreuses mutations ponctuelles non synonymes (i.e. avec changement d’acide aminé) de PRAF2 ont été répertoriées dans les bases de données, notamment dans les régions d’interaction avec GB1 (domaines amino- et carboxy-terminaux de PRAF2), mais leurs conséquences fonctionnelles ou leurs relations avec une maladie n’ont pas encore été étudiées. PRAF2 est une protéine ubiquitaire. Elle régule vraisemblablement, par le même mécanisme de rétention, d’autres récepteurs couplés aux protéines G. Il est donc possible que cette protéine soit impliquée dans des maladies humaines associées à un mauvais adressage de récepteurs à la surface cellulaire. Elle représente, de ce fait, une nouvelle cible thérapeutique.
(→) Voir la Nouvelle d’A. Guyon, m/s n° 1, janvier 2014, page 9
| Figure 1.
La rétention et la libération de GB1 sont régulées par l’expression relative de PRAF2 et de GB2. A. Dans les neurones de l’hippocampe, PRAF2 et GB2 sont en compétition pour la liaison à GB1. L’hétérodimérisation de GB1 avec PRAF2 maintient la sous-unité dans le réticulum endoplasmique (RE) alors que l’association avec GB2 permet l’expression de surface d’un récepteur GABAB fonctionnel (GB1+GB2). L’inhibition de l’expression de PRAF2 par interférence ARN (siPRAF2, B) ou sa surexpression par production exogène (C) modifient la concentration des récepteurs GABAB à la surface des neurones. Ainsi, les neurones deviennent respectivement plus sensibles (B) ou moins sensibles (C) au baclofène, un agoniste GABAB, qui inhibe l’activité neuronale spontanée. |