2010
6-
Évolution de l’incidence du VHC chez les usagers de drogues en France
Combien d’usagers de drogues sont contaminés chaque année par le virus de l’hépatite C (VHC) en France ? Une réponse fiable à cette question n’est pas aisée. A fortiori, reconstituer la dynamique de cette contamination virale depuis le début de l’épidémie est encore plus difficile. Cette difficulté tient à l’imbrication de différents phénomènes souvent convergents, parfois concurrents, à la fois variables d’une région à l’autre et évolutifs dans le temps. Ces évolutions ont été influencées par le marché des drogues illicites mais aussi par les conséquences sanitaires, dont la plus dévastatrice a été l’irruption du VIH/sida au début des années 1980. On peut penser que l’épidémie de VIH/sida a pu entraîner des modifications des comportements des usagers de drogues avant même la mise en place des politiques publiques. Jusqu’au début des années 1990, la littérature sur l’épidémiologie de l’usage de drogues en France était très limitée. Du fait de l’illégalité des stupéfiants, les seules données quantitatives disponibles à partir desquelles il était possible d’établir des statistiques relatives à l’usage de drogues étaient celles issues du système judiciaire, qui ne reflétaient la réalité que de façon vague et biaisée. Or, la connaissance de l’effectif des usagers de drogues et de leurs caractéristiques est nécessaire pour émettre des recommandations susceptibles de faire baisser le nombre de nouvelles contaminations.
Malgré les difficultés signalées, on peut distinguer deux époques : la première de 1970 à 1995 et la seconde de 1995 à aujourd’hui. L’année 1995 semble s’imposer comme le tournant de l’épidémie d’hépatite C chez les usagers de drogues parce qu’elle correspond à la fois à la diffusion en France des traitements de substitution aux opiacés puis à celle des trithérapies anti-VIH qui ont transformé l’évolution du sida et de la co-infection VIH-VHC. De plus, depuis 1995 et contrastant avec la période antérieure, de nombreuses données épidémiologiques émanant pour la plupart de l’Observatoire français des drogues et toxicomanies (OFDT) et de l’Institut de veille sanitaire (InVS) sont désormais disponibles. Le but de cette revue bibliographique est d’essayer de présenter de façon la plus factuelle possible la dynamique du VHC chez les usagers de drogues ces quarante dernières années en France.
Position du problème
En termes d’usages de drogues, l’Observatoire européen des drogues et des toxicomanies (OEDT) distingue l’expérimentation, définie par une consommation de drogue au moins une fois dans la vie, de l’usage problématique défini comme étant « l’usage de drogue par voie intraveineuse ou un usage régulier d’opiacés, cocaïne ou amphétamines durant l’année passée pour le groupe d’âge des 15-64 ans » (OEDT, 2010)
1
.
En 2006, en France, le nombre d’usagers de drogues problématiques était estimé entre 210 000 et 250 000 dont la moitié était concernée par des traitements médicaux de substitution aux opiacés. Parmi les usagers problématiques, environ 145 000 auraient utilisé la voie veineuse comme mode d’administration au moins une fois dans la vie (Costes, 2009

).
Les circonstances précises de la contamination par le VHC d’un usager de drogues restent souvent inconnues en raison de la multiplicité des actes potentiellement à risque. L’intrication de facteurs de risque de contamination démographiques, virologiques, psychologiques et sociaux ne permet pas de déterminer la part attribuable à chacun d’entre eux. Néanmoins, un socle de connaissances a été établi à partir d’études épidémiologiques mesurant l’incidence, la prévalence et la force de l’infection dont les aspects spécifiques à la problématique du VHC chez les usagers de drogues méritent d’être soulignés.
Transmission du VHC chez les usagers de drogues
La transmission du VHC chez les usagers de drogues se traduit par la mise en évidence, chaque année, d’un certain nombre de nouveaux sujets déclarés positifs au VHC (taux d’incidence). Cette transmission est associée à la pratique de l’injection et au partage du matériel de préparation à l’injection principalement les premières années d’usage.
Modalités d’évaluation épidémiologique de la transmission
L’incidence (ou le taux d’incidence) est utilisée en épidémiologie pour décrire la dynamique d’une maladie dans une population. Il s’agit du nombre de nouveaux cas d’une pathologie observés pendant une période et pour une population déterminée. L’incidence est stable lors de phases d’endémie, en augmentation en cas d’épidémies voire de pandémies, ou en diminution lors de la résolution d’une épidémie. Au décours d’une épidémie, l’endémie résiduelle est souvent d’autant plus élevée que la morbidité d’une maladie est faible et vice versa. Les variations d’incidence dans une sous-population ne reflètent pas forcement les variations d’incidence dans la population générale si l’incidence de la sous-population elle-même est différente de celle de la population générale. La difficulté méthodologique spécifique de l’étude de l’hépatite C chez les usagers de drogues tient au fait que la sous-population des usagers de drogues a connu une évolution épidémique ces 40 dernières années.
L’incidence se distingue de la prévalence qui est une mesure d’état qui compte tous les cas à un moment donné et qui s’exprime généralement en pourcentage. Une variation de prévalence peut s’obtenir lorsque le taux de guérison et le taux de mortalité sont plus ou moins élevés que le taux d’incidence de la maladie. On peut penser que la diminution de la prévalence du VIH chez les usagers de drogues durant les années 1990 a été la conséquence d’une baisse d’incidence de la contamination et d’une hausse de la mortalité liée au sida. En matière d’usage de drogues, l’initiation de nouveaux sujets à l’injection ou un solde migratoire positif d’usagers de drogues peut se traduire par une augmentation de l’effectif. Une baisse de l’effectif peut résulter de l’arrêt des consommations ou l’abandon de l’injection ou encore de décès des usagers.
Dans une cohorte rétrospective de 23 000 personnes interpellées pour usage d’héroïne, de cocaïne ou de crack observée entre 1992 et 2001, le taux brut de mortalité s’établissait à 7,3 décès pour mille personnes-années (Lopez et coll., 2004

). Une cohorte prospective de sujets VHC positifs menée en Grande-Bretagne entre 1991 et 2005 a montré que 39 % des décès de sujets VHC positifs dont le mode de contamination était l’usage de drogues étaient directement ou indirectement liés à l’usage de drogues (Mohsen et coll., 2001

; Neal, 2007

). Les principales causes étaient les surdoses, les décès par sida, les suicides et autres morts violentes, et les infections hors sida. Inversement, en cas de maladie non létale, la prévalence est généralement stable pendant des décennies même si l’incidence est devenue faible voire nulle. En conséquence, les variations de prévalence ne seraient pas adaptées pour mesurer la dynamique du VHC chez les usagers de drogues.
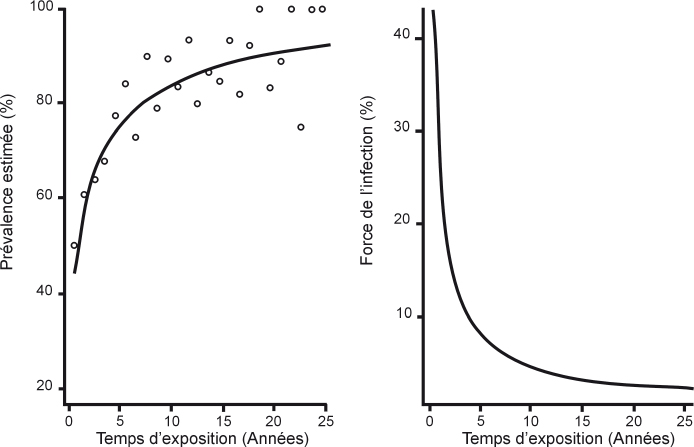
La force de l’infection est la vitesse avec laquelle des sujets susceptibles d’être infectés le deviennent (Mathei et coll., 2006

). La force de l’infection peut être estimée à partir des données de prévalence en fonction du temps d’exposition au risque. Concernant l’usage de drogues, le temps d’exposition est défini comme le temps entre la première injection et le moment de l’évaluation. La force de l’hépatite C chez les usagers de drogues par voie intraveineuse n’est pas linéaire dans le temps. Elle est très élevée les deux ou trois premières années de pratique d’injection et diminue très rapidement par la suite (figure 6.1

). Cette diminution s’explique peut-être en partie par des modifications des pratiques à risque mais surtout par un phénomène de saturation : plus la proportion de sujets contaminés augmente, plus celle des sujets susceptibles de le devenir diminue. Ainsi, le concept de force de l’infection est en contradiction avec l’idée selon laquelle la différence observée entre les évolutions des épidémies par le VHC et le VIH serait liée à la prévalence plus élevée du VHC chez les usagers de drogues. C’est le passage à l’injection qui est le paramètre clé de l’épidémie de VHC.
Modalités de transmission du VHC
La transmission du VHC est essentiellement parentérale et résulte de la mise en contact direct du sang d’un sujet indemne avec le sang d’un sujet infecté. La transmission entre partenaires sexuels est très faible et favorisée par une co-infection VIH. L’injection de drogues par voie intraveineuse est actuellement en France la principale source de contamination. Les aiguilles et les seringues ont le plus grand potentiel de contamination du VHC en raison de leur contact direct avec le sang pendant l’injection veineuse. Toutefois, l’ARN-VHC a également été retrouvé dans 25 % à 40 % des filtres, cuillères et eau de rinçage (Crofts et coll., 2000

). Une étude expérimentale a montré que le VHC maintenu hors de l’organisme humain en air ambiant conserverait son pouvoir infectant pendant au moins 16 heures (Kamili et coll., 2007

).
La seringue empruntée, le matériel de préparation partagé entre injecteurs sont des modes de contamination dominants chez les usagers de drogues par voie intraveineuse. À la différence du VIH, le partage du matériel de préparation à l’injection et en particulier du filtre en l’absence de partage de seringues est une source de contamination par le virus de l’hépatite C chez les usagers de drogues par voie intraveineuse (Hagan et coll., 2001

; Lucidarme et coll., 2004

; De P et coll., 2008

). En 1995, une étude multicentrique française avait montré une prévalence de 40 % après 3 années de pratiques d’injection en l’absence de partage de seringues suggérant le rôle du matériel de préparation comme facteur de risque (Chossegros, 2007

). En épidémiologie, la fraction attribuable permet de quantifier, dans un modèle de relation causale entre le facteur de risque et la maladie étudiée, la proportion des contaminations liées à ce facteur. Parmi l’ensemble des sujets ayant présenté une séroconversion, la fraction attribuable au partage du récipient et/ou du filtre était de 13 % (Hagan et coll., 2001

), mais celle-ci ne serait pas nécessairement constante dans le temps. La fraction attribuable au partage de seringues serait très élevée les cinq années suivant la première injection alors que les fractions attribuables aux partages de filtres et de seringues seraient similaires pour les contaminations survenues 25 années après le début des pratiques d’injection (Mathei et coll., 2006

). Ces dernières années, le sniff est considéré comme un facteur de risque non négligeable de contamination par le VHC en l’absence d’utilisation de la voie veineuse (Tortu et coll., 2004

; Martinez et Talal, 2008

). De même, le partage de pipes à crack semble un phénomène émergent de contamination par le VHC (Macias et coll., 2008

) ; cet aspect fait l’objet d’un chapitre spécifique sur les pratiques à risque chez les fumeurs de crack.
Environ 75 % des sujets infectés (en l’absence de traitement à la phase aiguë) restent porteurs chroniques du virus et sont donc susceptibles à leur tour de transmettre le virus (Micallef et coll., 2006

). De plus, la guérison spontanée ou sous traitement de l’hépatite C ne confère pas une immunité durable. Des réinfections par le VHC ont été rapportées chez des patients ayant reçu de nombreuses transfusions (Lai et coll., 1994

) et chez les usagers de drogues (Bowden et coll., 2005

; Micallef et coll., 2007

). Il semble cependant, même si ce point est controversé (Van de Laar et coll., 2009

), que les patients ayant déjà éliminé le VHC spontanément aient un risque plus faible de passage à la chronicité en cas de nouvelle contamination que ceux n’ayant jamais rencontré le VHC (Grebely et coll., 2006

; Osburn et coll., 2010

).
Difficultés méthodologiques spécifiques à la sous-population des usagers de drogues
La compréhension de l’épidémiologie de l’hépatite C chez les usagers de drogues soulève le triple problème des modalités d’estimation de l’incidence, de la mesure de l’impact des modifications de comportements sur le niveau de transmission du VHC et des modalités du diagnostic biologique de l’infection.
Estimation de l’incidence de l’infection par le VHC
L’estimation de l’incidence du VHC chez les usagers de drogues est complexe. L’incidence peut se mesurer directement de façon prospective dans le cadre d’un suivi longitudinal d’une cohorte d’usagers de drogues séronégatifs à l’inclusion. Ce type d’étude est difficile à conduire car le nombre de sujets perdus de vue à la fin de la période d’observation est généralement très important. De plus, différents biais avant tout de représentativité mais aussi de suivi et d’observation sont susceptibles de fausser les résultats. Le biais de représentativité est le plus difficile à éviter car les populations les plus à risque de contaminations virales sont aussi les plus difficiles à inclure dans les enquêtes épidémiologiques en raison d’une plus forte dépendance aux produits et de la fréquente marginalité sociale.
L’incidence peut également se mesurer indirectement et de façon rétrospective en divisant la prévalence par le nombre d’années écoulées entre la première prise de risque en l’occurrence la première injection intraveineuse et la date de première sérologie. Une telle mesure ne se conçoit que si le délai est suffisamment court pour correspondre à une incidence stable dans le temps. En règle générale, sont distingués dans la littérature la sous-population des usagers de moins de 25 ans et les injecteurs depuis moins de 2 ans. Ces derniers paramètres définissent la catégorie des « nouveaux injecteurs » qui permet d’évaluer le renouvellement de la population des usagers de drogues par voie intraveineuse.
Évaluation des modifications de comportements sur le niveau de transmission
La mesure épidémiologique de l’influence des pratiques à risque sur les contaminations virales est difficile pour plusieurs raisons. Les usagers de drogues ne forment pas une sous-population homogène car les modalités d’usage peuvent évoluer dans le temps. À titre d’exemple, dans une étude prospective de cohorte aux Pays-Bas entre 1985 à 1992 (Van Ameijden et coll., 1994

), après un suivi moyen de 5 ans, 30 % des non injecteurs étaient devenus injecteurs et 70 % des anciens injecteurs avaient repris leurs anciennes habitudes, illustrant ainsi les risques d’une simplification trop schématique des usages.
D’autre part, une injection de drogue susceptible de transmettre le VHC peut se pratiquer seul ou en groupe, avec l’aide d’un tiers ou non, avec une seringue neuve ou usagée appartenant au sujet lui-même ou à quelqu’un d’autre, avec mise en commun du matériel de préparation ou non, être précédée ou suivie d’autres injections à intervalles très rapprochés ou au contraire représenter une pratique très épisodique. Dans ce contexte complexe, la mesure du niveau de risque de transmission du VHC dans un échantillon d’usagers de drogues injecteurs repose généralement sur les proportions de partages de seringues ou de mise en commun du matériel de préparation au moment ou dans les semaines précédant l’observation dans le cadre le plus souvent d’enquêtes de prévalence. Or, les pratiques des premières années d’injection diffèrent des pratiques évaluées au moment de l’enquête (Vidal-Trecan et coll., 2002

). De plus, la comparaison des études entre elles sur ces critères est délicate. À titre d’exemple, dans l’enquête IREP (Institut de recherche en épidémiologie de la pharmacodépendance) de 1996 (Ingold, 1996

) et dans l’étude Coquelicot de 2004 (Jauffret-Roustide et coll., 2009

) le taux de partage de seringues était de 13 %. Toutefois, dans la première étude, l’évaluation concernait la dernière injection et dans la seconde l’ensemble des injections effectuées le mois précédant l’inclusion, impliquant malgré la similitude des pourcentages des niveaux de risque bien différents entre les deux études.
Diagnostic de l’hépatite C
Le diagnostic de contamination par le VHC repose sur la mise en évidence dans le sérum d’anticorps anti-VHC. Malgré cette apparente simplicité, sa réalisation dans le cadre d’études épidémiologiques auprès d’usagers de drogues est complexe pour au moins trois raisons.
La ponction veineuse est souvent difficile et refusée par les usagers ayant un état veineux altéré. Cette situation a pour conséquence de biaiser les études épidémiologiques en excluant du dépistage une fraction importante des sujets parmi les plus à risque. Des alternatives telles que le dépistage déclaratif (Six et coll., 1999

), le dépistage sur prélèvement salivaire (Bello et coll., 1998

; Lucidarme et coll., 2004

) ou capillaire (Jauffret-Roustide et coll., 2009

) ont été utilisées dans de nombreuses études pour contourner cette difficulté. Les avantages et limites de chaque technique de dosage sont connus et intégrés dans l’interprétation des données recueillies (Van Doornum et coll., 2001

; Lucidarme et coll., 2003

; Jauffret-Roustide et coll., 2009

; Tuaillon et coll., 2010

). Cependant, la multiplicité des techniques de dosage gène les comparaisons des prévalences du VHC entre les différentes études.
Le dépistage de l’infection par le VHC n’est possible que depuis 1990 avec la mise sur le marché des anticorps anti-VHC de première génération. Par conséquent, l’incidence du VHC antérieure à cette date ne peut être reconstruite que par des outils de modélisation mathématique basés sur les données épidémiologiques disponibles au moment de l’étude et sur les connaissances accumulées sur l’histoire naturelle de la maladie.
La re-contamination peut passer inaperçue si le diagnostic de guérison spontanée n’avait pas été posé au décours d’une première contamination (Amin et coll., 2007

).
Méthodologie de la présente analyse
L’intrication des interactions concernant deux sous-populations très évolutives à savoir les sujets VHC positifs et les usagers de drogues par voie intraveineuse suggère de privilégier comme source principale des données de l’analyse un référentiel plus stable à savoir la population générale. Deux études de prévalence de l’hépatite C en population générale menées en France par l’InVS en 1994 (Dubois et coll., 1997

) et 2004 (Meffre et coll., 2010

) ont constitué les pierres angulaires de l’analyse. En dépit du fait que les études en population générale peuvent sous-estimer les catégories de sujets statistiquement marginales, les constats de ces deux travaux permettent de proposer des hypothèses sur la dynamique de l’hépatite C chez les usagers de drogues en France. Cette approche a l’avantage de privilégier deux travaux de grande qualité méthodologique reposant sur de grands échantillons représentatifs.
Ensuite, les hypothèses construites à partir des études en population générale ont été confrontées aux résultats des études multicentriques de prévalence auprès de populations d’usagers de drogues (Six et coll., 1999

; Valenciano et coll., 2001

; Palle et Vaissade, 2007

; Jauffret-Roustide et coll., 2009

), d’incidence (Lucidarme et coll., 2004

) et aux travaux de modélisation (Downs et coll., 1997

; Deuffic et coll., 1999

; Lapidus et coll., 2006

; Mathei et coll., 2006

).
Enfin, les études monocentriques (Lucidarme et coll., 1994

; Bello et coll., 1998

; Vidal-Trecan et coll., 2002

; Di Nino et coll., 2009

) ont apporté un éclairage complémentaire à la compréhension de la dynamique de l’infection.
Dynamique de l’épidémie du VHC entre 1970 et 1995
Les épidémies d’hépatite C et de VIH chez les usagers de drogues injecteurs ont été les conséquences de l’explosion de la consommation d’héroïne qui a été pendant 25 ans le produit dominant en France. Cette consommation avait commencé en France au début des années 1970 et concernait environ 10 000 usagers (Chossegros, 2007

). Au cours de la seconde moitié des années 1970, elle s’est étendue aux milieux populaires de nombreuses grandes villes du sud de la France et d’Île-de-France puis la région lyonnaise avant de se généraliser à la fin des années 1980 et à l’ensemble du territoire en atteignant le Nord et l’Est de la France. L’héroïne est consommée selon de nombreuses voies d’administration. Elle peut être ingérée, prisée (voie nasale), injectée ou fumée. En France, la persistance du mode d’administration intraveineuse de 1970 à 1995 était en relation, comme presque partout en Europe et aux États-Unis, avec la disponibilité de la seule forme injectable de l’héroïne (Toufik, 1999

).
Évolution de l’épidémie du VHC
Les premières estimations de prévalence de l’usage problématique de drogues datent en France du milieu des années 1990. En 1993, on estimait à au moins 160 000 le nombre d’héroïnomanes sans que la proportion d’injecteurs ou d’anciens injecteurs ne soit précisée (Costes, 1995

). Dans l’étude menée en 1994 dans un échantillon d’assurés sociaux de quatre régions de France volontaires à un examen de santé, la prévalence du VHC était évaluée à 1,05 %. L’usage de drogues par voie intraveineuse était à l’origine de 29 % des contaminations par le VHC dans la tranche d’âge de 20 à 59 ans (Dubois et coll., 1997

). En extrapolant ces données à celles du recensement Insee de 1990 pour la même tranche d’âge et en considérant que le nombre de sujets de moins de 20 ans et de plus de 60 ans contaminés par le VHC par usage de drogues était marginal, 92 000±14 000 usagers de drogues étaient VHC positifs.
Dans les années 1980, aucune donnée concernant le VHC ou le VIH parmi les usagers de drogues n’a été recueillie. Une modélisation, selon la méthode du rétro-calcul, de l’épidémie du VHC de l’étude précédente (Dubois et coll., 1997

) avait suggéré une augmentation régulière de l’incidence entre 1970 et 1990 avec un chiffre d’environ 15 000 cas incidents de contaminations non-transfusionnelles pour l’année 1990 dont 70 % soit environ 10 000±1 000 cas étaient susceptibles d’être secondaires à un usage de drogues (Deuffic et coll., 1999

).
La fin des années 1980 et le début des années 1990 ont probablement coïncidé avec le pic d’incidence de l’hépatite C chez les usagers de drogues car la dynamique de l’usage de drogues à partir de cette époque a présenté un double phénomène de saturation à la fois géographique et démographique. En effet, l’extension de l’épidémie de VHC à tout le territoire a abouti après une longue phase d’expansion à une diminution de la force de l’infection en limitant les cas incidents d’infection par le VHC aux nouveaux injecteurs de chaque région. Le second phénomène de saturation est illustré par une étude menée en 1991 à Lille et qui a montré que l’incidence annuelle de la contamination par le VHC était de l’ordre de 50 % lors de la première année et qu’après trois années d’usage par voie intraveineuse d’héroïne 90 % des sujets étaient VHC positifs (Lucidarme et coll., 1994

). Dans cette étude, 57 % des usagers avaient débuté les injections depuis moins de 2 ans. La force de l’infection était par conséquent maximale la première année. À cette époque, l’initiation à l’usage intraveineux était synonyme de contamination par le VHC tant le risque apparaissait inéluctable. En 1992, l’incidence de l’expérimentation d’héroïne était estimée à 1 % d’une classe d’âge soit environ 8 000 cas par an (Baromètres santé 1992-1995-2000-2005, Inpes ; Baudier et coll., 1994

; Baudier et Arene, 1997

; Guilbert et coll., 2001

; Beck et coll., 2008

). En posant pour hypothèses que : de 65 à 95 % des expérimentateurs utilisaient tôt ou tard la voie intraveineuse ; de 80 à 90 % de ces derniers étaient contaminés dans les trois années suivant la première injection ; et que la consommation, à cette époque, d’autres drogues par voie injectée était marginale, on peut estimer que le nombre de nouveaux cas d’hépatite C entre 1992 et 1995 était compris entre 4 000 et 7 000 par an. Cette estimation, bien que plausible, n’est pas confirmée par d’autres sources.
Évolution de l’épidémie du VIH
L’estimation de la prévalence du VIH en France, quel que soit le mode de contamination, était de 100 000±30 000 à la fin des années 1990 (Desenclos et coll., 2005

). En 2008, avec 70 cas estimés, les personnes infectées par usage de drogue intraveineuse représentaient 1 % des nouvelles contaminations (Le Vu et coll., 2009

). La co-infection par le VHC serait le témoin d’une contamination secondaire à l’usage de drogues par voie intraveineuse parmi la population des sujets contaminés par le VIH dans la mesure où environ 71,6 % des cas de co-infection seraient liés à l’usage de drogues et 92,8 % (89,0-95,3 %) des usagers de drogues VIH positifs seraient également VHC positifs (Larsen et coll., 2005

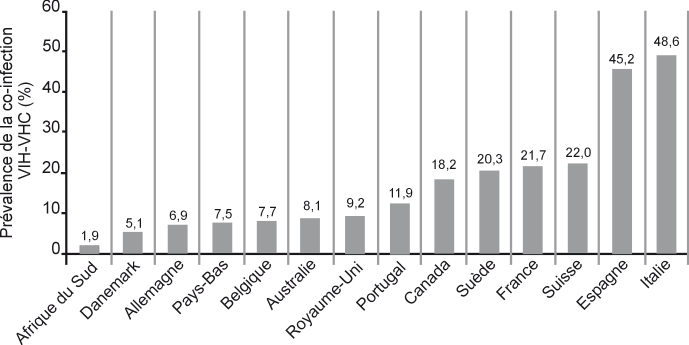
). Par conséquent, en France, la proportion de cas de co-infection parmi les sujets VIH positifs reflèterait dans une large mesure le poids épidémiologique de l’usage de drogues comme mode de transmission du VIH. En France, la proportion de sujets VIH positifs co-infectés par le VHC serait comprise entre 21,7 % (Amin et coll., 2004

) et 24,3 % (Larsen et coll., 2005

). Cette prévalence est avec celle de la Suisse l’une des plus élevées d’Europe, après celles de l’Italie et de l’Espagne (figure 6.2

).
L’épidémie de VIH a aussi fait l’objet de travaux de modélisation (Downs et coll., 1997

). Le système de surveillance de l’InVS indique que le pic de cas de sida déclarés chez les usagers de drogues en France a été atteint en 1993. Déterminée par la méthode de rétrocalcul fondée sur le fait selon lequel le nombre de nouveaux cas de sida est la résultante des nombres de sujets précédemment infectés par le VIH après une durée d’incubation donnée, l’incidence du VIH chez les usagers de drogues par voie intraveineuse aurait atteint un pic vers 1985, suivi d’une diminution rapide pour atteindre un taux de contamination annuelle très faible dès le début des années 1990 (Downs et coll., 1997

; figure 6.3

). Ainsi en 1997, les usagers de drogues VIH positifs de moins de 25 ans, donc vraisemblablement contaminés après 1990, ne représentaient que 2,5 % de l’ensemble des usagers de drogues VIH positifs, soit environ 700 sujets (Desenclos et coll., 2005

). Cette probable incidence très faible du VIH dès le début des années 1990 est corroborée par plusieurs études épidémiologiques menées dans le Nord et l’Est de la France (Lucidarme et coll., 1994

; Schmitt et coll., 1994

; Chossegros, 2007

) qui retrouvaient une prévalence faible du VIH de l’ordre de 1 % à 8 % parmi les usagers de drogues suivis en centre de soins car l’usage d’héroïne par voie intraveineuse ne s’est pas répandu dans le Nord et l’Est de la France avant la fin des années 1980. En France, l’épidémie de VIH chez les usagers de drogues a la double caractéristique d’avoir été à la fois importante ce dont témoigne la part élevée de l’usage de drogues par rapport à l’ensemble des contaminations (Amin et coll., 2004

) et limitée dans le temps ce dont témoigne un faible nombre de cas incidents dès le début des années 1990 (Lucidarme et coll., 1994

; Downs et coll., 1997

; Desenclos et coll., 2005

).
Analyse des différences évolutives des épidémies du VHC et du VIH
Selon ces deux études de modélisation (Downs et coll., 1997

; Deuffic et coll., 1999

), les courbes d’incidence du VHC et du VIH auraient été à peu près parallèles entre 1980 et 1985 avant de diverger ensuite. L’incidence du VHC aurait continué à croître jusque vers 1990 alors qu’une décroissance rapide de l’incidence du VIH se serait amorcée à cette époque. Trois facteurs pourraient expliquer la baisse de l’incidence du VIH :
• la « découverte » du VIH en 1983 et la mise à disposition à partir de 1985 de sérodiagnostics ;
• l’apparition des premiers cas de sida parmi les usagers de drogues ;
• la mise en vente libre des seringues en 1987.
Ces trois phénomènes ont été à l’origine des changements de pratique des usagers de drogues à cette époque. Jusqu’au début des années 1980, l’usage intraveineux avec partage de seringues était la règle. En 1988, 52 % des usagers injecteurs déclaraient ne jamais avoir partagé de seringues (Ingold et Ingold, 1989

).
Deux facteurs, l’un virologique, l’autre géographique, pourraient expliquer l’évolution divergente des courbes d’incidence entre 1985 et 1990 pour le VIH et le VHC. D’une part la transmission du VHC par les seringues usagées serait plus efficace que celle du VIH en raison d’une plus forte charge virale et d’une résistance supérieure dans le milieu extérieur. D’autre part, en 1985 l’expansion géographique du VHC n’était pas terminée dans la mesure où le Nord et l’Est de la France n’étaient encore que très peu touchés par l’épidémie. Bon nombre de cas incidents de VHC à la fin des années 1980 et au début des années 1990 auraient concerné ces deux régions.
Dynamique de l’épidémie du VHC entre 1995 et 2010
La prise de conscience des conséquences catastrophiques de l’épidémie de VIH, la prévalence très élevée du VHC mais aussi le nombre élevé de décès par overdose ont amené un nouveau dispositif financé par le ministère de la Santé, qui prévoyait entre autres la pérennisation de la mise en vente dans les pharmacies de kits avec seringues stériles (Stéribox
®), le développement des Programmes d’échange de seringues (PES), la création de « boutiques », structures d’accueil dites à bas seuil d’exigence, et enfin à partir de 1995 la montée en puissance des traitements de substitution aux opiacés dans le cadre d’une politique globale dite de « Réduction des risques ». En 2007, le nombre de personnes remboursées par l’Assurance maladie pour une délivrance de buprénorphine haut dosage (BHD) s’élevait à environ 96 000 et celui des patients remboursés pour une délivrance de méthadone s’élevait à environ 24 000 (Toufik et coll., 2010

).
De façon schématique, on est passé en quelques années d’un paysage dominé par un produit (l’héroïne), une modalité d’administration (la voie intraveineuse) et un lieu de consommation (la scène urbaine), à une situation plus complexe caractérisée par la forte diffusion de la cocaïne et de ses dérivés, les polyconsommations, le mésusage de la BHD, un changement des modes de consommation avec un moindre recours à la voie veineuse et l’émergence des espaces dits festifs comme lieu de consommation (OFDT, 2010a

et b

). Aussi, dans ce contexte de profonde mutation, malgré des données épidémiologiques plus abondantes, l’impact de la politique de réduction des risques sur la transmission du VHC est difficile à établir.
Estimation de l’incidence du VHC entre 1995 et 2004
Différentes études conduites en population générale et chez les usagers de drogues peuvent servir d’appui à une estimation de l’incidence entre 1995 et 2004.
Évolution du nombre d’usagers de drogues VHC positifs entre 1994 et 2004
En 2004, le nombre de personnes de 18 à 80 ans en France métropolitaine, séropositives pour les anti-VHC, ayant utilisé au moins une fois de la drogue par voie intraveineuse ou par voie nasale était estimé à environ 105 000 (40 000-154 000) dont environ 7 700±800 n’auraient utilisé que la voie nasale sans utilisation de la voie veineuse (Meffre et coll., 2007

).
D’autre part, l’enquête multicentrique Coquelicot menée en 2004 parmi des usagers ayant injecté ou sniffé au moins une fois dans leur vie a mesuré sur échantillons sanguins une prévalence de l’infection à VHC à 59,8 % alors que celle du VIH était de 10,8 %, soit 5,54 fois plus élevée (Jauffret-Roustide et coll., 2009

). En 2000, le nombre de sujets VIH positifs chez les usagers de drogues était évalué à 20 200 cas (14 300- 29 100) (Desenclos et coll., 2005

). En multipliant 20 200 par un facteur 5,54, on obtient une estimation de 112 000 usagers de drogues VHC positifs (79 000 à 160 000). Même si chaque source est susceptible d’être biaisée, on pourrait estimer le nombre d’usagers de drogues VHC positifs en 2004 entre 105 000 et 112 000.
La différence entre l’estimation du nombre d’usagers de drogues VHC positifs en 2004 (105 000-112 000) et en 1994 (92 000±14 000) correspond probablement à la somme des entrées par nouvelles contaminations et des sorties par décès. Pour évaluer le nombre de décès chez les usagers de drogues problématiques dont le nombre était estimé entre 142 000 et 176 000 en 1999 (OFDT, 1999

), l’extrapolation du taux de mortalité de 7,3 pour mille personnes-années (Lopez et coll., 2004

) à cette population aboutit à un nombre de décès annuels compris entre 1 000 et 1 300. Si l’on considère que la prévalence du VHC parmi les usagers problématiques de drogues était de 60 % (Jauffret-Roustide et coll., 2009

), entre 600 et 800 usagers de drogues VHC positifs seraient décédés chaque année entre 1994 et 2004, soit de 6 000 à 8 000 pour la décennie concernée. Par conséquent, le nombre de cas incidents d’hépatite C chez les usagers de drogues VHC positifs entre 1994 et 2004 serait compris entre 5 000 à 42 000 (si l’on tient compte des intervalles de confiance) soit une moyenne estimée de 500 à 4 200 nouveaux cas par an. Une moyenne de 500 à 4 200 nouveaux cas par an d’infection par le VHC chez les usagers de drogues entre 1994 et 2004 ne signifie pas que l’incidence aurait été stable entre 1994 et 2004. Depuis le début des années 1990, la tendance de l’incidence du VHC était à la baisse. Par conséquent, l’incidence annuelle du VHC en 1994 était probablement proche de 4 200 nouveaux cas par an alors qu’en 2004 celle-ci était plus proche de la borne inférieure que de la supérieure.
Incidence du VHC chez les usagers de drogues en 1999
Une étude longitudinale d’incidence de l’infection par le VHC dans la population des usagers de drogues entre 1999 et 2001 menée dans le Nord et l’Est de la France a mesuré cette incidence à 9 pour 100 personnes-années (Lucidarme et coll., 2004

) et à 11 pour 100 personnes-années parmi les injecteurs actifs c’est-à-dire ayant injecté au moins une fois dans les 6 mois précédant l’inclusion. Une extrapolation de ces résultats aux usagers de drogues injecteurs actifs présumés VHC négatifs estimait à cette époque qu’environ 3 500 (2 700 à 4 400) nouveaux cas de contamination parmi les usagers de drogues survenaient en France chaque année (Emmanuelli et coll., 2003

). Cette estimation ne reflèterait que l’année 1999 et non l’ensemble de la décennie dans la mesure où l’incidence n’était pas stable d’une année sur l’autre.
Cette extrapolation à la France entière du nombre de cas incidents obtenu dans le Nord et l’Est de la France pourrait constituer une légère surestimation dans la mesure où la force de l’infection dans le Nord et l’Est de la France aurait été plus élevée en raison d’une prévalence du VHC plus faible et d’une proportion supérieure à la moyenne nationale de nouveaux injecteurs. La décroissance de l’incidence du VHC pourrait aussi ne pas avoir été linéaire entre 1994 et 2004 mais avoir été plus marquée après l’année 2000, période à partir de laquelle la politique de réduction des risques a obtenu sa couverture maximale.
Évolution du nombre de cas incidents d’infection par le VHC entre 1999 et 2004
Concernant la période 1999-2004, les hypothèses d’une stabilité de l’incidence comprise entre 2 700 et 4 400 nouveaux cas par an et a fortiori d’une ascension de l’incidence semblent très improbables. En effet, dans l’enquête de prévalence du VHC en 2004 (Meffre et coll., 2007

), le nombre de sujets VHC positifs âgés de 18 à 29 ans était estimé à 7 977 (303-15 562). De même, dans l’enquête Coquelicot réalisée la même année (Jauffret-Roustide et coll., 2006a

et b

), la proportion de sujets nés après 1974 et donc âgés de 18 à 29 ans ne représentait que 10,4 % de l’ensemble de l’effectif des sujets VHC positifs, soit 11 648 (8 200-16 600) sujets, compte-tenu de l’estimation d’un effectif total de 112 000 (79 000 à 160 000) précédemment établie à partir de la même étude. La fourchette obtenue à partir de ces deux estimations (7 977-11 648) représenterait une estimation du nombre de sujets contaminés par le VHC entre 1999 et 2004, en posant pour hypothèse que le nombre de sujets nés avant 1975 contaminés entre 1999 et 2004 était marginal.
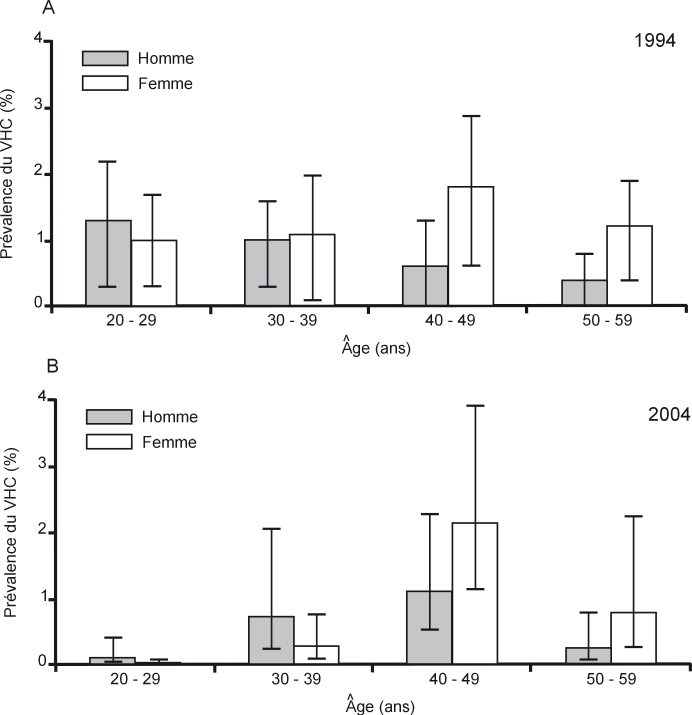
Cette fourchette doit toutefois être pondérée par un facteur de surestimation et un facteur de sous-estimation. Le facteur de surestimation est lié au fait qu’au moins un tiers voire davantage des sujets âgés de 18 à 29 ans, donc nés entre 1975 et 1986, auraient pu être contaminés avant 1999 et non entre 1999 et 2004 réduisant d’autant les valeurs hautes et basses de cette fourchette. Inversement, les études en population générale ont tendance à sous-estimer les populations statistiquement marginales. De même, les usagers de drogues les plus à risque de contaminations virales échappent aux enquêtes épidémiologiques et constituent les populations dites « cachées ». La neutralisation de ces deux facteurs est un postulat qui semble plausible voire même probable. Par conséquent, en considérant qu’entre 1999 et 2004, seraient survenues de 8 000 à près de 12 000 nouvelles contaminations par le VHC dont de 2 700 à 4 400 pour la seule année 1999, une estimation d’environ un millier (500-2 000) de contaminations secondaires à l’usage de drogues pour l’année 2004 pourrait raisonnablement être avancée. Ce déclin très significatif de l’incidence du VHC chez les usagers de drogues est illustré (figure 6.4

) par la baisse de la prévalence du VHC très nette dans les tranches d’âge de 20-29 ans entre 1994 et 2004 en population générale (Delarocque-Astagneau et coll., 2009

).
Évolution de l’incidence du VHC entre 2004 et 2010
Entre 2004 et 2010, aucune évaluation directe de l’incidence du VHC chez les usagers de drogues n’a été effectuée en France. Toutefois, plusieurs évaluations indirectes de l’incidence chez les nouveaux injecteurs obtenues à partir de données de prévalence parmi les usagers injecteurs de moins de 30 ans ou de 25 ans selon les études ont pu être réalisées. Plusieurs enquêtes menées parmi les usagers fréquentant les centres de soins, les cabinets de médecine générale (Palle et Vaissade, 2007

; Jauffret-Roustide et coll., 2009

; Di Nino et coll., 2009

) ou les structures de première ligne (Cadet-Taïrou et coll., 2010

) semblent indiquer une poursuite de la décroissance de l’incidence du VHC, même si l’interprétation de ces données doit rester prudente en raison de l’hétérogénéité géographique et méthodologique de ces différentes sources.
La prévalence du VHC parmi les sujets usagers de drogues de moins de 30 ans était de 44 % dans la première étude Coquelicot en 2002 (Jauffret-Roustide et coll., 2006a

et b

), de 29 % dans la seconde en 2004 (Jauffret-Roustide et coll., 2009

), et de seulement 7 % en 2007 dans le réseau des microstructures médicales en Alsace (Di Nino et coll., 2009

).
Le dispositif d’information Recap (Recueil commun sur les addictions et les prises en charges) de l’OFDT est un recueil annuel visant à l’exhaustivité d’informations concernant les usages et les prises en charge de chaque usager reçu dans un CSST/Csapa ou un CCAA (Centre de cure ambulatoire en alcoologie) ou une équipe de liaison hospitalière (Palle et Vaissade, 2007

). L’analyse de la base de données de l’année 2006 a permis de déterminer la proportion des sérologies positives, négatives et inconnues du VHC des patients suivis en CSST/Csapa selon le sexe et l’année de naissance donnant ainsi une représentation longitudinale à cette étude transversale (Cauchi-Duval, 2009

). Après un aspect en plateau concernant la génération née entre 1955 et 1965, la prévalence du VHC a amorcé une décroissance lente et régulière parmi les usagers nés entre 1965 et 1980 (figure 6.5

). Parmi les usagers les plus jeunes nés après 1980, la prévalence était inférieure à 5 % mais la proportion des sujets de cette tranche d’âge dépistés était plus basse. La force de cette étude est sa puissance statistique avec plus de 25 000 sujets inclus. Sa principale limite est le caractère déclaratif des résultats sérologiques. Les prévalences des sérologies déclarées positives pour le VHC chez les usagers de drogues injecteurs de moins de 25 ans dans les CSST avec hébergement en 1998 (Six et coll., 1999

) et dans les structures de première ligne en 2006 (Cadet-Taïrou et coll., 2010

) étaient de 40,8 % et de 12,2 % respectivement. Les données déclaratives des usagers (de moins de 25 ans ayant déjà utilisé l’injection dans leur vie) des structures de première ligne (Caarud) recueillies dans le cadre d’une enquête exhaustive menée sur la même semaine de l’année en 2006 et 2008 évoquent une décroissance de la prévalence du VHC qui serait passée de 22,5 % à 14,3 % (Cadet-Tairou et coll., 2010

).
Enfin, une surveillance de l’hépatite C par un réseau national de laboratoires publics et privés (Rena-VHC) et par les pôles de référence a montré que le nombre de nouveaux cas diagnostiqués dont le mode de contamination était l’usage de drogues par voie intraveineuse ou par voie nasale était passé de 710 à 330 cas par an entre 2001 et 2007 (Brouard et coll., 2009

). Même si le nombre de nouveaux cas diagnostiqués ne peut être assimilé au nombre de cas incidents dans la mesure où le diagnostic d’infection par le VHC est volontiers fait plusieurs années après la contamination, cette étude nationale conforte de façon indirecte la tendance générale.
Ainsi, l’incidence du VHC parmi les usagers de drogues aurait décliné ces vingt dernières années de façon très significative pour ne plus représenter aujourd’hui que de 10 à 15 % des estimations de 1990. De plus, à cette estimation s’ajoute un nombre difficile à préciser faute de données disponibles de sujets VHC positifs appartenant à des populations migrantes originaires pour bon nombre d’Europe de l’Est et du Caucase.
Ces données présentent beaucoup de similitudes avec celles mises en évidence dans une cohorte d’usagers de drogues à Amsterdam où l’incidence du VHC serait passée de 27,5 % à la fin des années 1980 à 2 % en 2005 (Van Den Berg et coll., 2007a

et b

). Aux Pays-Bas, une politique de réduction des risques avait été mise en place dès le début des années 1980.
Hypothèses sur la baisse de l’incidence du VHC entre 1995 et 2010
Plusieurs facteurs pourraient expliquer une baisse de l’incidence du VHC chez les usagers de drogues :
• une diffusion des politiques de réduction des risques ;
• un moindre recours à la voie veineuse ;
• une diminution de la force de l’infection ;
• une accessibilité accrue des usagers de drogues au traitement de l’hépatite C.
Moindre recours à la voie veineuse
Si la diminution des partages de seringues n’a pas suffi à infléchir le cours de l’épidémie c’est parce que le VHC, à la différence du VIH, se transmet aussi par le matériel de préparation à l’injection. Un changement des modes de consommation en faveur de la voie nasale avec un moindre recours à la voie veineuse parmi les nouveaux usagers aurait pu être un facteur déterminant. Dès 2003, le dispositif Trend était en mesure d’émettre l’hypothèse d’une diminution de la part des injecteurs parmi les usagers problématiques notamment d’héroïne (Bello et coll., 2010

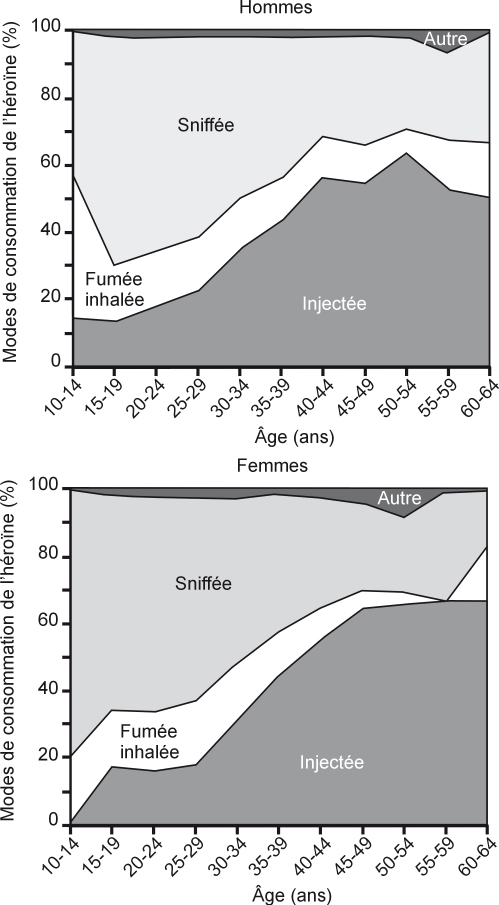
). Dans l’étude Recap, les consommateurs d’héroïne les plus âgés (après 40 ans) sont près de la moitié à utiliser l’injection comme mode d’administration, alors que les plus jeunes ont plus largement adopté le sniff (figure 6.6

). L’injection, qui est le deuxième mode d’administration le plus courant de la cocaïne après le sniff, présente comme pour l’héroïne un désintérêt de la part des générations les plus jeunes. De même, parmi les usagers des Caarud, la part des personnes qui n’ont jamais eu recours à l’injection tend à s’accroître (Cadet-Tairou et coll., 2010

). D’autre part, l’injection en milieu festif demeure un phénomène marginal.
Le moindre recours à la voie veineuse parmi les nouveaux usagers pourrait correspondre à une initiation plus tardive à la pratique d’injection dans le parcours des usagers de drogues. Cette hypothèse ne semble pas confirmée par la plupart des études épidémiologiques qui indiquent que l’âge médian à la première injection serait de 20 ans (Lucidarme et coll., 1994

; Jauffret-Roustide et coll., 2009

). Dans l’étude Recap, l’âge moyen de l’expérimentation de drogues illicites est stable dans le temps et la part de ceux qui injectent dès la première année de consommation reste élevée puisque plus de la moitié des injecteurs ont débuté l’injection avant leur premier anniversaire de consommation, 90 % après 5 ans de consommation (Cauchi-Duval, 2009

).
Le moindre recours à la voie veineuse a pour conséquence un renouvellement limité de la population des usagers de drogues suivis en centres de soins caractérisée par une baisse très nette de la proportion de nouveaux injecteurs. En 1993 et 1998, les proportions d’injecteurs de moins de 25 ans suivis en CSST/Csapa avec hébergement étaient respectivement de 24 et 16 % (Six et coll., 1999

). Dans l’étude Coquelicot de 2004, 8 % des sujets ayant injecté ou sniffé au moins une fois et seulement 3 % des injecteurs étaient âgés de moins de 25 ans (Jauffret-Roustide et coll., 2006a

et b

; Drees, 2007

). Ce phénomène n’est pas limité à l’hexagone. En Suisse, le taux d’usagers ayant débuté les injections depuis moins de deux ans est passé entre 1993 et 2006 de 18,7 % à 3,3 %. Le vieillissement de la population suivie, dont l’âge moyen est passé de 26 ans à 36 ans entre 1993 et 2006, est la conséquence de ce phénomène (Dubois-Arber et coll., 2008

). Ce renouvellement limité de la population des usagers de drogues suivis en centres de soins explique en grande partie une stabilité dans le temps de la prévalence du VHC dans la plupart des études transversales menées entre 1991 et 2004, de l’ordre de 50 à 80 % (Lucidarme et coll., 1994

; Schmitt et coll., 1994

; Bello et coll., 1998

; Valenciano et coll., 2001

; Jauffret-Roustide et coll., 2009

).
Même si le risque de contamination par voie nasale est plus faible que par voie veineuse, la proportion de nouveaux usagers de drogues contaminés par voie nasale semble augmenter et devenir perceptible (Aaron et coll., 2008

).
Diminution de la force de l’infection
Parmi les usagers injecteurs, le second facteur serait une diminution de la force de l’infection avec pour conséquence une contamination par le VHC moins précoce et moins massive qu’au début des années 1990, même si les premières années d’usage de drogues par voie intraveineuse représentent toujours la période où le risque de contracter le VHC est le plus élevé. Une fréquence moins importante des injections et un meilleur respect des règles d’asepsie seraient à l’origine de ce phénomène. En 2008, seuls 20 % des usagers des structures de première ligne (Caarud) qui ont consommé de l’héroïne au cours du mois précédent en prennent quotidiennement (Toufik et coll., 2010

). Ainsi, les pratiques d’injection pluri-quotidiennes couramment observées, avant la mise en place des traitements de substitution aux opiacés, sont moins fréquentes diminuant mécaniquement la fréquence de l’injection et donc les risques qui lui sont associés. Cependant, l’augmentation récente de la consommation de cocaïne qui engendre un nombre important d’injections (ou de sniff) pourrait venir compenser cette diminution des injections d’héroïne.
Dans une étude d’incidence du VHC dans le Nord et l’Est de la France en 1999, l’incidence du VHC parmi les usagers de drogues depuis moins de deux ans était de 17,5 % puis de 6 % au-delà (Lucidarme et coll., 2004

). Dans l’étude Coquelicot en 2004, la force de l’infection reste élevée. En effet, malgré le faible nombre de sujets concernés, la prévalence du VHC parmi les injecteurs de moins de 25 ans était de 32,1 % (Drees, 2007

). Ainsi, ces dernières années, l’incidence cumulée du VHC après 5 années de pratique d’injection serait de l’ordre de 40 % à 50 % alors qu’elle était de 90 % au début des années 1990 (Lucidarme et coll., 1994

). Pour les usagers ayant commencé l’héroïne après l’introduction des traitements de substitution aux opiacés, la période de dépendance après prise en charge thérapeutique est fortement raccourcie. Les personnes substituées opèrent une sortie de la dépendance à l’héroïne plus précoce que leurs pairs des générations précédentes qui connaissaient en moyenne une durée de dépendance d’une dizaine d’années (Toufik et coll., 2010

).
Accessibilité des usagers de drogues au traitement de l’hépatite C
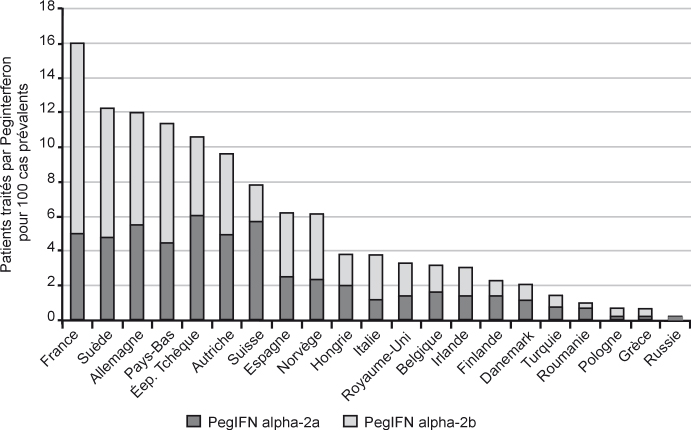
La France est le pays d’Europe qui a fait le plus d’efforts en matière de traitement de l’hépatite C (Lettmeier et coll., 2008

). À la fin de l’année 2005, 16 % des cas prévalents d’infection par le VHC avaient reçu un traitement anti-viral (figure 6.7

). Cette diffusion du traitement serait à l’origine d’une baisse sensible de la proportion de sujets séropositifs pour le VHC et virémiques passant de 81 % en 1994 (Dubois et coll., 1997

) à 65 % en 2004 (Meffre et coll., 2010

). Chez les usagers de drogues, le traitement n’est pas dissociable des efforts de prévention et de dépistage des nouvelles contaminations. Leur accessibilité au traitement a également fait l’objet d’efforts importants. En 2008, 70,5 % des usagers des Caarud, porteurs du VHC, ont consulté dans l’année pour cette pathologie et plus du quart (28 %) est sous traitement soit 5,5 points de plus qu’en 2006 (Bello et coll., 2010

). Le traitement des usagers de drogues est favorisé par la présence d’un génotype favorable dans environ un cas sur deux. Une étude réalisée par le Groupe français d’étude moléculaire des hépatites (Gemhep) (Martinot-Peignoux et coll., 1999

) avait montré que la répartition des génotypes dans la population toxicomane était la suivante : génotype 1a 26,0 %, génotype 1b 12,8 %, génotype 2a 3,3 %, génotype 3a 43,2 %, autres génotypes 16,7 %. Cette répartition des génotypes semble stable ces dernières années car plusieurs études récentes ont rapporté des pourcentages similaires (Bourlière et coll., 2002

; Payan et coll., 2005

; Di Nino et coll., 2009

). Les résultats obtenus en termes de réponse au traitement, d’effets indésirables et d’interruption prématurée de traitement sont globalement comparables à ceux observés chez les patients non usagers de drogues (Bruggmann et coll., 2008

; Chossegros et coll., 2008

). Dans ce contexte, une prise en charge multidisciplinaire des problèmes d’addiction, de l’hépatite C et des comorbidités psychiatriques fréquemment associées est nécessaire (Moussalli et coll., 2007

). La proportion de re-contaminations après traitement ayant permis la guérison ne dépasserait pas 10 % des cas (Backmund et coll., 2001

; Sylvestre, 2002

; Dalgard et coll., 2002

) et ne justifie pas de récuser le traitement du VHC chez les usagers de drogues.
En conclusion, savoir combien d’usagers de drogues sont contaminés chaque année par le virus de l’hépatite C en France est une question cruciale mais dont la réponse n’est pas simple. La période avant le début des années 1990 correspondrait à une montée en puissance du nombre de cas de contaminations parmi les usagers de drogues injecteurs ; puis la période après 1990 correspondrait à une décroissance progressive des contaminations. Jusqu’au début des années 1990, la contamination par le VHC des usagers de drogues injecteurs était quasi-inéluctable après quelques années de pratique de l’injection. Les modifications de comportement des usagers ainsi que le développement d’une politique de réduction des risques ont progressivement modifié cette situation même si les conséquences en termes de contamination virale C ont été longtemps incertaines. Le paradigme selon lequel cette politique serait de portée limitée sur le VHC mériterait, avec le recul dont nous disposons aujourd’hui, d’être révisé. Les principaux succès de cette politique seraient avant tout d’avoir contribué à diminuer le nombre de nouveaux injecteurs, ce dont témoignent les différentes enquêtes de l’OFDT, en favorisant les modalités alternatives que sont l’inhalation et la voie fumée mais aussi d’avoir amené les usagers à limiter les prises de risque lors des injections et à interrompre ce mode d’administration ou à en limiter la fréquence. L’accessibilité accrue aux traitements antiviraux des usagers de drogues aurait également contribué à ces résultats.
Malgré la diminution de l’incidence, la contamination par le VHC chez les usagers de drogues reste un problème incontournable de santé publique en France en 2010 et exige une poursuite des efforts en termes de politique de réduction des risques.
Bibliographie
[1] aaron s,
mcmahon jm,
milano d,
torres l,
clatts m, et coll. Intranasal transmission of hepatitis C virus: virological and clinical evidence.
Clin Infect Dis. 2008;
47:931
-934

[2] amin j,
kaye m,
skidmore s,
pillay d,
cooper da, et coll. HIV and hepatitis C coinfection within the CAESAR study.
HIVMedicine. 2004;
5:174
-179

[3] amin j,
law mg,
micallef j,
jauncey m,
van beek i, et coll. Potential biases in estimates of hepatitis C RNA clearance in newly acquired hepatitis C infection among a cohort of injecting drug users.
Epidemiol Infect. 2007;
135:144
-150

[4] backmund m,
meyer k,
von zielonka m,
eichenlaub d. Treatment of hepatitis C infection in drug users.
Hepatology. 2001;
34:188
-193

[5] baudier f,
arene j. Baromètre santé 95-96 adultes.
CFES;
Vanves:1997;

[6] baudier f,
dressen c,
alias f. Baromètre santé 1992.
CFES;
Vanves:1994;

[7] beck f,
guilbert p,
gautier a,
lamoureux p. Baromètre santé 2005 : attitudes et comportements de santé.
Inpes;
Saint Denis:2008;

[8] bello py,
pasquier c,
gourney p,
puel j,
izopet j. Assessment of a hepatitis C virus antibody assay in saliva for epidemiological studies.
Eur J Clin Microbiol Infect Dis. 1998;
17:570
-572

[9] bello py,
cadet-tairou a,
halfen s. L’état de santé des usagers problématiques. Les usages de drogues illicites en France depuis 1999 vus au travers du dispositif Trend.
OFDT;
2010;

[10] bourliere m,
barberin jm,
rotily m,
guagliardo v,
portal i, et coll. Epidemiological changes in hepatitis C virus genotypes in France: evidence in intravenous drug users.
J Viral Hepat. 2002;
9:62
-70

[11] bowden s,
mc
caw r,
white pa,
crofts n,
aitken ck. Detection of multiple hepatitis C virus genotypes in a cohort of injecting drug users.
J Viral Hepat. 2005;
12:322
-324

[12] brouard c,
delarocque-astagneau e,
meffre c,
pioche c,
silvain c, et coll. Evolution du dépistage de l’hépatite C en France à partir des systèmes de surveillance Rena-VHC et des pôles de référence, 2000-2007.
BEH. 2009;
20-21:7
-12

[13] bruggmann p,
falcato l,
dober s,
helbling b,
keiser o, et coll. Active intravenous drug use during chronic hepatitis C therapy does not reduce sustained virological response rates in adherent patients.
J Viral Hepat. 2008;
15:747
-752

[14] cadet-tairou a,
gandilhon m,
lahaie e,
chalumeau m,
coquelin a, et coll. Etat de santé des usagers. Drogues et usages de drogues en France. Etats des lieux et tendances récentes 2007-2009. Neuvième édition rapport national du dispositif Trend.
OFDT;
2010;

[15] cauchi-duval n. Parcours des usages de drogues en France : observation et analyse démographique. Thèse de doctorat soutenue à l’Université Montesquieu-Bordeaux IV.
Novembre 2009;

[16] chossegros p. Management of drug addiction in France (a short history).
Gastroenterol Clin Biol. 2007;
31:4S44
-50

[17] chossegros p,
melin p,
hezode c,
bourliere m,
pol s,
fhima aet coll. A French prospective observational study of the treatment of chronic hepatitis C in drug abusers.
Gastroentérol Clin Biol. 2008;
32:850
-857

[18] costes jm. Une estimation de prévalence.
Drogues et toxicomanies. CARPENTIER C, COSTES JM (eds). Indicateurs et tendances 1995;
4445

[19] costes jm. Prévalence de l’usage problématique de drogues en France : estimations 2006.
Tendances. 2009;
69:

[20] crofts n,
caruana s,
bowden s,
kerger m. Minimising harm from hepatitis C virus needs better strategies.
BMJ. 2000;
321:899

[21] dalgard o,
bjoro k,
hellum k,
myrvang b,
skaug k, et coll. Treatment of chronic hepatitis C in injecting drug users: 5 years’ follow-up.
Eur Addict Res. 2002;
8:45
-49

[22] de p,
roy e,
boivin jf,
cox j,
morissette c. Risk of hepatitis C virus transmission through drug preparation equipment: a systematic and methodological review.
J Viral Hepat. 2008;
15:279
-292

[23] delarocque-astagneau e,
meffre c,
dubois f,
pioche c,
le strat y, et coll. The hepatitis C surveillance system committee and the scientific committee for the national prevalence survey of hepatitis b and c markers. The impact of the prevention programme of hepatitis C over more than a decade: the French experience.
J Viral Hepat. 2009, epub;

[24] desenclos jc,
costagliola d,
commenges d,
lellouche j, les membres de l’action coordonnee 23 de l’agence nationale de recherche sur le sida. Dynamique de l’épidémie.
BEH. 2005;
11:41
-44

[25] deuffic s,
buffat l,
poynard t,
valleron aj. Modeling the hepatitis C virus epidemic in France.
Hepatology. 1999;
29:1596
-1601

[26] di nino f,
imbs jl,
melenotte gh,
le réseau rms,
doffoel m. Dépistage et traitement des hépatites C par le réseau des microstructures médicales chez les usagers de drogues en Alsace, France, 2006-2007.
BEH. 2009;
37:4
-8

[27] downs am,
heisterkamp sh,
brunet jb,
hamers ff. Reconstruction and prediction of the HIV/AIDS epidemic amoung adults in the European Union and in the low prevalence countries of central and eastern Europe.
AIDS. 1997;
11:649
-662

[29] dubois f,
desenclos jc,
mariotte n,
goudeau a, the collaborative study group. Hepatitis C in a French population-based survey, 1994: seroprevalence, frequency of viremia, genotype distribution, and risk factors.
Hepatology. 1997;
25:1490
-1496

[30] dubois-arber f,
balthasar h,
huissoud t,
zobel f,
arnaud s, et coll. Trends in drug consumption and risk of transmission of HIV and hepatitis C virus among injecting drug users in Switzerland, 1993-2006.
Euro Surveill. 2008;
13:18881

[31] emmanuelli j,
jauffret-roustide m,
barin f. Epidémiologie du VHC chez les usagers de drogues, France, 1993-2002.
BEH. 2003;
16-17:13
-15

[32] grebely j,
conway b,
raffa jd,
lai c,
krajden m, et coll. Hepatitis C virus reinfection in injection drug users.
Hepatology. 2006;
44:1139
-1145

[33] guilbert p,
baudier f,
gautier a. Baromètre santé 2000.
CFES;
Vanves:2001;

[34] hagan h,
thiede h,
weiss ns,
hopkins sg,
duchin j, et coll. Sharing of drug preparation equipment as a risk factor for hepatitis C.
Am J Public Health. 2001;
91:42
-46

[35] ingold r. Etude multicentrique sur les attitudes et les comportements des toxicomanes face au rique de contamination par le VIH et les virus de l’hépatite. Rapport de synthèse. Institut de Recherche en Epidémiologie de la Pharmacodépendance (IREP).
Octobre 1996;

[36] ingold r,
ingold s. The effects of the liberalization of syringe sales on the behaviour of intravenous drug users in France.
Bull Narc. 1989;
41:67
-81

[37] jauffret-roustide m,
couturier e,
le strat y,
barin f,
emmanuelli j, et coll. Estimation de la séroprévalence du VIH et du VHC et profils des usagers de drogues en France, étude InVS-ANRS Coquelicot, 2004.
BEH. 2006a;
244
-247

[38] jauffret-roustide m,
emmanuelli j,
quaglia m,
barin f,
arduin p, et coll. Impact of a harm-reduction policy on HIV and hepatitis C virus transmission among drug users: recent French data-the ANRS-Coquelicot Study.
Subst Use Misuse. 2006b;
41:1603
-1621

[39] jauffret-roustide m,
le strat y,
couturier e,
thierry d,
rondy m, et coll. A national cross-sectional study among drug-users in France: epidemiology of HCV and highlight on practical and statistical aspects of the design.
BMC Infectious Deseases. 2009;
9:113

[40] kamili s,
krawczynski k,
mccaustland k,
li x,
alter mj. Infectivity of hepatitis C virus in plasma after drying and storing at room temperature.
Infect Control Hosp Epidemiol. 2007;
28:519
-524

[41] lai me,
mazzoleni ap,
argiolu f,
de virgilis s,
balestrieri a, et coll. Hepatitis C virus in multiple episodes of acute hepatitis in polytransfused thalassaemic children.
Lancet. 1994;
343:388
-390

[42] lapidus n,
le strat y,
delarocque-astagneau e,
desenclos jc.Estimation de l’incidence des infections par le virus de l’hépatite C en France, à partir des enquêtes de séroprévalence réalisées en 1994 et 2004. Communication à l’AC23 ANRS;
novembre 2006;

[43] larsen c,
pialoux g,
salmon d,
antona d,
piroth l, et coll. Prévalence des co-infections par les virus des hépatites B et C dans la population VIH+, France, juin 2004.
BEH. 2005;
, 109
-112

[45] lettmeier b,
muhlberger n,
schwarzer r,
sroczynski g,
wright d, et coll. Market uptake of new antiviral drugs for the treatment of hepatitis C.
J Hepatol. 2008;
49:528
-536

[46] lopez d,
martineau h,
palle c. Mortalité des personnes interpellées pour usage d’héroïne de cocaïne ou de crack. OFDT.
Tendances. 2004;
36:

[47] lucidarme d,
foutrein p,
creusy c,
forzy g,
foutrein-comes mc, et coll. Prevalence of hepatitis C, B and D markers and histopathological aspects in a group of intravenous drug addicts.
Gastroenterol Clin Biol. 1994;
18:964
-968

[48] lucidarme d,
decoster a,
delamare c,
schmitt c,
kozlowski d, et coll. Etude inter laboratoires de la détection des anticorps anti-VHC sur prélèvements salivaires.
Gastroenterol Clin Biol. 2003;
27:159
-162

[49] lucidarme d,
bruandet a,
ilef d,
harbonnier j,
jacob c, et coll. Incidence and risk factors of HCV and HIV infections in a cohort of intravenous drug users in the North and East of France.
Epidemiol Infect. 2004;
132:699
-708

[50] macias j,
palacios rb,
claro e,
vargas j,
vergara s, et coll. High prevalence of hepatitis C virus infection among noninjecting drug users: association with sharing the inhalation implements of crack.
Liver Int. 2008;
28:781
-786

[51] martinez a,
talal ah. Noninjection drug use: an under-appreciated risk factor for hepatitis C virus transmission.
Liver Int. 2008;
28:757
-760

[52] martinot-peignoux m,
roudot-thoraval f,
mendel i,
coste j,
izopet j, et coll. Hepatitis C virus genotypes in France : relationship with epidemiology, pathogenicity and response to interferon therapy.
J Viral Hepatitis. 1999;
6:435
-443

[53] mathei c,
shkedy z,
denis b,
kabali c,
aerts m, et coll. Evidence for a substantial role of sharing of injecting paraphernalia other than syringes/needles to the spread of hepatitis C among injecting drug users.
J Viral Hepat. 2006;
13:560
-570

[54] meffre c,
le strat y,
delarocque-astagneau e,
antona d,
desenclos jc. Prévalence des hépatites B et C en France en 2004.
Institut de veille sanitaire;
Saint-Maurice:mars 2007;
114 pp.

[55] meffre c,
le strat y,
delarocque-astagneau e,
dubois f,
antona d, et coll. Prevalence of hepatitis B and hepatitis C virus infections in France in 2004: social factors are important predictors after adjusting for known risk factor.
J Med Virol. 2010;
82:546
-555

[56] micallef jm,
kaldor jm,
dore gj. Spontaneous viral clearance following acute hepatitis C infection: a systematic review of longitudinal studies.
J Viral Hepat. 2006;
13:34
-41

[57] micallef jm,
macdonald v,
jauncey m,
amin j,
rawlinson w, et coll. High incidence of hepatitis C virus reinfection within a cohort of injecting drug users.
J Viral Hepat. 2007;
14:413
-418

[58] mohsen ah. Trent HCV Study Group. The epidemiology of hepatitis C in a UK health regional population of 5.12 million.
Gut. 2001;
48:707
-713

[59] moussalli j,
melin p,
wartelle-bladou c,
lang jp. Management of hepatitis C among drug user patients.
Gastroenterol Clin Biol. 2007;
31:4S51
-4S55

[60] neal kt. On behalf of the Trent Hepatitis C Study Group. Excess mortality rates in a cohort of patients infected with the hepatitis C virus: a prospective study.
Gut. 2007;
56:1098
-1104

[61]ofdt. Drogues et toxicomanies : Indicateurs et tendances de l’Observatoire Français des Drogues et des Toxicomanies.
1999;

[63]ofdt. Les usages de drogues illicites en France depuis 1999, vu au travers du dispositif TREND.
COSTES JM (Dir.) OFDT;
2010b;
191pp.

[64] osburn wo,
fisher be,
dowd ka,
urban g,
liu l, et coll. Spontaneous control of primary hepatitis C virus infection and immunity against persistent reinfection.
Gastroenterology. 2010;
138:315
-324

[65] palle c,
vaissade l. Premiers résultats nationaux de l’enquête RECAP.
Tendances. 2007;
54:

[66] payan c,
roudot thoraval f,
marcellin p,
bled n,
duverlie g, et coll. Changing of hepatitis C virus genotype patterns in France at the beginning of the third millenium: The GEMHEP GenoCII Study.
J Viral Hepat. 2005;
12:405
-413

[67] schmitt c,
bertel j,
jacob c. Fréquence des marqueurs sérologiques des hépatites B et C et du VIH dans une population de toxicomanes hospitalisés de 1990 à 1992.
Ann Med Int. 1994;
145:7
-12

[68] six c,
hamers f,
brunet jb. Infections à VIH, VHC et VHB chez les résidents des centres de soins spécialisés pour toxicomanes avec hébergement 1993-1998.
BEH. 1999;
32:1
-4

[69] sylvestre dl. Treating hepatitis C in methadone maintenance patients: an interim analysis.
Drug Alcohol Depend. 2002;
67:117
-123

[70] tortu s,
macmahon jm,
pouget er,
hamid r. Sharing of noninjection drug-use implements as a risk factor for hepatitis C.
Subst Use Misuse. 2004;
39:211
-224

[71] toufik a. La diffusion de l’injection intraveineuse de l’héroïne en France.
Tendances. 1999;
5:

[72] toufik a,
escots s,
cadet-tairou a. La transformation des usages de drogues liée à la diffusion des traitements de substitution opiacés. Les usages de drogues illicites en France depuis 1999 vus au travers du dispositif Trend.
OFDT;
2010;

[73] tuaillon e,
mondain am,
meroueh f,
ottomani l,
picot mc, et coll. Dried blood spot for hepatitis C virus serology and molecular testing.
Hepatology. 2010;
51:752
-758

[74] valenciano m,
emmanuelli j,
lert f. Unsafe injecting practices among attendees of syringe exchange programmes in France.
Addiction. 2001;
96:597
-606

[75] van ameijden ej,
vanden hoek ja,
hartgers c,
coutinho ra. Risk factors for the transition from noninjection to injection drug use and accompanying AIDS risk behavior in a cohort of drug users.
Am J Epidemiol. 1994;
139:1153
-1163

[76] van de laar tj,
molenkamp r,
van den berg c,
schinkel j,
beld mg, et coll. Frequent HCV reinfection and superinjection in a cohort of injecting drug users in Amsterdam.
J Hepatol. 2009;
51:667
-674

[77] van den berg c,
smit c,
van brussel g,
coutinho r,
prins m. Full participation in harm reduction programmes is associated with decreased risk for human immunodeficiency virus and hepatitis C virus: evidence from the Amsterdam Cohort Studies among drug users.
Addiction. 2007a;
102:1454
-1462

[78] van den berg ch,
smit c,
bakker m,
geskus rb,
berkhout b, et coll. Major decline of hepatitis C virus incidence rate over two decades in a cohort of drug users.
Eur J Epidemiol. 2007b;
22:183
-193

[79] van doornum gj,
lodder a,
buimer m,
van ameijden ej,
bruisten s. Evaluation of hepatitis C antibody testing in saliva specimens collected by two different systems in comparison with HCV antibody and HCV RNA in serum.
J Med Virol. 2001;
64:13
-20

[80] vidal-trecan gm,
varescon-pousson i,
boissonnas a. Injection risk behaviors at the first and at the most recent injections among drug users.
Drug Alcohol Depend. 2002;
66:107
-109

→ Aller vers SYNTHESE
 ).
). ). Une cohorte prospective de sujets VHC positifs menée en Grande-Bretagne entre 1991 et 2005 a montré que 39 % des décès de sujets VHC positifs dont le mode de contamination était l’usage de drogues étaient directement ou indirectement liés à l’usage de drogues (Mohsen et coll., 2001
). Une cohorte prospective de sujets VHC positifs menée en Grande-Bretagne entre 1991 et 2005 a montré que 39 % des décès de sujets VHC positifs dont le mode de contamination était l’usage de drogues étaient directement ou indirectement liés à l’usage de drogues (Mohsen et coll., 2001 ; Neal, 2007
; Neal, 2007 ). Les principales causes étaient les surdoses, les décès par sida, les suicides et autres morts violentes, et les infections hors sida. Inversement, en cas de maladie non létale, la prévalence est généralement stable pendant des décennies même si l’incidence est devenue faible voire nulle. En conséquence, les variations de prévalence ne seraient pas adaptées pour mesurer la dynamique du VHC chez les usagers de drogues.
). Les principales causes étaient les surdoses, les décès par sida, les suicides et autres morts violentes, et les infections hors sida. Inversement, en cas de maladie non létale, la prévalence est généralement stable pendant des décennies même si l’incidence est devenue faible voire nulle. En conséquence, les variations de prévalence ne seraient pas adaptées pour mesurer la dynamique du VHC chez les usagers de drogues. ). La force de l’infection peut être estimée à partir des données de prévalence en fonction du temps d’exposition au risque. Concernant l’usage de drogues, le temps d’exposition est défini comme le temps entre la première injection et le moment de l’évaluation. La force de l’hépatite C chez les usagers de drogues par voie intraveineuse n’est pas linéaire dans le temps. Elle est très élevée les deux ou trois premières années de pratique d’injection et diminue très rapidement par la suite (figure 6.1
). La force de l’infection peut être estimée à partir des données de prévalence en fonction du temps d’exposition au risque. Concernant l’usage de drogues, le temps d’exposition est défini comme le temps entre la première injection et le moment de l’évaluation. La force de l’hépatite C chez les usagers de drogues par voie intraveineuse n’est pas linéaire dans le temps. Elle est très élevée les deux ou trois premières années de pratique d’injection et diminue très rapidement par la suite (figure 6.1 ). Cette diminution s’explique peut-être en partie par des modifications des pratiques à risque mais surtout par un phénomène de saturation : plus la proportion de sujets contaminés augmente, plus celle des sujets susceptibles de le devenir diminue. Ainsi, le concept de force de l’infection est en contradiction avec l’idée selon laquelle la différence observée entre les évolutions des épidémies par le VHC et le VIH serait liée à la prévalence plus élevée du VHC chez les usagers de drogues. C’est le passage à l’injection qui est le paramètre clé de l’épidémie de VHC.
). Cette diminution s’explique peut-être en partie par des modifications des pratiques à risque mais surtout par un phénomène de saturation : plus la proportion de sujets contaminés augmente, plus celle des sujets susceptibles de le devenir diminue. Ainsi, le concept de force de l’infection est en contradiction avec l’idée selon laquelle la différence observée entre les évolutions des épidémies par le VHC et le VIH serait liée à la prévalence plus élevée du VHC chez les usagers de drogues. C’est le passage à l’injection qui est le paramètre clé de l’épidémie de VHC.
 )
) ). Une étude expérimentale a montré que le VHC maintenu hors de l’organisme humain en air ambiant conserverait son pouvoir infectant pendant au moins 16 heures (Kamili et coll., 2007
). Une étude expérimentale a montré que le VHC maintenu hors de l’organisme humain en air ambiant conserverait son pouvoir infectant pendant au moins 16 heures (Kamili et coll., 2007 ).
). ; Lucidarme et coll., 2004
; Lucidarme et coll., 2004 ; De P et coll., 2008
; De P et coll., 2008 ). En 1995, une étude multicentrique française avait montré une prévalence de 40 % après 3 années de pratiques d’injection en l’absence de partage de seringues suggérant le rôle du matériel de préparation comme facteur de risque (Chossegros, 2007
). En 1995, une étude multicentrique française avait montré une prévalence de 40 % après 3 années de pratiques d’injection en l’absence de partage de seringues suggérant le rôle du matériel de préparation comme facteur de risque (Chossegros, 2007 ). En épidémiologie, la fraction attribuable permet de quantifier, dans un modèle de relation causale entre le facteur de risque et la maladie étudiée, la proportion des contaminations liées à ce facteur. Parmi l’ensemble des sujets ayant présenté une séroconversion, la fraction attribuable au partage du récipient et/ou du filtre était de 13 % (Hagan et coll., 2001
). En épidémiologie, la fraction attribuable permet de quantifier, dans un modèle de relation causale entre le facteur de risque et la maladie étudiée, la proportion des contaminations liées à ce facteur. Parmi l’ensemble des sujets ayant présenté une séroconversion, la fraction attribuable au partage du récipient et/ou du filtre était de 13 % (Hagan et coll., 2001 ), mais celle-ci ne serait pas nécessairement constante dans le temps. La fraction attribuable au partage de seringues serait très élevée les cinq années suivant la première injection alors que les fractions attribuables aux partages de filtres et de seringues seraient similaires pour les contaminations survenues 25 années après le début des pratiques d’injection (Mathei et coll., 2006
), mais celle-ci ne serait pas nécessairement constante dans le temps. La fraction attribuable au partage de seringues serait très élevée les cinq années suivant la première injection alors que les fractions attribuables aux partages de filtres et de seringues seraient similaires pour les contaminations survenues 25 années après le début des pratiques d’injection (Mathei et coll., 2006 ). Ces dernières années, le sniff est considéré comme un facteur de risque non négligeable de contamination par le VHC en l’absence d’utilisation de la voie veineuse (Tortu et coll., 2004
). Ces dernières années, le sniff est considéré comme un facteur de risque non négligeable de contamination par le VHC en l’absence d’utilisation de la voie veineuse (Tortu et coll., 2004 ; Martinez et Talal, 2008
; Martinez et Talal, 2008 ). De même, le partage de pipes à crack semble un phénomène émergent de contamination par le VHC (Macias et coll., 2008
). De même, le partage de pipes à crack semble un phénomène émergent de contamination par le VHC (Macias et coll., 2008 ) ; cet aspect fait l’objet d’un chapitre spécifique sur les pratiques à risque chez les fumeurs de crack.
) ; cet aspect fait l’objet d’un chapitre spécifique sur les pratiques à risque chez les fumeurs de crack. ). De plus, la guérison spontanée ou sous traitement de l’hépatite C ne confère pas une immunité durable. Des réinfections par le VHC ont été rapportées chez des patients ayant reçu de nombreuses transfusions (Lai et coll., 1994
). De plus, la guérison spontanée ou sous traitement de l’hépatite C ne confère pas une immunité durable. Des réinfections par le VHC ont été rapportées chez des patients ayant reçu de nombreuses transfusions (Lai et coll., 1994 ) et chez les usagers de drogues (Bowden et coll., 2005
) et chez les usagers de drogues (Bowden et coll., 2005 ; Micallef et coll., 2007
; Micallef et coll., 2007 ). Il semble cependant, même si ce point est controversé (Van de Laar et coll., 2009
). Il semble cependant, même si ce point est controversé (Van de Laar et coll., 2009 ), que les patients ayant déjà éliminé le VHC spontanément aient un risque plus faible de passage à la chronicité en cas de nouvelle contamination que ceux n’ayant jamais rencontré le VHC (Grebely et coll., 2006
), que les patients ayant déjà éliminé le VHC spontanément aient un risque plus faible de passage à la chronicité en cas de nouvelle contamination que ceux n’ayant jamais rencontré le VHC (Grebely et coll., 2006 ; Osburn et coll., 2010
; Osburn et coll., 2010 ).
). ), après un suivi moyen de 5 ans, 30 % des non injecteurs étaient devenus injecteurs et 70 % des anciens injecteurs avaient repris leurs anciennes habitudes, illustrant ainsi les risques d’une simplification trop schématique des usages.
), après un suivi moyen de 5 ans, 30 % des non injecteurs étaient devenus injecteurs et 70 % des anciens injecteurs avaient repris leurs anciennes habitudes, illustrant ainsi les risques d’une simplification trop schématique des usages. ). De plus, la comparaison des études entre elles sur ces critères est délicate. À titre d’exemple, dans l’enquête IREP (Institut de recherche en épidémiologie de la pharmacodépendance) de 1996 (Ingold, 1996
). De plus, la comparaison des études entre elles sur ces critères est délicate. À titre d’exemple, dans l’enquête IREP (Institut de recherche en épidémiologie de la pharmacodépendance) de 1996 (Ingold, 1996 ) et dans l’étude Coquelicot de 2004 (Jauffret-Roustide et coll., 2009
) et dans l’étude Coquelicot de 2004 (Jauffret-Roustide et coll., 2009 ) le taux de partage de seringues était de 13 %. Toutefois, dans la première étude, l’évaluation concernait la dernière injection et dans la seconde l’ensemble des injections effectuées le mois précédant l’inclusion, impliquant malgré la similitude des pourcentages des niveaux de risque bien différents entre les deux études.
) le taux de partage de seringues était de 13 %. Toutefois, dans la première étude, l’évaluation concernait la dernière injection et dans la seconde l’ensemble des injections effectuées le mois précédant l’inclusion, impliquant malgré la similitude des pourcentages des niveaux de risque bien différents entre les deux études. ), le dépistage sur prélèvement salivaire (Bello et coll., 1998
), le dépistage sur prélèvement salivaire (Bello et coll., 1998 ; Lucidarme et coll., 2004
; Lucidarme et coll., 2004 ) ou capillaire (Jauffret-Roustide et coll., 2009
) ou capillaire (Jauffret-Roustide et coll., 2009 ) ont été utilisées dans de nombreuses études pour contourner cette difficulté. Les avantages et limites de chaque technique de dosage sont connus et intégrés dans l’interprétation des données recueillies (Van Doornum et coll., 2001
) ont été utilisées dans de nombreuses études pour contourner cette difficulté. Les avantages et limites de chaque technique de dosage sont connus et intégrés dans l’interprétation des données recueillies (Van Doornum et coll., 2001 ; Lucidarme et coll., 2003
; Lucidarme et coll., 2003 ; Jauffret-Roustide et coll., 2009
; Jauffret-Roustide et coll., 2009 ; Tuaillon et coll., 2010
; Tuaillon et coll., 2010 ). Cependant, la multiplicité des techniques de dosage gène les comparaisons des prévalences du VHC entre les différentes études.
). Cependant, la multiplicité des techniques de dosage gène les comparaisons des prévalences du VHC entre les différentes études. ).
). ) et 2004 (Meffre et coll., 2010
) et 2004 (Meffre et coll., 2010 ) ont constitué les pierres angulaires de l’analyse. En dépit du fait que les études en population générale peuvent sous-estimer les catégories de sujets statistiquement marginales, les constats de ces deux travaux permettent de proposer des hypothèses sur la dynamique de l’hépatite C chez les usagers de drogues en France. Cette approche a l’avantage de privilégier deux travaux de grande qualité méthodologique reposant sur de grands échantillons représentatifs.
) ont constitué les pierres angulaires de l’analyse. En dépit du fait que les études en population générale peuvent sous-estimer les catégories de sujets statistiquement marginales, les constats de ces deux travaux permettent de proposer des hypothèses sur la dynamique de l’hépatite C chez les usagers de drogues en France. Cette approche a l’avantage de privilégier deux travaux de grande qualité méthodologique reposant sur de grands échantillons représentatifs. ; Valenciano et coll., 2001
; Valenciano et coll., 2001 ; Palle et Vaissade, 2007
; Palle et Vaissade, 2007 ; Jauffret-Roustide et coll., 2009
; Jauffret-Roustide et coll., 2009 ), d’incidence (Lucidarme et coll., 2004
), d’incidence (Lucidarme et coll., 2004 ) et aux travaux de modélisation (Downs et coll., 1997
) et aux travaux de modélisation (Downs et coll., 1997 ; Deuffic et coll., 1999
; Deuffic et coll., 1999 ; Lapidus et coll., 2006
; Lapidus et coll., 2006 ; Mathei et coll., 2006
; Mathei et coll., 2006 ).
). ; Bello et coll., 1998
; Bello et coll., 1998 ; Vidal-Trecan et coll., 2002
; Vidal-Trecan et coll., 2002 ; Di Nino et coll., 2009
; Di Nino et coll., 2009 ) ont apporté un éclairage complémentaire à la compréhension de la dynamique de l’infection.
) ont apporté un éclairage complémentaire à la compréhension de la dynamique de l’infection. ). Au cours de la seconde moitié des années 1970, elle s’est étendue aux milieux populaires de nombreuses grandes villes du sud de la France et d’Île-de-France puis la région lyonnaise avant de se généraliser à la fin des années 1980 et à l’ensemble du territoire en atteignant le Nord et l’Est de la France. L’héroïne est consommée selon de nombreuses voies d’administration. Elle peut être ingérée, prisée (voie nasale), injectée ou fumée. En France, la persistance du mode d’administration intraveineuse de 1970 à 1995 était en relation, comme presque partout en Europe et aux États-Unis, avec la disponibilité de la seule forme injectable de l’héroïne (Toufik, 1999
). Au cours de la seconde moitié des années 1970, elle s’est étendue aux milieux populaires de nombreuses grandes villes du sud de la France et d’Île-de-France puis la région lyonnaise avant de se généraliser à la fin des années 1980 et à l’ensemble du territoire en atteignant le Nord et l’Est de la France. L’héroïne est consommée selon de nombreuses voies d’administration. Elle peut être ingérée, prisée (voie nasale), injectée ou fumée. En France, la persistance du mode d’administration intraveineuse de 1970 à 1995 était en relation, comme presque partout en Europe et aux États-Unis, avec la disponibilité de la seule forme injectable de l’héroïne (Toufik, 1999 ).
). ). Dans l’étude menée en 1994 dans un échantillon d’assurés sociaux de quatre régions de France volontaires à un examen de santé, la prévalence du VHC était évaluée à 1,05 %. L’usage de drogues par voie intraveineuse était à l’origine de 29 % des contaminations par le VHC dans la tranche d’âge de 20 à 59 ans (Dubois et coll., 1997
). Dans l’étude menée en 1994 dans un échantillon d’assurés sociaux de quatre régions de France volontaires à un examen de santé, la prévalence du VHC était évaluée à 1,05 %. L’usage de drogues par voie intraveineuse était à l’origine de 29 % des contaminations par le VHC dans la tranche d’âge de 20 à 59 ans (Dubois et coll., 1997 ). En extrapolant ces données à celles du recensement Insee de 1990 pour la même tranche d’âge et en considérant que le nombre de sujets de moins de 20 ans et de plus de 60 ans contaminés par le VHC par usage de drogues était marginal, 92 000±14 000 usagers de drogues étaient VHC positifs.
). En extrapolant ces données à celles du recensement Insee de 1990 pour la même tranche d’âge et en considérant que le nombre de sujets de moins de 20 ans et de plus de 60 ans contaminés par le VHC par usage de drogues était marginal, 92 000±14 000 usagers de drogues étaient VHC positifs. ) avait suggéré une augmentation régulière de l’incidence entre 1970 et 1990 avec un chiffre d’environ 15 000 cas incidents de contaminations non-transfusionnelles pour l’année 1990 dont 70 % soit environ 10 000±1 000 cas étaient susceptibles d’être secondaires à un usage de drogues (Deuffic et coll., 1999
) avait suggéré une augmentation régulière de l’incidence entre 1970 et 1990 avec un chiffre d’environ 15 000 cas incidents de contaminations non-transfusionnelles pour l’année 1990 dont 70 % soit environ 10 000±1 000 cas étaient susceptibles d’être secondaires à un usage de drogues (Deuffic et coll., 1999 ).
). ). Dans cette étude, 57 % des usagers avaient débuté les injections depuis moins de 2 ans. La force de l’infection était par conséquent maximale la première année. À cette époque, l’initiation à l’usage intraveineux était synonyme de contamination par le VHC tant le risque apparaissait inéluctable. En 1992, l’incidence de l’expérimentation d’héroïne était estimée à 1 % d’une classe d’âge soit environ 8 000 cas par an (Baromètres santé 1992-1995-2000-2005, Inpes ; Baudier et coll., 1994
). Dans cette étude, 57 % des usagers avaient débuté les injections depuis moins de 2 ans. La force de l’infection était par conséquent maximale la première année. À cette époque, l’initiation à l’usage intraveineux était synonyme de contamination par le VHC tant le risque apparaissait inéluctable. En 1992, l’incidence de l’expérimentation d’héroïne était estimée à 1 % d’une classe d’âge soit environ 8 000 cas par an (Baromètres santé 1992-1995-2000-2005, Inpes ; Baudier et coll., 1994 ; Baudier et Arene, 1997
; Baudier et Arene, 1997 ; Guilbert et coll., 2001
; Guilbert et coll., 2001 ; Beck et coll., 2008
; Beck et coll., 2008 ). En posant pour hypothèses que : de 65 à 95 % des expérimentateurs utilisaient tôt ou tard la voie intraveineuse ; de 80 à 90 % de ces derniers étaient contaminés dans les trois années suivant la première injection ; et que la consommation, à cette époque, d’autres drogues par voie injectée était marginale, on peut estimer que le nombre de nouveaux cas d’hépatite C entre 1992 et 1995 était compris entre 4 000 et 7 000 par an. Cette estimation, bien que plausible, n’est pas confirmée par d’autres sources.
). En posant pour hypothèses que : de 65 à 95 % des expérimentateurs utilisaient tôt ou tard la voie intraveineuse ; de 80 à 90 % de ces derniers étaient contaminés dans les trois années suivant la première injection ; et que la consommation, à cette époque, d’autres drogues par voie injectée était marginale, on peut estimer que le nombre de nouveaux cas d’hépatite C entre 1992 et 1995 était compris entre 4 000 et 7 000 par an. Cette estimation, bien que plausible, n’est pas confirmée par d’autres sources. ). En 2008, avec 70 cas estimés, les personnes infectées par usage de drogue intraveineuse représentaient 1 % des nouvelles contaminations (Le Vu et coll., 2009
). En 2008, avec 70 cas estimés, les personnes infectées par usage de drogue intraveineuse représentaient 1 % des nouvelles contaminations (Le Vu et coll., 2009 ). La co-infection par le VHC serait le témoin d’une contamination secondaire à l’usage de drogues par voie intraveineuse parmi la population des sujets contaminés par le VIH dans la mesure où environ 71,6 % des cas de co-infection seraient liés à l’usage de drogues et 92,8 % (89,0-95,3 %) des usagers de drogues VIH positifs seraient également VHC positifs (Larsen et coll., 2005
). La co-infection par le VHC serait le témoin d’une contamination secondaire à l’usage de drogues par voie intraveineuse parmi la population des sujets contaminés par le VIH dans la mesure où environ 71,6 % des cas de co-infection seraient liés à l’usage de drogues et 92,8 % (89,0-95,3 %) des usagers de drogues VIH positifs seraient également VHC positifs (Larsen et coll., 2005 ). Par conséquent, en France, la proportion de cas de co-infection parmi les sujets VIH positifs reflèterait dans une large mesure le poids épidémiologique de l’usage de drogues comme mode de transmission du VIH. En France, la proportion de sujets VIH positifs co-infectés par le VHC serait comprise entre 21,7 % (Amin et coll., 2004
). Par conséquent, en France, la proportion de cas de co-infection parmi les sujets VIH positifs reflèterait dans une large mesure le poids épidémiologique de l’usage de drogues comme mode de transmission du VIH. En France, la proportion de sujets VIH positifs co-infectés par le VHC serait comprise entre 21,7 % (Amin et coll., 2004 ) et 24,3 % (Larsen et coll., 2005
) et 24,3 % (Larsen et coll., 2005 ). Cette prévalence est avec celle de la Suisse l’une des plus élevées d’Europe, après celles de l’Italie et de l’Espagne (figure 6.2
). Cette prévalence est avec celle de la Suisse l’une des plus élevées d’Europe, après celles de l’Italie et de l’Espagne (figure 6.2 ).
). ). Le système de surveillance de l’InVS indique que le pic de cas de sida déclarés chez les usagers de drogues en France a été atteint en 1993. Déterminée par la méthode de rétrocalcul fondée sur le fait selon lequel le nombre de nouveaux cas de sida est la résultante des nombres de sujets précédemment infectés par le VIH après une durée d’incubation donnée, l’incidence du VIH chez les usagers de drogues par voie intraveineuse aurait atteint un pic vers 1985, suivi d’une diminution rapide pour atteindre un taux de contamination annuelle très faible dès le début des années 1990 (Downs et coll., 1997
). Le système de surveillance de l’InVS indique que le pic de cas de sida déclarés chez les usagers de drogues en France a été atteint en 1993. Déterminée par la méthode de rétrocalcul fondée sur le fait selon lequel le nombre de nouveaux cas de sida est la résultante des nombres de sujets précédemment infectés par le VIH après une durée d’incubation donnée, l’incidence du VIH chez les usagers de drogues par voie intraveineuse aurait atteint un pic vers 1985, suivi d’une diminution rapide pour atteindre un taux de contamination annuelle très faible dès le début des années 1990 (Downs et coll., 1997 ; figure 6.3
; figure 6.3 ). Ainsi en 1997, les usagers de drogues VIH positifs de moins de 25 ans, donc vraisemblablement contaminés après 1990, ne représentaient que 2,5 % de l’ensemble des usagers de drogues VIH positifs, soit environ 700 sujets (Desenclos et coll., 2005
). Ainsi en 1997, les usagers de drogues VIH positifs de moins de 25 ans, donc vraisemblablement contaminés après 1990, ne représentaient que 2,5 % de l’ensemble des usagers de drogues VIH positifs, soit environ 700 sujets (Desenclos et coll., 2005 ). Cette probable incidence très faible du VIH dès le début des années 1990 est corroborée par plusieurs études épidémiologiques menées dans le Nord et l’Est de la France (Lucidarme et coll., 1994
). Cette probable incidence très faible du VIH dès le début des années 1990 est corroborée par plusieurs études épidémiologiques menées dans le Nord et l’Est de la France (Lucidarme et coll., 1994 ; Schmitt et coll., 1994
; Schmitt et coll., 1994 ; Chossegros, 2007
; Chossegros, 2007 ) qui retrouvaient une prévalence faible du VIH de l’ordre de 1 % à 8 % parmi les usagers de drogues suivis en centre de soins car l’usage d’héroïne par voie intraveineuse ne s’est pas répandu dans le Nord et l’Est de la France avant la fin des années 1980. En France, l’épidémie de VIH chez les usagers de drogues a la double caractéristique d’avoir été à la fois importante ce dont témoigne la part élevée de l’usage de drogues par rapport à l’ensemble des contaminations (Amin et coll., 2004
) qui retrouvaient une prévalence faible du VIH de l’ordre de 1 % à 8 % parmi les usagers de drogues suivis en centre de soins car l’usage d’héroïne par voie intraveineuse ne s’est pas répandu dans le Nord et l’Est de la France avant la fin des années 1980. En France, l’épidémie de VIH chez les usagers de drogues a la double caractéristique d’avoir été à la fois importante ce dont témoigne la part élevée de l’usage de drogues par rapport à l’ensemble des contaminations (Amin et coll., 2004 ) et limitée dans le temps ce dont témoigne un faible nombre de cas incidents dès le début des années 1990 (Lucidarme et coll., 1994
) et limitée dans le temps ce dont témoigne un faible nombre de cas incidents dès le début des années 1990 (Lucidarme et coll., 1994 ; Downs et coll., 1997
; Downs et coll., 1997 ; Desenclos et coll., 2005
; Desenclos et coll., 2005 ).
).
 )
) ; Deuffic et coll., 1999
; Deuffic et coll., 1999 ), les courbes d’incidence du VHC et du VIH auraient été à peu près parallèles entre 1980 et 1985 avant de diverger ensuite. L’incidence du VHC aurait continué à croître jusque vers 1990 alors qu’une décroissance rapide de l’incidence du VIH se serait amorcée à cette époque. Trois facteurs pourraient expliquer la baisse de l’incidence du VIH :
), les courbes d’incidence du VHC et du VIH auraient été à peu près parallèles entre 1980 et 1985 avant de diverger ensuite. L’incidence du VHC aurait continué à croître jusque vers 1990 alors qu’une décroissance rapide de l’incidence du VIH se serait amorcée à cette époque. Trois facteurs pourraient expliquer la baisse de l’incidence du VIH : ).
). ).
). et b
et b ). Aussi, dans ce contexte de profonde mutation, malgré des données épidémiologiques plus abondantes, l’impact de la politique de réduction des risques sur la transmission du VHC est difficile à établir.
). Aussi, dans ce contexte de profonde mutation, malgré des données épidémiologiques plus abondantes, l’impact de la politique de réduction des risques sur la transmission du VHC est difficile à établir. ).
). ). En 2000, le nombre de sujets VIH positifs chez les usagers de drogues était évalué à 20 200 cas (14 300- 29 100) (Desenclos et coll., 2005
). En 2000, le nombre de sujets VIH positifs chez les usagers de drogues était évalué à 20 200 cas (14 300- 29 100) (Desenclos et coll., 2005 ). En multipliant 20 200 par un facteur 5,54, on obtient une estimation de 112 000 usagers de drogues VHC positifs (79 000 à 160 000). Même si chaque source est susceptible d’être biaisée, on pourrait estimer le nombre d’usagers de drogues VHC positifs en 2004 entre 105 000 et 112 000.
). En multipliant 20 200 par un facteur 5,54, on obtient une estimation de 112 000 usagers de drogues VHC positifs (79 000 à 160 000). Même si chaque source est susceptible d’être biaisée, on pourrait estimer le nombre d’usagers de drogues VHC positifs en 2004 entre 105 000 et 112 000. ), l’extrapolation du taux de mortalité de 7,3 pour mille personnes-années (Lopez et coll., 2004
), l’extrapolation du taux de mortalité de 7,3 pour mille personnes-années (Lopez et coll., 2004 ) à cette population aboutit à un nombre de décès annuels compris entre 1 000 et 1 300. Si l’on considère que la prévalence du VHC parmi les usagers problématiques de drogues était de 60 % (Jauffret-Roustide et coll., 2009
) à cette population aboutit à un nombre de décès annuels compris entre 1 000 et 1 300. Si l’on considère que la prévalence du VHC parmi les usagers problématiques de drogues était de 60 % (Jauffret-Roustide et coll., 2009 ), entre 600 et 800 usagers de drogues VHC positifs seraient décédés chaque année entre 1994 et 2004, soit de 6 000 à 8 000 pour la décennie concernée. Par conséquent, le nombre de cas incidents d’hépatite C chez les usagers de drogues VHC positifs entre 1994 et 2004 serait compris entre 5 000 à 42 000 (si l’on tient compte des intervalles de confiance) soit une moyenne estimée de 500 à 4 200 nouveaux cas par an. Une moyenne de 500 à 4 200 nouveaux cas par an d’infection par le VHC chez les usagers de drogues entre 1994 et 2004 ne signifie pas que l’incidence aurait été stable entre 1994 et 2004. Depuis le début des années 1990, la tendance de l’incidence du VHC était à la baisse. Par conséquent, l’incidence annuelle du VHC en 1994 était probablement proche de 4 200 nouveaux cas par an alors qu’en 2004 celle-ci était plus proche de la borne inférieure que de la supérieure.
), entre 600 et 800 usagers de drogues VHC positifs seraient décédés chaque année entre 1994 et 2004, soit de 6 000 à 8 000 pour la décennie concernée. Par conséquent, le nombre de cas incidents d’hépatite C chez les usagers de drogues VHC positifs entre 1994 et 2004 serait compris entre 5 000 à 42 000 (si l’on tient compte des intervalles de confiance) soit une moyenne estimée de 500 à 4 200 nouveaux cas par an. Une moyenne de 500 à 4 200 nouveaux cas par an d’infection par le VHC chez les usagers de drogues entre 1994 et 2004 ne signifie pas que l’incidence aurait été stable entre 1994 et 2004. Depuis le début des années 1990, la tendance de l’incidence du VHC était à la baisse. Par conséquent, l’incidence annuelle du VHC en 1994 était probablement proche de 4 200 nouveaux cas par an alors qu’en 2004 celle-ci était plus proche de la borne inférieure que de la supérieure. ) et à 11 pour 100 personnes-années parmi les injecteurs actifs c’est-à-dire ayant injecté au moins une fois dans les 6 mois précédant l’inclusion. Une extrapolation de ces résultats aux usagers de drogues injecteurs actifs présumés VHC négatifs estimait à cette époque qu’environ 3 500 (2 700 à 4 400) nouveaux cas de contamination parmi les usagers de drogues survenaient en France chaque année (Emmanuelli et coll., 2003
) et à 11 pour 100 personnes-années parmi les injecteurs actifs c’est-à-dire ayant injecté au moins une fois dans les 6 mois précédant l’inclusion. Une extrapolation de ces résultats aux usagers de drogues injecteurs actifs présumés VHC négatifs estimait à cette époque qu’environ 3 500 (2 700 à 4 400) nouveaux cas de contamination parmi les usagers de drogues survenaient en France chaque année (Emmanuelli et coll., 2003 ). Cette estimation ne reflèterait que l’année 1999 et non l’ensemble de la décennie dans la mesure où l’incidence n’était pas stable d’une année sur l’autre.
). Cette estimation ne reflèterait que l’année 1999 et non l’ensemble de la décennie dans la mesure où l’incidence n’était pas stable d’une année sur l’autre. ), le nombre de sujets VHC positifs âgés de 18 à 29 ans était estimé à 7 977 (303-15 562). De même, dans l’enquête Coquelicot réalisée la même année (Jauffret-Roustide et coll., 2006a
), le nombre de sujets VHC positifs âgés de 18 à 29 ans était estimé à 7 977 (303-15 562). De même, dans l’enquête Coquelicot réalisée la même année (Jauffret-Roustide et coll., 2006a et b
et b ), la proportion de sujets nés après 1974 et donc âgés de 18 à 29 ans ne représentait que 10,4 % de l’ensemble de l’effectif des sujets VHC positifs, soit 11 648 (8 200-16 600) sujets, compte-tenu de l’estimation d’un effectif total de 112 000 (79 000 à 160 000) précédemment établie à partir de la même étude. La fourchette obtenue à partir de ces deux estimations (7 977-11 648) représenterait une estimation du nombre de sujets contaminés par le VHC entre 1999 et 2004, en posant pour hypothèse que le nombre de sujets nés avant 1975 contaminés entre 1999 et 2004 était marginal.
), la proportion de sujets nés après 1974 et donc âgés de 18 à 29 ans ne représentait que 10,4 % de l’ensemble de l’effectif des sujets VHC positifs, soit 11 648 (8 200-16 600) sujets, compte-tenu de l’estimation d’un effectif total de 112 000 (79 000 à 160 000) précédemment établie à partir de la même étude. La fourchette obtenue à partir de ces deux estimations (7 977-11 648) représenterait une estimation du nombre de sujets contaminés par le VHC entre 1999 et 2004, en posant pour hypothèse que le nombre de sujets nés avant 1975 contaminés entre 1999 et 2004 était marginal. ) par la baisse de la prévalence du VHC très nette dans les tranches d’âge de 20-29 ans entre 1994 et 2004 en population générale (Delarocque-Astagneau et coll., 2009
) par la baisse de la prévalence du VHC très nette dans les tranches d’âge de 20-29 ans entre 1994 et 2004 en population générale (Delarocque-Astagneau et coll., 2009 ).
).
 )
) ; Jauffret-Roustide et coll., 2009
; Jauffret-Roustide et coll., 2009 ; Di Nino et coll., 2009
; Di Nino et coll., 2009 ) ou les structures de première ligne (Cadet-Taïrou et coll., 2010
) ou les structures de première ligne (Cadet-Taïrou et coll., 2010 ) semblent indiquer une poursuite de la décroissance de l’incidence du VHC, même si l’interprétation de ces données doit rester prudente en raison de l’hétérogénéité géographique et méthodologique de ces différentes sources.
) semblent indiquer une poursuite de la décroissance de l’incidence du VHC, même si l’interprétation de ces données doit rester prudente en raison de l’hétérogénéité géographique et méthodologique de ces différentes sources. et b
et b ), de 29 % dans la seconde en 2004 (Jauffret-Roustide et coll., 2009
), de 29 % dans la seconde en 2004 (Jauffret-Roustide et coll., 2009 ), et de seulement 7 % en 2007 dans le réseau des microstructures médicales en Alsace (Di Nino et coll., 2009
), et de seulement 7 % en 2007 dans le réseau des microstructures médicales en Alsace (Di Nino et coll., 2009 ).
). ). L’analyse de la base de données de l’année 2006 a permis de déterminer la proportion des sérologies positives, négatives et inconnues du VHC des patients suivis en CSST/Csapa selon le sexe et l’année de naissance donnant ainsi une représentation longitudinale à cette étude transversale (Cauchi-Duval, 2009
). L’analyse de la base de données de l’année 2006 a permis de déterminer la proportion des sérologies positives, négatives et inconnues du VHC des patients suivis en CSST/Csapa selon le sexe et l’année de naissance donnant ainsi une représentation longitudinale à cette étude transversale (Cauchi-Duval, 2009 ). Après un aspect en plateau concernant la génération née entre 1955 et 1965, la prévalence du VHC a amorcé une décroissance lente et régulière parmi les usagers nés entre 1965 et 1980 (figure 6.5
). Après un aspect en plateau concernant la génération née entre 1955 et 1965, la prévalence du VHC a amorcé une décroissance lente et régulière parmi les usagers nés entre 1965 et 1980 (figure 6.5 ). Parmi les usagers les plus jeunes nés après 1980, la prévalence était inférieure à 5 % mais la proportion des sujets de cette tranche d’âge dépistés était plus basse. La force de cette étude est sa puissance statistique avec plus de 25 000 sujets inclus. Sa principale limite est le caractère déclaratif des résultats sérologiques. Les prévalences des sérologies déclarées positives pour le VHC chez les usagers de drogues injecteurs de moins de 25 ans dans les CSST avec hébergement en 1998 (Six et coll., 1999
). Parmi les usagers les plus jeunes nés après 1980, la prévalence était inférieure à 5 % mais la proportion des sujets de cette tranche d’âge dépistés était plus basse. La force de cette étude est sa puissance statistique avec plus de 25 000 sujets inclus. Sa principale limite est le caractère déclaratif des résultats sérologiques. Les prévalences des sérologies déclarées positives pour le VHC chez les usagers de drogues injecteurs de moins de 25 ans dans les CSST avec hébergement en 1998 (Six et coll., 1999 ) et dans les structures de première ligne en 2006 (Cadet-Taïrou et coll., 2010
) et dans les structures de première ligne en 2006 (Cadet-Taïrou et coll., 2010 ) étaient de 40,8 % et de 12,2 % respectivement. Les données déclaratives des usagers (de moins de 25 ans ayant déjà utilisé l’injection dans leur vie) des structures de première ligne (Caarud) recueillies dans le cadre d’une enquête exhaustive menée sur la même semaine de l’année en 2006 et 2008 évoquent une décroissance de la prévalence du VHC qui serait passée de 22,5 % à 14,3 % (Cadet-Tairou et coll., 2010
) étaient de 40,8 % et de 12,2 % respectivement. Les données déclaratives des usagers (de moins de 25 ans ayant déjà utilisé l’injection dans leur vie) des structures de première ligne (Caarud) recueillies dans le cadre d’une enquête exhaustive menée sur la même semaine de l’année en 2006 et 2008 évoquent une décroissance de la prévalence du VHC qui serait passée de 22,5 % à 14,3 % (Cadet-Tairou et coll., 2010 ).
).
 ; Source Recap/OFDT 2006)
; Source Recap/OFDT 2006) ). Même si le nombre de nouveaux cas diagnostiqués ne peut être assimilé au nombre de cas incidents dans la mesure où le diagnostic d’infection par le VHC est volontiers fait plusieurs années après la contamination, cette étude nationale conforte de façon indirecte la tendance générale.
). Même si le nombre de nouveaux cas diagnostiqués ne peut être assimilé au nombre de cas incidents dans la mesure où le diagnostic d’infection par le VHC est volontiers fait plusieurs années après la contamination, cette étude nationale conforte de façon indirecte la tendance générale. et b
et b ). Aux Pays-Bas, une politique de réduction des risques avait été mise en place dès le début des années 1980.
). Aux Pays-Bas, une politique de réduction des risques avait été mise en place dès le début des années 1980. ). Dans l’étude Recap, les consommateurs d’héroïne les plus âgés (après 40 ans) sont près de la moitié à utiliser l’injection comme mode d’administration, alors que les plus jeunes ont plus largement adopté le sniff (figure 6.6
). Dans l’étude Recap, les consommateurs d’héroïne les plus âgés (après 40 ans) sont près de la moitié à utiliser l’injection comme mode d’administration, alors que les plus jeunes ont plus largement adopté le sniff (figure 6.6 ). L’injection, qui est le deuxième mode d’administration le plus courant de la cocaïne après le sniff, présente comme pour l’héroïne un désintérêt de la part des générations les plus jeunes. De même, parmi les usagers des Caarud, la part des personnes qui n’ont jamais eu recours à l’injection tend à s’accroître (Cadet-Tairou et coll., 2010
). L’injection, qui est le deuxième mode d’administration le plus courant de la cocaïne après le sniff, présente comme pour l’héroïne un désintérêt de la part des générations les plus jeunes. De même, parmi les usagers des Caarud, la part des personnes qui n’ont jamais eu recours à l’injection tend à s’accroître (Cadet-Tairou et coll., 2010 ). D’autre part, l’injection en milieu festif demeure un phénomène marginal.
). D’autre part, l’injection en milieu festif demeure un phénomène marginal.
 ; Source Recap/OFDT 2006)
; Source Recap/OFDT 2006) ; Jauffret-Roustide et coll., 2009
; Jauffret-Roustide et coll., 2009 ). Dans l’étude Recap, l’âge moyen de l’expérimentation de drogues illicites est stable dans le temps et la part de ceux qui injectent dès la première année de consommation reste élevée puisque plus de la moitié des injecteurs ont débuté l’injection avant leur premier anniversaire de consommation, 90 % après 5 ans de consommation (Cauchi-Duval, 2009
). Dans l’étude Recap, l’âge moyen de l’expérimentation de drogues illicites est stable dans le temps et la part de ceux qui injectent dès la première année de consommation reste élevée puisque plus de la moitié des injecteurs ont débuté l’injection avant leur premier anniversaire de consommation, 90 % après 5 ans de consommation (Cauchi-Duval, 2009 ).
). ). Dans l’étude Coquelicot de 2004, 8 % des sujets ayant injecté ou sniffé au moins une fois et seulement 3 % des injecteurs étaient âgés de moins de 25 ans (Jauffret-Roustide et coll., 2006a
). Dans l’étude Coquelicot de 2004, 8 % des sujets ayant injecté ou sniffé au moins une fois et seulement 3 % des injecteurs étaient âgés de moins de 25 ans (Jauffret-Roustide et coll., 2006a et b
et b ; Drees, 2007
; Drees, 2007 ). Ce phénomène n’est pas limité à l’hexagone. En Suisse, le taux d’usagers ayant débuté les injections depuis moins de deux ans est passé entre 1993 et 2006 de 18,7 % à 3,3 %. Le vieillissement de la population suivie, dont l’âge moyen est passé de 26 ans à 36 ans entre 1993 et 2006, est la conséquence de ce phénomène (Dubois-Arber et coll., 2008
). Ce phénomène n’est pas limité à l’hexagone. En Suisse, le taux d’usagers ayant débuté les injections depuis moins de deux ans est passé entre 1993 et 2006 de 18,7 % à 3,3 %. Le vieillissement de la population suivie, dont l’âge moyen est passé de 26 ans à 36 ans entre 1993 et 2006, est la conséquence de ce phénomène (Dubois-Arber et coll., 2008 ). Ce renouvellement limité de la population des usagers de drogues suivis en centres de soins explique en grande partie une stabilité dans le temps de la prévalence du VHC dans la plupart des études transversales menées entre 1991 et 2004, de l’ordre de 50 à 80 % (Lucidarme et coll., 1994
). Ce renouvellement limité de la population des usagers de drogues suivis en centres de soins explique en grande partie une stabilité dans le temps de la prévalence du VHC dans la plupart des études transversales menées entre 1991 et 2004, de l’ordre de 50 à 80 % (Lucidarme et coll., 1994 ; Schmitt et coll., 1994
; Schmitt et coll., 1994 ; Bello et coll., 1998
; Bello et coll., 1998 ; Valenciano et coll., 2001
; Valenciano et coll., 2001 ; Jauffret-Roustide et coll., 2009
; Jauffret-Roustide et coll., 2009 ).
). ).
). ). Ainsi, les pratiques d’injection pluri-quotidiennes couramment observées, avant la mise en place des traitements de substitution aux opiacés, sont moins fréquentes diminuant mécaniquement la fréquence de l’injection et donc les risques qui lui sont associés. Cependant, l’augmentation récente de la consommation de cocaïne qui engendre un nombre important d’injections (ou de sniff) pourrait venir compenser cette diminution des injections d’héroïne.
). Ainsi, les pratiques d’injection pluri-quotidiennes couramment observées, avant la mise en place des traitements de substitution aux opiacés, sont moins fréquentes diminuant mécaniquement la fréquence de l’injection et donc les risques qui lui sont associés. Cependant, l’augmentation récente de la consommation de cocaïne qui engendre un nombre important d’injections (ou de sniff) pourrait venir compenser cette diminution des injections d’héroïne. ). Dans l’étude Coquelicot en 2004, la force de l’infection reste élevée. En effet, malgré le faible nombre de sujets concernés, la prévalence du VHC parmi les injecteurs de moins de 25 ans était de 32,1 % (Drees, 2007
). Dans l’étude Coquelicot en 2004, la force de l’infection reste élevée. En effet, malgré le faible nombre de sujets concernés, la prévalence du VHC parmi les injecteurs de moins de 25 ans était de 32,1 % (Drees, 2007 ). Ainsi, ces dernières années, l’incidence cumulée du VHC après 5 années de pratique d’injection serait de l’ordre de 40 % à 50 % alors qu’elle était de 90 % au début des années 1990 (Lucidarme et coll., 1994
). Ainsi, ces dernières années, l’incidence cumulée du VHC après 5 années de pratique d’injection serait de l’ordre de 40 % à 50 % alors qu’elle était de 90 % au début des années 1990 (Lucidarme et coll., 1994 ). Pour les usagers ayant commencé l’héroïne après l’introduction des traitements de substitution aux opiacés, la période de dépendance après prise en charge thérapeutique est fortement raccourcie. Les personnes substituées opèrent une sortie de la dépendance à l’héroïne plus précoce que leurs pairs des générations précédentes qui connaissaient en moyenne une durée de dépendance d’une dizaine d’années (Toufik et coll., 2010
). Pour les usagers ayant commencé l’héroïne après l’introduction des traitements de substitution aux opiacés, la période de dépendance après prise en charge thérapeutique est fortement raccourcie. Les personnes substituées opèrent une sortie de la dépendance à l’héroïne plus précoce que leurs pairs des générations précédentes qui connaissaient en moyenne une durée de dépendance d’une dizaine d’années (Toufik et coll., 2010 ).
). ). À la fin de l’année 2005, 16 % des cas prévalents d’infection par le VHC avaient reçu un traitement anti-viral (figure 6.7
). À la fin de l’année 2005, 16 % des cas prévalents d’infection par le VHC avaient reçu un traitement anti-viral (figure 6.7 ). Cette diffusion du traitement serait à l’origine d’une baisse sensible de la proportion de sujets séropositifs pour le VHC et virémiques passant de 81 % en 1994 (Dubois et coll., 1997
). Cette diffusion du traitement serait à l’origine d’une baisse sensible de la proportion de sujets séropositifs pour le VHC et virémiques passant de 81 % en 1994 (Dubois et coll., 1997 ) à 65 % en 2004 (Meffre et coll., 2010
) à 65 % en 2004 (Meffre et coll., 2010 ). Chez les usagers de drogues, le traitement n’est pas dissociable des efforts de prévention et de dépistage des nouvelles contaminations. Leur accessibilité au traitement a également fait l’objet d’efforts importants. En 2008, 70,5 % des usagers des Caarud, porteurs du VHC, ont consulté dans l’année pour cette pathologie et plus du quart (28 %) est sous traitement soit 5,5 points de plus qu’en 2006 (Bello et coll., 2010
). Chez les usagers de drogues, le traitement n’est pas dissociable des efforts de prévention et de dépistage des nouvelles contaminations. Leur accessibilité au traitement a également fait l’objet d’efforts importants. En 2008, 70,5 % des usagers des Caarud, porteurs du VHC, ont consulté dans l’année pour cette pathologie et plus du quart (28 %) est sous traitement soit 5,5 points de plus qu’en 2006 (Bello et coll., 2010 ). Le traitement des usagers de drogues est favorisé par la présence d’un génotype favorable dans environ un cas sur deux. Une étude réalisée par le Groupe français d’étude moléculaire des hépatites (Gemhep) (Martinot-Peignoux et coll., 1999
). Le traitement des usagers de drogues est favorisé par la présence d’un génotype favorable dans environ un cas sur deux. Une étude réalisée par le Groupe français d’étude moléculaire des hépatites (Gemhep) (Martinot-Peignoux et coll., 1999 ) avait montré que la répartition des génotypes dans la population toxicomane était la suivante : génotype 1a 26,0 %, génotype 1b 12,8 %, génotype 2a 3,3 %, génotype 3a 43,2 %, autres génotypes 16,7 %. Cette répartition des génotypes semble stable ces dernières années car plusieurs études récentes ont rapporté des pourcentages similaires (Bourlière et coll., 2002
) avait montré que la répartition des génotypes dans la population toxicomane était la suivante : génotype 1a 26,0 %, génotype 1b 12,8 %, génotype 2a 3,3 %, génotype 3a 43,2 %, autres génotypes 16,7 %. Cette répartition des génotypes semble stable ces dernières années car plusieurs études récentes ont rapporté des pourcentages similaires (Bourlière et coll., 2002 ; Payan et coll., 2005
; Payan et coll., 2005 ; Di Nino et coll., 2009
; Di Nino et coll., 2009 ). Les résultats obtenus en termes de réponse au traitement, d’effets indésirables et d’interruption prématurée de traitement sont globalement comparables à ceux observés chez les patients non usagers de drogues (Bruggmann et coll., 2008
). Les résultats obtenus en termes de réponse au traitement, d’effets indésirables et d’interruption prématurée de traitement sont globalement comparables à ceux observés chez les patients non usagers de drogues (Bruggmann et coll., 2008 ; Chossegros et coll., 2008
; Chossegros et coll., 2008 ). Dans ce contexte, une prise en charge multidisciplinaire des problèmes d’addiction, de l’hépatite C et des comorbidités psychiatriques fréquemment associées est nécessaire (Moussalli et coll., 2007
). Dans ce contexte, une prise en charge multidisciplinaire des problèmes d’addiction, de l’hépatite C et des comorbidités psychiatriques fréquemment associées est nécessaire (Moussalli et coll., 2007 ). La proportion de re-contaminations après traitement ayant permis la guérison ne dépasserait pas 10 % des cas (Backmund et coll., 2001
). La proportion de re-contaminations après traitement ayant permis la guérison ne dépasserait pas 10 % des cas (Backmund et coll., 2001 ; Sylvestre, 2002
; Sylvestre, 2002 ; Dalgard et coll., 2002
; Dalgard et coll., 2002 ) et ne justifie pas de récuser le traitement du VHC chez les usagers de drogues.
) et ne justifie pas de récuser le traitement du VHC chez les usagers de drogues.
 )
)