 |
| |||
Med Sci (Paris). 2015 November; 31: 11–13. Published online 2015 November 6. doi: 10.1051/medsci/201531s303.Syndrome de Chanarin-Dorfman Quand la myopathie et l’atteinte cutanée ne font qu’un 1Service de neuropédiatrie et Centre de Référence des maladies neuromusculaires Garches-Necker-Mondor-Hendaye, site Necker, AP-HP 2Laboratoire d’anatomopathologie et Centre de Référence des maladies neuromusculaires Garches-Necker-Mondor-Hendaye, site Mondor, AP-HP 3UF de génétique et oncogénétique moléculaires, Hôpital Avicenne, AP-HP Corresponding author. | ||
| ||
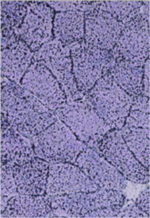
La patiente est une fillette âgée de 7 ans, au moment du diagnostic. Ses parents sont apparentés (cousins germains). Toute sa famille est kurde, originaire de Turquie. Elle est née prématurément à 36 SA, après une grossesse s’étant déroulée normalement. Sont rapportées à la naissance une microcéphalie modérée (PC au 10e percentile), une érythrodermie néonatale et une hypocalcémie transitoire. L’érythrodermie va persister dans le temps, mais reste stable. Elle s’associe à une ichtyose, sans poussée inflammatoire ni prurit important sauf lorsque la peau est très sèche. Elle reçoit pour cela un traitement à base d’émollients. Elle a un retard de langage alors qu’elle est scolarisée en maternelle, lequel sera rapporté à un trilinguisme. Une évaluation neuropsychologique retrouve une efficience cognitive de bonne qualité, mis à part ce retard de langage. La croissance du périmètre crânien post-natal est normale. Lors d’un bilan sanguin, un dosage retrouve des transaminases élevées (8 fois la norme). Ce résultat conduit à pratiquer un dosage des CPK, s’avérant élevé par deux fois : 1 023 et 937 UI/l (N < 160 UI/l). À l’examen clinique, elle présente un déficit de la ceinture pelvienne, avec un signe de Gowers net. Elle a depuis toujours des difficultés à courir et a besoin de se tracter pour monter les escaliers. Il existe par ailleurs un minime déficit axial, mais pas de déficit scapulaire évident, pas d’atteinte faciale, pas d’amyotrophie. Elle n’a pas de rétractions, pas d’atteinte squelettique, pas de scoliose. Elle a par ailleurs une surcharge pondérale avec un poids à + 3DS, semblant secondaire à ses habitudes alimentaires. Dans ce contexte, une biopsie musculaire du deltoïde est réalisée. L’histologie met en évidence une microvacuolisation du cytoplasme des myocytes, prédominant dans les fibres de type I (Figure 1). Ces vacuoles de petites tailles sont vides en coloration PAS et révèlent un contenu lipidique en coloration noir soudan. Par ailleurs, l’expression des marquages membranaires est normale sur des coupes de muscle en congélation (HLA classe I, CD3, CD 56, complexe d’attaque membranaine, dystrophine, sarcoglycanes, dysferline, mérosine, cavéoline 3, desmine, fast-myosine). Le western blot montre un aspect décalé pour la calpaïne, avec une surexpression de la fraction 94kD, mais sans anomalie du gène de la calpaïne. D’emblée cet aspect de lipidose fait poser le diagnostic de syndrome de Chanarin-Dorfman. Ce résultat sera ensuite confirmé par l’étude moléculaire, avec la mise en évidence d’une mutation homozygote dans le gène ABDHD5 (CGI-58) : insertion d’un nucléotide à l’état homozygote dans l’exon 4 (c.[594_595insC] ; [594_595insC]). Cette mutation délétère a déjà été rapportée auparavant dans une famille turque. Le bilan complémentaire réalisé chez l’enfant montrera une discrète hypertrophie du ventricule gauche concentrique, avec une fonction cardiaque normale. Le reste du bilan est normal (pas de surdité, pas d’atteinte ophtalmologique, pas d’hépatomégalie, ni de stéatose).
| ||
Le syndrome de Chanarin-Dorfman (CDS) est une pathologie rare récessive autosomique, rapportée dans un peu moins d’une centaine de cas environ. La plupart des familles sont originaires du bassin méditerranéen ou du Moyen-Orient, mais certaines ont aussi été décrites au Japon ou en Inde [1]. Ce syndrome est l’unique cause d’ichtyose congénitale associée à une accumulation de lipides neutres. L’atteinte cutanée est systématique et congénitale ; elle prend la forme d’une ichtyose non bulleuse sur peau érythrodermique (NCIE pour Non Bullous Congenital Ichthyosiform Erythroderma), avec de fines ou moyennes desquamations et sans hyperkératose [2]. En plus de l’ichtyose, on peut observer d’autres atteintes d’organes. La fréquence de l’atteinte myopathique n’est pas clairement connue. Elle est décrite comme symptôme présent dans 60 % à 100 % des cas selon les séries. Cette atteinte est peut-être sous-estimée car elle n’est pas rapportée systématiquement. Son évolution n’est pas non plus clairement établie. Alors qu’elle semble être le plus souvent lentement progressive et touchant plutôt les adultes, elle est parfois stable. Elle prédomine au niveau des ceintures et ne semble, en tous cas, jamais être très invalidante. La biopsie musculaire quand elle est réalisée montre toujours une accumulation de lipides neutres. Le diagnostic différentiel de cette myopathie avec accumulation de lipides neutres est la myopathie due aux mutations du gène PNPLA2 impliqué dans la première étape de l’hydrolyse des triglycérides. Cette dernière forme de myopathie ne touche que le muscle squelettique et cardiaque et n’entraîne pas d’ichtyose, laquelle est donc un signe distinctif majeur [3]. L’atteinte hépatique, assez fréquente, est rapportée dans environ 64 % des cas. La principale manifestation est l’hépatomégalie avec ou sans élévation des transaminases, mais des stéatoses hépatiques, parfois sévères, ont été rapportées pouvant conduire à une fibrose et à une cirrhose hépatique. L’atteinte neurologique centrale est rare : elle se manifeste par un retard mental, cependant rarement décrit. D’autres signes comme l’ataxie, l’épilepsie ou la microcéphalie paraissent encore plus rares. L’atteinte sensorielle à type de surdité paraît, elle, fréquente et évolutive au cours du temps. D’autres atteintes d’organes sont encore possibles : cataracte, ptosis, nystagmus, cardiomyopathie, splénomégalie, retard de croissance statural, insuffisance rénale ou encore rachitisme par insuffisance en vitamine D. L’existence de vacuoles lipidiques dans les leucocytes (corps de Jordan) est un test diagnostique facile à réaliser en routine et permet lorsqu’il existe une ichtyose érythrodermique d’orienter rapidement le diagnostic. L’accumulation de lipides est du reste visible dans d’autres tissus quand elle est recherchée : par exemple dans la peau, le foie. L’origine de cette pathologie est une anomalie dans le gène ABHD5 (CGI-58), α/β-Hydrolase Domain Containing Protein 5, gène situé en 3p21 et comprenant 7 exons [4]. Il est exprimé de façon préférentielle à la surface des gouttelettes lipidiques. Dans le syndrome de Chanarin-Dorfman, il existe une accumulation importante de gouttelettes lipidiques cytosoliques contenant du triacylglycérol dans différents tissus comme la peau, le foie ou les leucocytes. Dans les adipocytes, la protéine ABHD5 participe à la dégradation du triacylglycérol (comme co-activateur de la triglycéride lipase) et ce, avec la participation d’autres facteurs lipolytiques comme la périlipine. Certaines mutations du gène ABHD5 perturberaient son interaction avec la périlipine ou sa capacité à activer la triglycéride lipase des adipocytes. La distribution cellulaire de ces facteurs lipolytiques, expliquerait les multiples cibles de l’action du gène ABHD5, conduisant à des phénotypes aussi divers que l’ichtyose, la stéatose hépatique ou la surdité [5]. | ||
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. | ||
1.
Redaelli C, Coleman RA, Moro L, et al. Clinical and genetic characterisation of Chanarin-Dorfman syndrome patients: first report of large deletions in the ABHD5 gene . Orphanet J Rare Dis. 2010; ; 5 : :33.. 2.
Schmuth M, Martinz V, Janecke AR, et al. Inherited ichthyoses/generalized Mendelian disorders of cornification . Eur J Hum Genet. 2013; ; 21 : :123.–133. 3.
Reillich P, Horvath R, Krause S, et al. The phenotypic spectrum of neutral lipid storage myopathy due to mutations in the PNPLA2 gene . J Neurol. 2011; ; 258 : :1987.–1997. | ||