| |
| Med Sci (Paris). 2015 December; 31(12): 1057–1060. Published online 2015 December 16. doi: 10.1051/medsci/20153112002.L’activation de la voie eIF2α-ATF4, une réponse adaptative au stress cellulaire Alain Bruhat,1,2* Céline Jousse,1,2 Valérie Carraro,1,2 Anne-Catherine Maurin,1,2 Cédric Chaveroux,3 Laurent Parry,1,2 Julien Averous,1,2 Florent Mesclon,1,2 and Pierre Fafournoux1,2** 1INRA, UMR 1019 Nutrition Humaine, centre Auvergne-Rhône-Alpes, 63122Saint Genès Champanelle, France 2Université Clermont 1, UFR Médecine, UMR 1019 Nutrition Humaine, 63000Clermont-Ferrand, France 3Inserm U1052, CNRS UMR5286, centre de recherche en cancérologie de Lyon, 69000Lyon, France MeSH keywords: Facteur de transcription ATF-4, Adaptation physiologique, Phénomènes physiologiques cellulaires, Facteur-2 d'initiation eucaryote, Transduction du signal, Stress physiologique, physiologie |
Toutes les cellules de l’organisme doivent faire face à des perturbations de leur environnement pouvant affecter leur homéostasie. Le programme de défense de la cellule sollicite des mécanismes de signalisation permettant de détecter les perturbations de l’environnement et de mettre en place des processus physiologiques d’adaptation. Parmi les voies de signalisation mises en jeu, la voie eIF2α-ATF4 (eukaryotic initiation factor 2 alpha - activating transcription factor 4) joue un rôle clé dans la réponse à des stress cellulaires tels que la carence en acides aminés, le stress oxydant, le choc thermique ou encore l’hypoxie. |
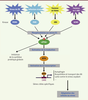
eIF2 (eukaryotic initiation factor 2) est un facteur d’initiation de la traduction composé de trois sous-unités (α, β et γ). Il est impliqué dans la fixation du premier ARN de transfert méthionine (ARNt-Met) à la petite sous-unité du ribosome. En réponse à une grande variété de stress, sa sous-unité α est phosphorylée sur la sérine 51. Chez les mammifères, cette phosphorylation peut être réalisée par quatre kinases [1]. Les deux premières sont la kinase GCN2 (general control non-depressible-2) et la kinase PERK (protein kinase RNA-like endoplasmic reticulum kinase). GCN2 est activée par la liaison d’ARNt non chargés, générés par une carence en un acide aminé indispensable (AAI), et PERK par l’accumulation de protéines malformées, conduisant au stress du réticulum endoplasmique (RE) (Figure 1). La kinase PKR (protein kinase double-stranded RNA-dependent) est, elle, activée lors d’infections virales et par certaines cytokines (interféron γ, TNFα [tumor necrosis factor] et IL[interleukine]-1β). Enfin la kinase HRI (heme regulated inhibitor), qui est la moins étudiée, est activée dans des conditions de déficit en hème1. Quel que soit le stress, la phosphorylation d’eIF2α par ces kinases va avoir pour conséquence d’empêcher la formation du complexe d’initiation de la traduction, entraînant une forte inhibition de la synthèse protéique [2]. La cellule va ainsi pouvoir réduire son métabolisme général et économiser de l’énergie pour réparer les dommages causés par le stress.
 | Figure 1.
L’activation de la voie de signalisation eIF2α-ATF4. La voie eIF2α-ATF4 est activée par 4 kinases (PERK [protein kinase RNA-like endoplasmic reticulum kinase], GCN2 [general control non-depressible-2], PKR [protein kinase double-stranded RNA-dependent], HRI [heme regulated inhibitor]) spécifiques à différents types de stress. Les kinases, une fois activées, vont phosphoryler le facteur d’initiation de la traduction, eIF2 (eukaryotic initiation factor 2), sur la sérine 51 de sa sous-unité α. Cet événement va conduire, d’une part, à l’inhibition de la synthèse protéique globale et, d’autre part, à l’induction de la traduction d’un petit nombre d’ARN messagers, dont celui codant le facteur de transcription ATF4 (activating transcription factor 4). Une fois fixé sur des séquences d’ADN cis appelées CARE (C/EBP-ATF-responsive element), ATF4 va induire un programme de gènes cibles spécifiques jouant un rôle dans l’adaptation des cellules au stress. AA : acide aminé ; AAI : acide aminé indispensable. |
En parallèle, la traduction de certains ARN messagers, comme celui de l’ATF4 (activating transcription factor 4), est sélectivement induite grâce à une structure particulière de leur région 5’ non-traduite [3]. ATF4 est un facteur de transcription qui appartient à la famille des protéines bZIP (basic leucine zipper protein). Ce facteur interagit avec des séquences promotrices spécifiques, appelées séquences CARE (C/EBP [CCAAT-enhancer-binding protein] - ATF [activating transcription factor] - responsive element), et est responsable de l’induction d’un programme d’expression de gènes cibles connu sous le nom de réponse intégrée au stress (ISR, integrated stress response) [4]. Ces gènes jouent un rôle clé dans les processus d’adaptation et de survie de la cellule au stress : ils codent des protéines impliquées, par exemple, dans l’autophagie, la biosynthèse et le transport des acides aminés, et la lutte contre le stress oxydant [5, 6]. |
La souris CARE-LUC, un outil pour visualiser l’activation de la voie eIF2α-ATF4 Afin de visualiser l’activation de la voie de signalisation eIF2α-ATF4 en réponse à un stress au niveau de l’animal entier, nous avons récemment généré une lignée de souris transgénique, appelée CARE-LUC, qui exprime le gène rapporteur luciférase (LUC) sous le contrôle de séquences CARE capables de fixer le facteur de transcription ATF4 (Figure 2A) [7]. La luciférase exprimée dans les différents tissus catalyse l’oxydation de la luciférine injectée à l’animal. La lumière émise lors de cette réaction est donc proportionnelle au niveau d’expression du gène luciférase. Sa détection permet ainsi de visualiser l’activation de la voie eIF2α-ATF4 en fonction des stress ou des situations physiopathologiques ou pathologiques au niveau (1) de l’animal entier vivant, par imagerie bioluminescente, (2) de chaque organe ou tissu, par imagerie bioluminescente et dosage enzymatique, et (3) de chaque cellule, par immuno-histochimie en utilisant un anticorps anti-luciférase.
 | Figure 2.
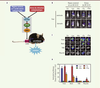
La lignée de souris transgénique CARE-LUC. A. La souris CARE-LUC possède un transgène stable, constitué de plusieurs sites de fixation d’ATF4 ( activating transcription factor 4) appelés séquences CARE ( C/EBP-ATF-responsive element), fusionnés au gène rapporteur de la luciférase (LUC). L’expression du gène LUC est induite lors de l’activation de la voie eIF2α-ATF4 par différents stress comme la carence en un acide aminé indispensable ou le stress du réticulum endoplasmique. B. Visualisation de la bioluminescence par imagerie de souris vivantes 6 h après avoir consommé un repas carencé en acide aminé (AA), lysine (Lys) ou alanine (Ala), ou après avoir été injectées avec des inducteurs du stress du réticulum endoplasmique (RE) comme la tunicamycine (Tu) ou la thapsigargine (Tha). Ctr : contrôle. C. Visualisation de la bioluminescence par imagerie dans le foie, le rein, le tissu adipeux brun (TAB) et le muscle gastrocnémien (situé au niveau du mollet), après sacrifice des souris. D. Dosage de l’activité luciférase dans les tissus. Les valeurs correspondent au taux d’induction par rapport au contrôle (Ctr) ; *P≤0.05 par rapport aux valeurs contrôles (d’après [ 7]). |
|
Le profil d’activation de la voie eIF2α-ATF4 dans les tissus est spécifique de l’inducteur La lignée transgénique CARE-LUC nous a permis de visualiser l’activation de la voie eIF2α-ATF4 soit par la kinase GCN2, lors d’un stress nutritionnel résultant de la consommation d’un régime carencé en un acide aminé indispensable comme la lysine, soit par la kinase PERK, lors d’un stress du réticulum endoplasmique consécutif à l’injection de drogues comme la tunicamycine2, (Tu) et la thapsigargine3, (Tha) (Figure 2B) [7]. Les résultats, obtenus par visualisation de la bioluminescence au niveau de l’abdomen des souris vivantes, confirment que la voie eIF2α-ATF4 est activée par ces inducteurs. En revanche, et comme nous nous y attendions, aucune activation n’est détectée suite à la consommation d’un repas carencé en alanine, un acide aminé non indispensable que l’organisme est capable de synthétiser. L’analyse de l’activité luciférase dans les différents tissus nous a ensuite permis de montrer que le profil d’activation de la voie eIF2α-ATF4 dépend de l’inducteur (Figure 2C, D). Si l’induction de cette voie est observée dans le foie lors d’une carence en un acide aminé indispensable (AAI) ou d’un stress du réticulum endoplasmique, elle dépend de l’inducteur dans certains tissus comme le rein, le tissu adipeux brun (TAB) et le muscle. Nous avons pu confirmer ces résultats en mesurant l’induction de l’expression, dans ces différents tissus, de gènes cibles de la voie eIF2α-ATF4, comme Trb3 (tribbles pseudokinase 3), Atf3 (activating transcription factor 3) ou Xpot (exportin, tRNA) [7]. Cette différence de profil d’activation ne peut pas s’expliquer par la présence, ou l’absence, des kinases GCN2 et PERK, car celles-ci sont toutes les deux exprimées dans ces tissus. Les mécanismes gouvernant la spécificité tissulaire de l’induction de la voie eIF2α-ATF4 restent donc encore à identifier. |
La voie eIF2α-ATF4 est activée dans un modèle de fibrose hépatique La voie eIF2α-ATF4 est activée dans un grand nombre de situations pathologiques comme la maladie d’Alzheimer, le développement tumoral, les néphropathies, l’infection bactérienne ou le diabète [8–10]. Cependant, le rôle de cette voie dans la progression ou la lutte contre ces pathologies demande à être mieux caractérisé. Nous avons réalisé une expérience de preuve de concept de l’utilisation de la lignée de souris CARE-LUC pour étudier l’activation de la voie eIF2α-ATF4 dans une situation pathologique, la fibrose hépatique [7]. Ce type de fibrose est une conséquence de lésions hépatiques chroniques qui se caractérise par l’accumulation anormalement élevée de constituants de la matrice extracellulaire dans le parenchyme hépatique. Nous avons démontré qu’il existe une corrélation entre l’apparition d’une fibrose hépatique induite chimiquement et l’activation de la voie eIF2α-ATF4 par la kinase PERK [7]. Des expériences d’immuno-histochimie nous ont aussi permis de mettre en évidence une induction des protéines à la fois de luciférase et du collagène-1 au niveau des hépatocytes. La souris CARE-LUC constitue ainsi un bon modèle in vivo pour suivre, dans l’espace et le temps, la modulation de la voie eIF2α-ATF4 au cours de l’évolution d’une pathologie. |
Conclusions et perspectives La voie eIF2α-ATF4 est connue pour son implication dans l’adaptation et la survie cellulaire en réponse à différents types de stress. Cependant le rôle de cette voie et des kinases qui la contrôlent, dans le développement ou l’adaptation à différentes situations physiopathologiques, est complexe et reste encore mal connu. Nos résultats démontrent que la souris CARE-LUC constitue un bon outil pour mieux comprendre la spécificité tissulaire d’induction et la fonction de cette voie. Si l’on envisage d’utiliser la voie eIF2α-ATF4 comme cible thérapeutique, la souris CARE-LUC pourra également permettre de tester l’efficacité de nouvelles drogues pharmacologiques capables de moduler son activation. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ces travaux ont été soutenus par des financements de l’Agence Nationale de la Recherche (ANR-12-EMMA-0024, ANR-12-BSV2-0025-03) et de l’INRA (ANSSD AlimH).
|
Footnotes |
1.
Donnelly N, Gorman AM, Gupta S, Samali A. The eIF2alpha kinases: their structures and functions . Cell Mol Life Sci. 2013; ; 70 : :3493.–3511. 2.
Holcik M, Sonenberg N. Translational control in stress and apoptosis . Nat Rev Mol Cell Biol. 2005; ; 6 : :318.–327. 3.
Harding HP, Novoa II, Zhang Y, et al. Regulated translation initiation controls stress-induced gene expression in mammalian cells . Mol Cell. 2000; ; 6 : :1099.–1108. 4.
Kilberg MS, Shan J, Su N. ATF4-dependent transcription mediates signaling of amino acid limitation . Trends Endocrinol Metab. 2009; ; 20 : :436.–443. 5.
Harding HP, Zhang Y, Zeng H, et al. An integrated stress response regulates amino acid metabolism and resistance to oxidative stress . Mol Cell. 2003; ; 11 : :619.–633. 6.
B’Chir W, Maurin AC, Carraro V, et al. The eIF2alpha/ATF4 pathway is essential for stress-induced autophagy gene expression . Nucleic Acids Res. 2013; ; 41 : :7683.–7699. 7.
Chaveroux C, Carraro V, Canaple L, et al. In vivo imaging of the spatiotemporal activity of the eIF2alpha-ATF4 signaling pathway: Insights into stress and related disorders . Sci Signal. 2015; ; 8 : :rs5.. 8.
Baird TD, Wek RC. Eukaryotic initiation factor 2 phosphorylation and translational control in metabolism . Adv Nutr. 2012; ; 3 : :307.–321. 9.
Tattoli I, Sorbara MT, Vuckovic D, et al. Amino acid starvation induced by invasive bacterial pathogens triggers an innate host defense program . Cell Host Microbe. 2012; ; 11 : :563.–575. 10.
Ohno M. Roles of eIF2alpha kinases in the pathogenesis of Alzheimer’s disease . Front Mol Neurosci. 2014; ; 7 : :22.. |