| |
| Med Sci (Paris). 2015 December; 31(12): 1069–1071. Published online 2015 December 16. doi: 10.1051/medsci/20153112007.Tous les hépatocytes ne sont pas égaux entre eux ! Laurent Dollé1* and Hélène Gilgenkrantz2** 1Laboratory of liver cell biology, department of biomedical sciences, faculty of medicine and pharmacy, Vrije Universiteit Brussel (VUB), Bruxelles, Belgique 2Institut Cochin, Inserm U1016, CNRS UMR 8104, université Paris-Descartes, 24, rue du faubourg Saint-Jacques, 75005Paris, France MeSH keywords: Animaux, Axine, Hépatocytes, Humains, Foie, Taille d'organe, physiologie, cytologie, croissance et développement |
Paradoxe des études sur la régénération du foie Le foie des mammifères est organisé en lobules fonctionnels limités d’un côté par une veine centrale et de l’autre par une veine porte (Figure 1). Il est doté de pouvoirs régénératifs remarquables, indispensables au maintien de sa masse et à son bon fonctionnement. Ce processus observé ad libitum annonçait la quête du Graal pour un concept légendaire [1] ! Afin d’élucider les mécanismes qui concourent à ce don de régénération, les scientifiques ont développé des astuces techniques permettant d’induire artificiellement des lésions hépatiques chez le rongeur. Néanmoins, alors que d’innombrables études illustraient la capacité de différents types cellulaires à reconstituer le parenchyme hépatique, moins juteuse fut la découverte de la vraie nature de ce compartiment [2, 3]. Pour faire simple, jusqu’à présent, deux théories s’affrontaient : l’idée qu’un pool de cellules souches approvisionne le foie en hépatocytes fonctionnels, par maturation de leur descendance suivant l’axe porto-central de la travée hépatocytaire, s’opposant au concept que la régénération résulte uniquement de la dédifférenciation et/ou de la division d’hépatocytes adultes, sans intervention d’une cellule souche résiduelle chez l’adulte [4]. Si les dernières publications semblaient plutôt en faveur de cette dernière hypothèse, il faut admettre que la vue d’ensemble restait encore nébuleuse [2–6] !
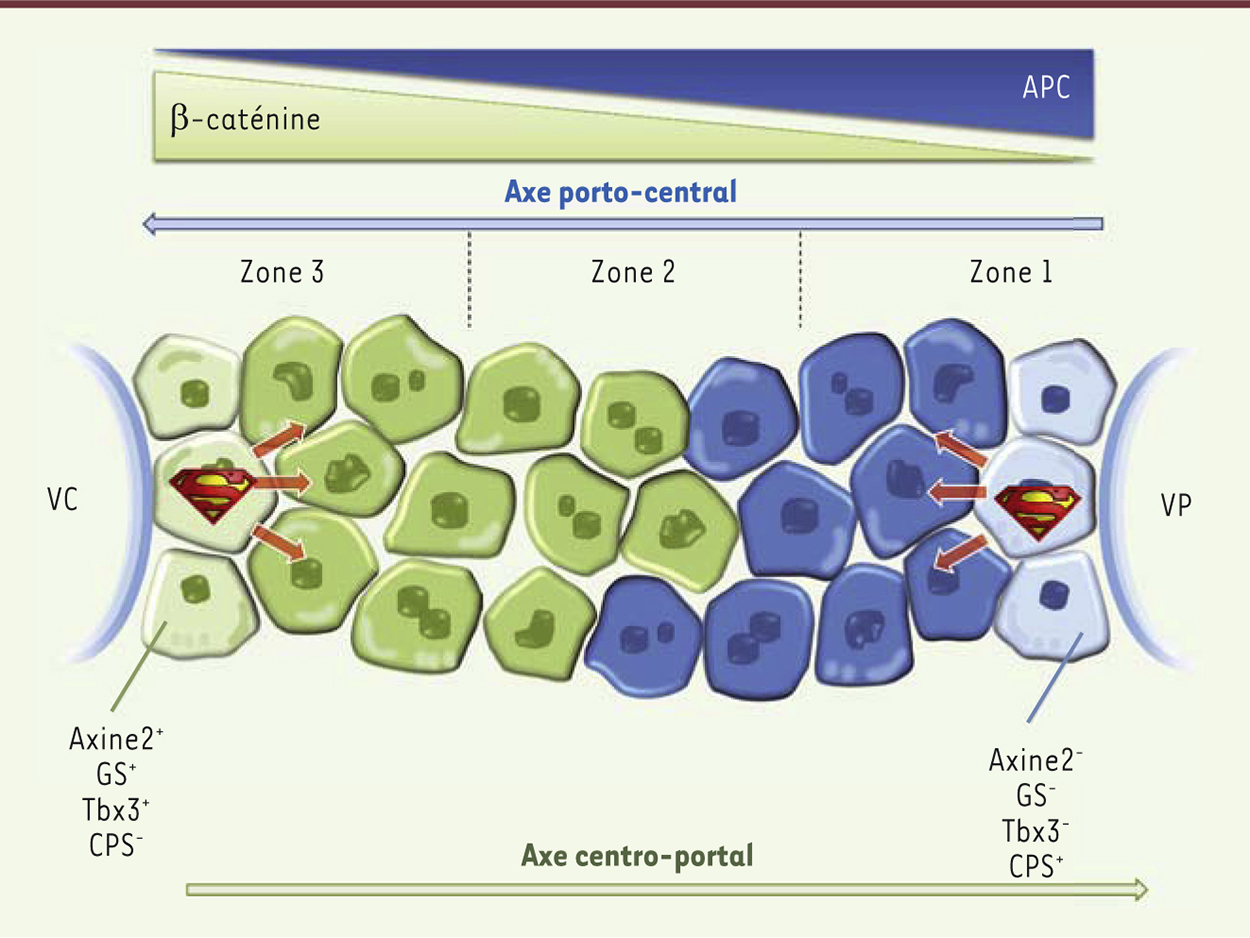
 | Figure 1.
Deux super-héros pour alimenter le renouvellement hépatique physiologique ? Le foie est composé de lobules fonctionnels. Un lobule est schématiquement représenté ici avec, à un pôle, la veine centrale (VC) et à l’autre, la veine porte (VP). Les hépatocytes n’assurent pas les mêmes fonctions, notamment métaboliques, selon leur position péricentrale (zone 3) ou périportale (zone 1). Cette zonation du foie est notamment assurée par un gradient opposé des gènes β-caténine et APC (adenomatous polyposis coli). En condition d’homéostasie normale du foie, une nouvelle sous-population d’hépatocytes jouxtant la veine centrale et dotée de superpouvoirs régénératifs vient d’être mise en évidence (vert clair). Ces cellules expriment Tbx3 (T-box 3), axine-2 et GS (glutamine synthase) mais pas CPS (carbamoyl-phosphate synthétase) et elles sont diploïdes. La descendance de cette sous-population se différencie selon l’axe centro-portal et perd l’expression de ces gènes (hépatocytes en vert plus foncé). Dans certaines conditions d’agression hépatique, ont été mises en évidence des cellules périportales (hépatocytes bleu-clair) capables de se différencier en hépatocytes le long de l’axe porto-central (hépatocytes bleu foncé). Il n’est cependant pas démontré que ces cellules aient également la capacité d’assurer le renouvellement du foie normal en conditions physiologiques. |
|
L’hépatocyte perdure comme héros de l’homéostasie hépatique ! En raison d’une complexité initialement insoupçonnée (dans leur utilisation et leur nature), les modèles animaux ne sont plus aujourd’hui unanimement considérés comme pertinents dans la quête de l’identité des cellules souches [1]. En effet, très peu de ces modèles reproduisent l’étiologie, l’histoire naturelle et la progression des maladies hépatiques humaines. Par conséquent, conjecturales sont les conclusions apportées sur l’existence même de ces cellules souches chez l’homme ou sur leur potentielle utilité clinique. La tendance, pour disséquer cette capacité mythique, est donc de revenir sur un ancien concept : utiliser l’homéostasie d’un foie normal, c’est-à-dire sa capacité à remplacer au fur et à mesure ces hépatocytes mourants par des cellules résidentes matures. Dans ces conditions de renouvellement, le foie utilise une entité cellulaire différenciée et pourtant dotée d’une capacité réplicative non-négligeable, l’hépatocyte, héros de la régénération [4]. Mais tous les hépatocytes sont-ils égaux entre eux, en d’autres termes, n’existe-t-il pas des hépatocytes plus égaux que d’autres pour remplir cette fonction ? |
Les vertus de « super héros » de l’hépatocyte axine-2 +Une nouvelle étude publiée par l’université de Stanford dans la revue Nature s’attaque à cette question et distingue, parmi les hépatocytes, une catégorie de cellules épithéliales, localisées à proximité immédiate de la veine centrale, capables d’endosser le costume du super-héros pour assurer l’homéostasie hépatique [7] (Figure 1). L’utilisation d’une technique de lignage moléculaire, permettant le marquage définitif par la GFP (green fluorescent protein) de cellules exprimant l’axine-2 au début de l’analyse, révèle en effet la présence d’une rangée d’hépatocytes fluorescents bordant la veine centrale [7]. Ces cellules se distinguent de la plupart des autres hépatocytes par l’expression du facteur de transcription Tbx3 (T-box 3), important dans le maintien de la pluripotence, et leur caractère diploïde, souvent associé à une capacité proliférative supérieure à celle des autres hépatocytes qui sont majoritairement polyploïdes. Au cours du renouvellement homéostatique, la descendance de ces cellules fluorescentes se différencie très rapidement en hépatocytes dépourvus d’axine-2 et de Tbx3, évoluant vers la polyploïdie et surtout, capables de remplacer les hépatocytes suivant l’axe centro-portal de la travée hépatocytaire. Nous sommes donc à l’opposé de la théorie de cellules souches périportales avec maturation suivant l’axe porto-central ! En un an, ces cellules reconstituent jusqu’à 30 % de la masse hépatocytaire [7]. De façon remarquable, ces hépatocytes axine-2+ ne sont jamais remplacés par des hépatocytes axine-2- provenant de la région portale, et ne donnent jamais naissance aux cellules biliaires. Par différentes approches de lignage in vitro et in vivo, les auteurs montrent que ces hépatocytes axine-2+ prolifèrent deux fois plus vite que les autres. Ils sont donc unipotents, s’auto-renouvellent et, de façon inattendue, rénovent la travée hépatocytaire à « contre-courant ». Si les auteurs collent, un peu rapidement, à ces hépatocytes axine2+, l’étiquette de cellules souches, ils remettent en tout cas totalement en question la localisation spatiale des cellules progénitrices et confirment la plasticité remarquable de ces cellules [2–4] ! |
Quelle est la mécanistique sous-jacente à l’existence de ce super-héros ? En suivant leurs descendants pendant un an, les scientifiques ont découvert que ces cellules acquièrent différents profils d’expression de gènes en fonction de leur position dans le lobule : en s’éloignant de la veine centrale, elles perdent l’expression de la glutamine synthase (GS) et de l’axine-2 et gagnent celle de la carbamoyl-phosphate synthétase (CPS) [7]. On retrouve donc ici le concept, connu de longue date, de zonation du foie, qui veut que les hépatocytes assurent une fonction différente (et donc expriment des gènes différents) en fonction de la zone qu’ils occupent dans le lobule hépatique. La zonation hépatique est contrôlée par la voie Wnt et plus particulièrement par l’existence de deux gradients d’expression opposés des gènes APC (adenomatous polyposis coli) et β-caténine le long de l’axe porto-central [8]. Ainsi, la β-caténine, stimulée par la voie Wnt, détermine l’identité centro-lobulaire des hépatocytes dans lesquels le gène APC est réprimé. À l’opposé, la β-caténine est réprimée dans les hépatocytes périportaux, dans lesquels le gène APC est actif (Figure 1). Or, le gène codant l’axine-2 est une cible directe connue de la β-caténine. En raison de leur structure moléculaire, les ligands Wnt sont contraints d’agir sur de courtes distances [9]. Il est montré que les cellules endothéliales des veines centrales fournissent les signaux Wnt (Wnt2 et Wnt9a) nécessaires au maintien de la plasticité des hépatocytes axine-2+, constituant ainsi une niche distincte de la région portale puisque ces signaux n’y sont pas présents [7]. Lorsque les descendants de ces hépatocytes axine-2+ migrent en dehors de la zone d’action des signaux Wnt, ils perdent alors rapidement leur superpouvoir de division et acquièrent des caractéristiques d’hépatocytes matures plus classiques. |
Un scénario digne d’Avengers 1 ? Peut-on concilier ces résultats avec l’existence d’un autre super-héros qui serait périportal ? Une possibilité serait que, à chaque pôle du lobule, siège un type cellulaire ayant un avantage prolifératif lui permettant de renouveler simplement sa région lobulaire. De fait, au cours pratiquement d’une vie de souris (1 an), seuls 30 % du foie sont reconstitués à partir des hépatocytes axine-2+. Qui renouvelle la partie périportale dans cette homéostasie hépatique normale ? Une sous-population d’hépatocytes périportaux, présentant des capacités remarquables de repeuplement du foie après agression hépatique, vient d’être mise en évidence [10]. Sont-ils également à l’œuvre en conditions de renouvellement normal ? La capacité à tirer profit de plusieurs sources cellulaires localisées à des endroits distincts du lobule pourrait être une stratégie évolutive favorable, permettant une flexibilité dans la réponse régénérative à des agressions hépatiques différentes. Dans ce cas de figure, même si les modèles développés chez les rongeurs ne sont pas parfaits, il serait intéressant de connaître la contribution de chaque super-héros face à des dommages spécifiques situés en zone portale ou centrale. Le foie est doté d’une plasticité métabolique remarquable, définie par une distribution hétérogène des fonctions métaboliques, déterminées elles-mêmes par la position des hépatocytes sur l’axe porto-central [8, 11–13]. Même s’il est désormais admis que l’hépatocyte est une cellule plastique et dédifférenciable à façon [4], l’existence de 2 niches aurait donc une certaine pertinence dans la préservation de cette gymnastique métabolique. Dans ce scénario, il serait intéressant de permuter la zonation hépatique en jouant sur le sens du flux sanguin, afin d’observer si ces niches dédiées à ces 2 super-héros peuvent être interverties, en d’autres termes déclarer la guerre des Avengers ! Déjà deux types de super-héros ! Combien de temps avant que la liste ne s’allonge ? L’hépatocyte péribiliaire pourrait constituer d’ores et déjà un troisième type cellulaire à part [14, 15]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Laurent Dollé reçoit un financement d’Interuniversity Attraction Poles (IAP) – phase VII – contract P7/47 (Federal Science Policy – BELSPO).
|
Footnotes |
1.
Dollé L, Best J, Mei J, et al. The quest for liver progenitor cells: a practical point of view . J Hepatol. 2010; ; 52 : :117.–129. 2.
Itoh T, Miyajima A. Liver regeneration by stem/progenitor cells . Hepatology. 2014; ; 59 : :1617.–1626. 3.
Miyajima A, Tanaka M, Itoh T. Stem/progenitor cells in liver development, homeostasis, regeneration, and reprogramming . Cell Stem Cell. 2014; ; 14 : :561.–574. 4.
Gilgenkrantz H. Une seule cellule souche dans le foie : l’hépatocyte ! . Med Sci (Paris). 2015; ; 31 : :357.–359. 5.
Lemaigre FP. Determining the fate of hepatic cells by lineage tracing: facts and pitfalls . Hepatology. 2015; ; 61 : :2100.–2103. 6.
Reid LM. Paradoxes in studies of liver regeneration: relevance of the parable of the blind men and the elephant . Hepatology. 2015; ; 62 : :330.–333. 7.
Wang B, Zhao L, Fish M, et al. Self-renewing diploid Axin2+ cells fuel homeostatic renewal of the liver . Nature. 2015; ; 524 : :180.–185. 8.
Benhamouche S, Decaens T, Perret C, Colnot S. Voie Wnt/β-caténine et zonation métabolique du foie : un nouvel acteur pour un ancien concept . Med Sci (Paris). 2006; ; 22 : :904.–906. 9.
Clevers H, Loh KM, Nusse R. Stem cell signaling. An integral program for tissue renewal and regeneration: Wnt signaling and stem cell control . Science. 2014; ; 346 : :1248012.. 10.
Font-Burgada J, Shalapour S, Ramaswamy S, et al. Hybrid periportal hepatocytes regenerate the injured liver without giving rise to cancer . Cell. 2015; ; 162 : :766.–779. 11.
Gebhardt R. Metabolic zonation of the liver: regulation and implications for liver function . Pharmacol Ther. 1992; ; 53 : :275.–354. 12.
Jungermann K, Kietzmann T. Zonation of parenchymal and nonparenchymal metabolism in liver . Annu Rev Nutr. 1996; ; 16 : :179.–203. 13.
Gebhardt R, Hovhannisyan A. Organ patterning in the adult stage: the role of Wnt/beta-catenin signaling in liver zonation and beyond . Dev Dyn. 2010; ; 239 : :45.–55. 14.
Theise ND, Dollé L, Kuwahara R. Low hepatocyte repopulation from stem cells: a matter of hepatobiliary linkage not massive production . Gastroenterology. 2013; ; 145 : :253.–254. 15.
Lu WY, Bird TG, Boulter L, et al. Hepatic progenitor cells of biliary origin with liver repopulation capacity . Nat Cell Biol. 2015; ; 17 : :971.–983. |