Considérant l’expression spécifique de CYR61/CCN1, cantonnée au stroma thymique [4], et ses propriétés prolifératives [3], nous avons décidé d’étudier les bénéfices d’un traitement utilisant CYR61 sur l’intégrité du stroma thymique et le développement des lymphocytes T.
Nous avons tout d’abord identifié les TEC comme la principale source de CYR61 dans le thymus de souris. Des études in vitro ont été menées pour comprendre quelle pouvait être l’action de la protéine CYR61 sur le stroma thymique, et en particulier sur les TEC. Pour cela, des lobes de thymus fœtaux de souris dépourvus de thymocytes (2DG-FTOC1,) ont été traités avec de la protéine recombinante CYR61, avec pour conséquence d’augmenter fortement la taille du stroma. Cette augmentation a été causée par une élévation du nombre de TEC, sans changement de leur degré de différentiation/maturation ni du nombre des autres cellules stromales. Afin de tester si l’action de la protéine CYR61 sur les TEC est directe, ou bien si elle résulte de l’activation d’un autre type cellulaire présent dans le stroma, tels les macrophages ou cellules dendritiques, nous avons traité une lignée pure de cellules épithéliales thymiques appelée IT76M12. La protéine CYR61 a stimulé la prolifération de ces cellules, ce qui a démontré une action directe de CYR61 sur les TEC. Des analyses complémentaires ont montré que la protéine CYR61 se fixe sur l’intégrine α6, activant la voie de signalisation Akt. L’utilisation de MK2206, inhibiteur d’Akt, et d’anticorps bloquant l’intégrine α6, a ainsi permis de supprimer l’action de CYR61 sur les TEC.
Nous nous sommes ensuite intéressés à la possibilité de stimuler in vivo les fonctions thymiques, notamment la production de lymphocytes T, au moyen de CYR61. Nous avons induit la surexpression de la protéine CYR61 dans les cellules du stroma thymique en infectant des lobes de thymus fœtaux de souris dépourvus de thymocytes (2DG-FTOC) par un vecteur d’expression lentiviral3 CYR61. Les lobes ainsi transduits ont vu leur niveau de protéine CYR61 augmenter d’environ 4 fois. Pour le groupe contrôle, nous avons utilisé des lobes transduits avec un vecteur vide, qui n’a pas modifié les taux de protéine CYR61. Ces lobes, surexprimant CYR61 ou contrôles, ont ensuite été greffés sous la capsule rénale de souris dépourvues de système immunitaire (souris nude). La particularité des souris nude est l’absence d’un thymus fonctionnel, et donc de lymphocytes T, suite à une mutation dans le gène du facteur de transcription FoxN1, essentiel au développement des TEC [5]. Les progéniteurs hématopoïétiques étant normaux chez les souris nude, la transplantation de lobes thymiques contrôles restaure une production normale de lymphocytes T [6]. La production de lymphocytes T est également rétablie chez les souris nude transplantées avec des lobes surexprimant CYR61. En revanche, les niveaux de lymphocytes T en circulation dans le sang ont été doublés comparés à ceux des souris greffées contrôles. Il est important de souligner que les animaux ainsi greffés présentaient un répertoire T normal sans aucun signe d’auto-immunité ni anomalie anatomo-pathologique (Figure 1).
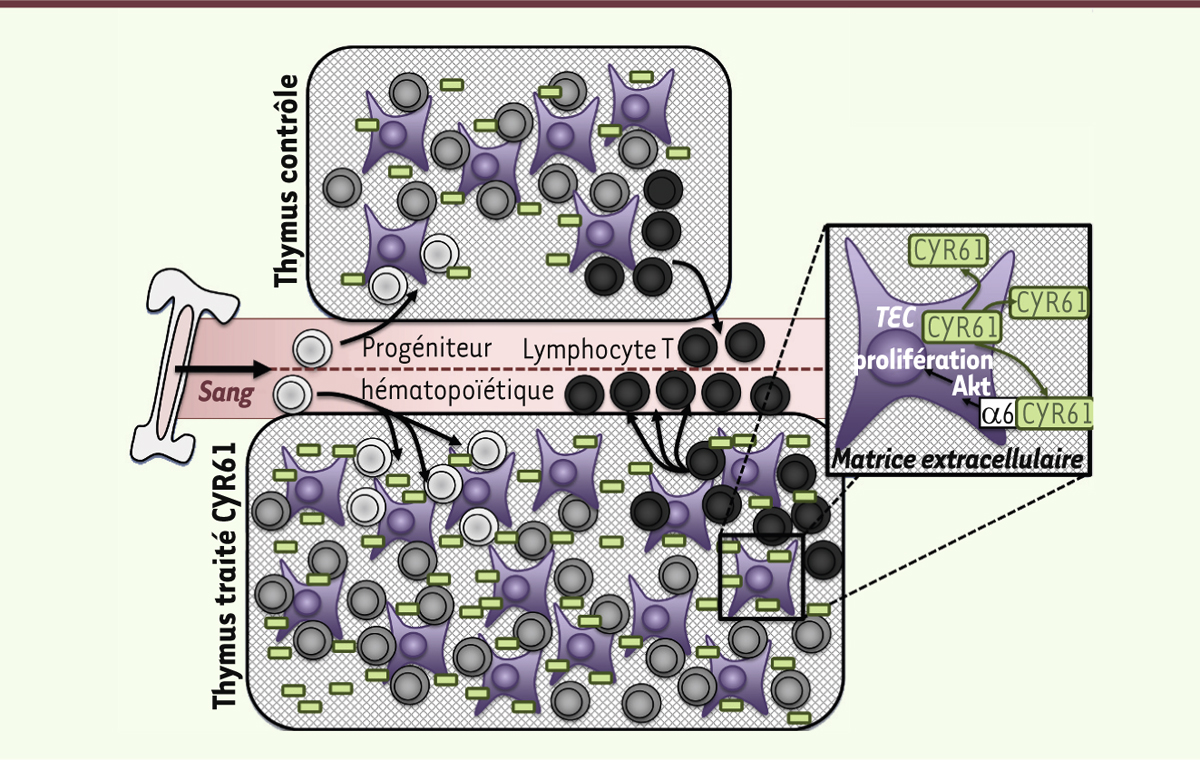
 | Figure 1.
L’expansion du stroma thymique induite par CYR61 augmente la production de lymphocytes. Les TEC (en violet) sont la source principale de production de CYR61/CCN1 dans le thymus. L’expansion du stroma induite par CYR61/CCN1 augmente l’espace disponible pour le recrutement des cellules souches hématopoïétiques (en gris) et par conséquent pour le développement de lymphocytes T (en noir) [ 7]. |
Deux hypothèses pouvaient expliquer cette augmentation de la production de lymphocytes T. Une possibilité était une action directe de CYR61 sur le développement des thymocytes4. La seconde possibilité était que l’hypertrophie thymique, induite par CYR61, augmente la capacité des lobes à héberger des progéniteurs issus de la circulation et, par conséquent, favorise indirectement le développement des thymocytes.
Nous avons testé l’effet direct de CYR61 sur le développement des thymocytes dans des cultures de lobes de thymus fœtaux (FTOC, fetal thymus organ culture). Les lobes sont composés d’un stroma complet et d’un nombre déterminé de précurseurs thymiques qui se différencient au cours du temps. Bien que le traitement par CYR61, pendant 2 ou 6 jours, ait augmenté le nombre de TEC, la fréquence et le nombre de thymocytes en développement n’ont pas été affectés. De plus, la présence de CYR61 lors de tests de prolifération des lymphocytes n’a affecté ni la prolifération ni la survie des cellules. Ces données nous ont permis d’exclure une action directe de CYR61 sur le développement des thymocytes.
Nous avons alors testé la seconde hypothèse : la capacité des lobes à recruter des progéniteurs circulants. Pour cela, nous avons transplanté des lobes surexprimant CYR61 sous la capsule rénale d’un rein, et des lobes contrôles sous l’autre capsule rénale, chez une même souris. Trois semaines plus tard, les souris ont été injectées avec des cellules de moelle osseuse (contenant des progéniteurs hématopoïétiques). Après 48 heures, le nombre de cellules recrutées dans les greffons a été quantifié, montrant que la capacité de mobilisation des lobes surexprimant CYR61 était sensiblement augmentée comparée aux greffons contrôles.
Cette différence de recrutement des progéniteurs pouvait être la conséquence d’un phénomène passif (simple augmentation de l’espace disponible dans le thymus) ou actif (lié à une augmentation de production de facteurs de croissance/chimiokines). Le recrutement des progéniteurs est dépendant de facteurs et de molécules d’adhésion tels que l’IL7 (interleukine 7), CCL25 (chemokine [C-C motif] ligand 25), FGF7 (fibroblast growth factor 7) ou P-sélectine. Nos analyses n’ont pas montré de différence entre les lobes surexprimant CYR61 et les lobes contrôles concernant l’expression de ces molécules. Par conséquent, nous avons pu conclure que le recrutement accru de progéniteurs résulte uniquement d’une augmentation de l’espace disponible et non d’une production élevée de facteurs de développement.