| |
| Med Sci (Paris). 2016 March; 32(3): 236–238. Published online 2016 March 23. doi: 10.1051/medsci/20163203003.La mémoire virtuelle des lymphocytes T cytotoxiques Valérie Martinet1 and Stanislas Goriely1* 1Institute for medical immunology (IMI), 8, rue A. Bolland, CP305, Université Libre de Bruxelles, 6041Gosselies, Belgique MeSH keywords: Animaux, Lymphocytes T CD8+, Humains, Mémoire immunologique, Activation des lymphocytes, Lymphocytes T cytotoxiques, immunologie |
Différenciation des lymphocytes T CD8 + en cellules mémoires : la voie classique et les voies alternatives Les lymphocytes T CD8+ sont des acteurs importants de la réponse immunitaire contre les pathogènes intracellulaires tels que les virus ou certaines bactéries. Ils sont également impliqués dans le contrôle de l’élimination des cellules tumorales. Lors d’une infection ou d’une vaccination, les cellules du système immunitaire inné (comme les cellules dendritiques) captent les antigènes et les présentent à des lymphocytes « naïfs ». Grâce aux signaux qu’ils reçoivent, les cellules capables de reconnaître un antigène spécifique prolifèrent fortement et aquièrent des fonctions effectrices permettant l’élimination du pathogène. Ces cellules vont reconnaître et lyser les cellules infectées grâce à l’expression de molécules cytotoxiques, ainsi qu’à la production de cytokines telles que l’interféron-γ (IFNγ). La plupart des cellules activées subissent une différenciation terminale et seront éliminées lors de la phase dite de contraction de la réponse. À l’issue de celle-ci, ne subsistera qu’une petite population de cellules dites « mémoires » [1] (→).
(→) Voir la Synthèse de T. Walzer, m/s n° 11, novembre 2001, page 1105
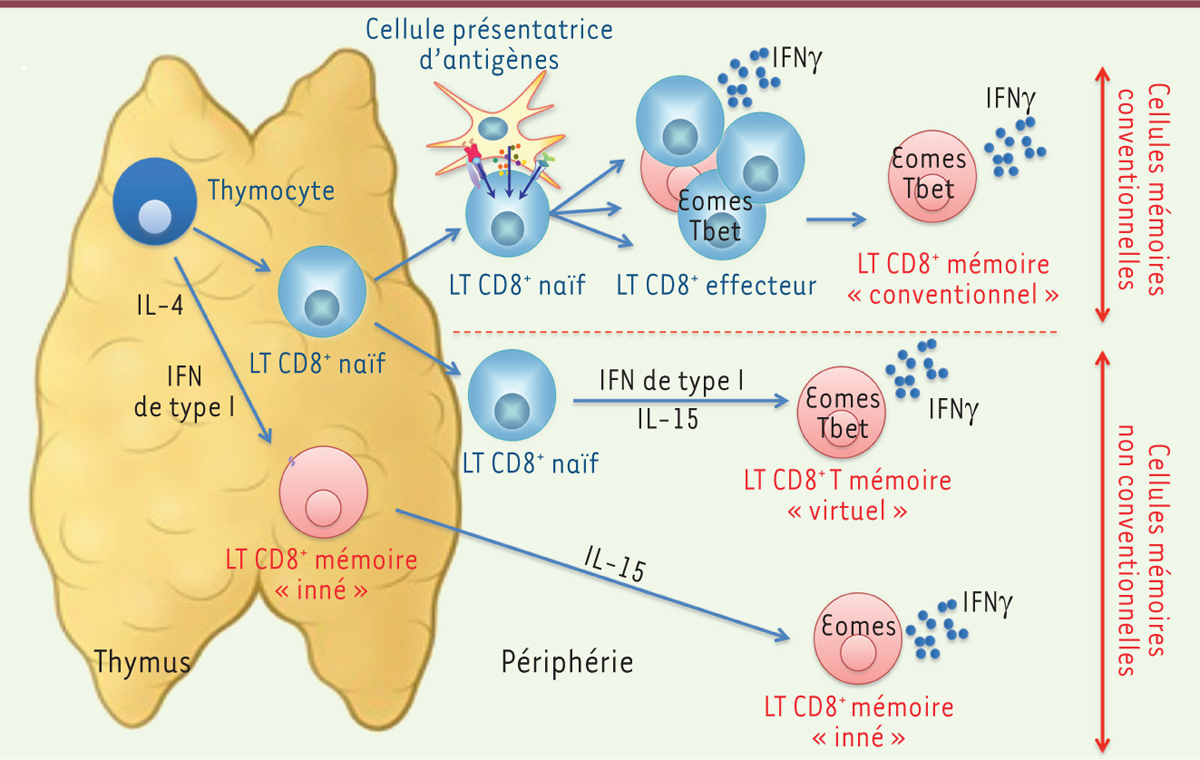
La persistance de ces cellules dépend de leur capacité à répondre à des cytokines prolifératives comme l’interleukine (IL)-7 et l’IL-15, ainsi qu’au maintien de l’expression de molécules anti-apoptotiques comme Bcl2 (B-cell lymphoma 2). En répondant plus efficacement et plus rapidement lors d’un nouveau contact avec le même antigène, les cellules mémoires confèrent à l’organisme une protection à long-terme face à des infections ultérieures. On sait depuis plusieurs années que des lymphocytes T CD8+ naïfs peuvent également acquérir le phénotype et la fonction de cellules mémoires en l’absence de contact et de reconnaissance antigénique [2]. En effet, dans des conditions de lymphopénie (comme lors de transfert de lymphocytes T CD8+ naïfs dans des hôtes immunodéficients ou irradiés), les fortes concentrations de cytokines prolifératives poussent les lymphocytes T CD8+ naïfs à acquérir le phénotype et les propriétés des cellules mémoires (phénomène qualifié de mémoire par « prolifération homéostatique »). Des études récentes réalisées chez l’animal montrent que ces lymphocytes T CD8+ mémoires « non conventionnels » apparaissent également dans des conditions physiologiques et qu’ils constituent une partie importante du pool de cellules mémoires (Figure 1). En effet, l’étude des sous-populations de lymphocytes T CD8+ dans des souris élevées en l’absence de pathogène et qui n’ont jamais été immunisées, montre que 10 à 30 % des ces cellules présentent un phénotype mémoire. Cette population, appelée « mémoire virtuelle », augmente fortement avec l’âge [3]. On considérait jusqu’à présent que l’apparition de cette population résultait de l’activation et de la formation de cellules mémoires en réponse à des antigènes de la flore microbienne. Cependant, des études récentes montrent que cette population de cellules mémoires apparaît également dans des animaux élevés en conditions axéniques (c’est-à-dire en l’absence complète de germes) ainsi que dans divers modèles transgéniques. Cette population mémoire « virtuelle » partage la plupart des caractéristiques phénotypiques des lymphocytes T CD8+ mémoires centraux. Cependant, elles sont caractérisées par une faible expression de CD49d, une sous-unité de l’intégrine alpha (intégrine α4), qui permet de les différencier des lymphocytes T CD8+ mémoires « conventionnels ». En plus de cette conversion périphérique de cellules naïves en cellules mémoires, une proportion plus ou moins importante de lymphocytes T CD8+ peut acquérir, très tôt au cours du développement intrathymique, un phénotype mémoire (cellules « innées thymiques »,
Figure 1
) [4].
 | Figure 1.
La mémoire conventionnelle, virtuelle ou innée des lymphocytes T cytotoxiques. Il existe plusieurs voies de différenciation menant à l’acquisition d’un phénotype mémoire. La mémoire « conventionnelle » apparaît après stimulation antigénique. Les lymphocytes T CD8+ peuvent également acquérir un phénotype de cellules mémoires lors de leur différenciation intra-thymique ou en périphérie sous l’effet de cytokines telles que les interférons (IFN) de type I. Cet état de différenciation dépend de l’expression d’Eomes, un facteur de transcription apparenté à T-bet. Le taux d’expression de ces deux facteurs varie en fonction de la voie de différenciation et conditionne la fonction des cellules mémoires. IFN : interféron ; IL : interleukine ; LT : lymphocyte T. |
|
Par quels mécanismes un lymphocyte T CD8 + naïf acquiert-il des fonctions de cellule mémoire ? Le programme transcriptionnel impliqué dans ces processus de différenciation alternative reste mal compris. Eomesodermin (Eomes), un facteur de transcription de la famille T-box (apparenté à T-bet [T-box expressed in T-cells]), semble jouer un rôle central dans l’acquisition du phénotype mémoire et dans la fonction de ces cellules [5]. Lors d’une activation antigénique classique, Eomes contribue à l’acquisition des fonctions effectrices ainsi qu’à la différenciation à long terme des lymphocytes T CD8+, en favorisant le développement de cellules mémoires centrales [6]. L’expression d’Eomes au sein des thymocytes est nécessaire au développement des lymphocytes T CD8+ innés thymiques. Ces cellules se développent suite à l’induction d’Eomes par les thymocytes CD8 SP (single-positive) en réponse à l’IL-4 produite en grande quantité dans certaines souches de souris [4]. Le développement des lymphocytes T CD8+ mémoires virtuels en périphérie dépend également de l’expression d’Eomes [7]. Une cible importante de ce facteur de transcription est le gène codant une des chaînes du récepteur de l’IL-15 (la molécule CD122 ou IL-2Rβ, partagée avec le récepteur de l’IL-2) [5]. Eomes permet ainsi à ces cellules de répondre efficacement à cette cytokine qui joue un rôle crucial dans le maintien des cellules mémoires en général, et en particulier des lymphocytes T CD8+ mémoires virtuels. Cependant, malgré le rôle crucial d’Eomes dans ce contexte, les signaux responsables de son induction et du maintien de son expression ne sont pas clairement établis. |
Les interférons de type I contribuent à l’acquisition de la mémoire non-conventionnelle des lymphocytes T CD8 +Lors d’une infection, les cellules présentatrices d’antigènes, comme les monocytes inflammatoires, les macrophages ou les cellules dendritiques, produisent des cytokines qui vont agir de façon directe ou indirecte pour influencer les fonctions et l’homéostasie des lymphocytes T CD8+. Parmi ces médiateurs, les interférons (IFN) de type I1 (qui regroupent les IFNα et β) sont bien connus pour leurs fonctions anti-virales. Ces cytokines présentent également des propriétés immunomodulatrices importantes. Nous avons récemment observé que les IFN de type I activent directement l’expression d’Eomes dans les lymphocytes T CD8+ naïfs et mémoires ainsi que dans les thymocytes [8]. La liaison des IFN de type I à leur récepteur conduit à la formation d’un complexe multimérique qui se lie directement à la région promotrice d’Eomes. Nous avons montré que, par ce mécanisme, les IFN de type I favorisent l’expansion des lymphocytes T CD8+ mémoires non conventionnels tant en périphérie (lymphocytes T CD8+ mémoires virtuels) que dans le thymus (lymphocytes T CD8+ innés thymiques). Nos travaux indiquent de plus que la signalisation des IFN de type I au sein des lymphocytes T CD8+ est nécessaire pour l’accumulation avec l’âge des cellules mémoires virtuelles ainsi que pour leur fonction. Cet axe IFN de type I/Eomes ne semble pas requis pour la formation de cellules mémoires conventionnelles, ce qui suggère des voies de régulation indépendantes. Notre équipe tente à présent de définir les mécanismes épigénétiques possiblement impliqués dans cette conversion en cellules mémoires sous l’effet d’Eomes. |
Le rôle de ces cellules mémoires « non conventionnelles » et leur contribution à la réponse immunitaire (protectrice ou pathologique) ne sont pas encore clairs. Comparés aux cellules naïves, les lymphocytes de mémoire virtuelle répondent plus rapidement et plus efficacement à une stimulation antigénique. En revanche, cette capacité est réduite par rapport à celle des lymphocytes T de mémoire conventionnelle. À côté de leur rôle important dans la réponse adaptative, les cellules mémoires, qu’elles soient conventionnelles ou non conventionnelles, peuvent être activées par des cytokines inflammatoires, acquérir des fonctions cytotoxiques et produire de larges quantités d’IFNγ [9]. Elles contribuent ainsi à la première ligne de défense de l’organisme au même titre que d’autres sous-populations lymphoïdes dites « innées », comme les cellules NK (natural killer) ou les lymphocytes T γδ. Elles pourraient participer également aux réponses immunitaires en début et en fin de vie, deux périodes de susceptibilité accrue aux infections. L’existence de ces cellules non conventionnelles chez l’homme n’est pas encore formellement démontrée, mais plusieurs études ont mis en évidence une population de lymphocytes T CD8+ de phénotype mémoire dans les rates et le sang de cordon de fœtus humains [10]. Une sous-population de cellules mémoires, exprimant fortement Eomes et les marqueurs de cellules NK, KIR (Killer cell Ig-like receptor) et NKG2A (aussi appelé KLRC1, killer cell lectine-like receptor C1), s’observe également dans le sang de cordon d’enfants nés à terme ainsi que dans du sang d’adulte [11]. Ces observations suggèrent donc la présence de lymphocytes T CD8+ mémoires innés chez l’homme. Il sera intéressant d’identifier des marqueurs permettant de caractériser avec certitude ces populations de lymphocytes T mémoires non conventionnels chez l’homme, ainsi que de déterminer leur origine et leurs fonctions, afin d’évaluer leur rôle dans des contextes cliniques. |
Les auteurs déclarent n’avoir aucun conflit d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Walzer T, Arpin C, Belœil L, Marvel J. Phénotype et fonctions des lymphocytes T CD8+ mémoire . Med Sci (Paris). 2001; ; 17 : :1105.–1111. 2.
Haluszczak C, Akue AD, Hamilton SE, et al. The antigen-specific CD8+ T cell repertoire in unimmunized mice includes memory phenotype cells bearing markers of homeostatic expansion . J Exp Med. 2009; ; 206 : :435.–448. 3.
Chiu BC, Martin BE, Stolberg VR, Chensue SW. Cutting edge: central memory CD8 T cells in aged mice are virtual memory cells . J Immunol. 2013; ; 191 : :5793.–5796. 4.
Weinreich MA, Odumade OA, Jameson SC, Kristin A. PLZF+ T cells regulate memory-like CD8+ T cell development . Nat Immunol. 2011; ; 11 : :709.–716. 5.
Intlekofer AM, Takemoto N, Wherry EJ, et al. Effector and memory CD8+ T cell fate coupled by T-bet and eomesodermin . Nat Immunol. 2005; ; 6 : :1236.–1244. 6.
Banerjee A, Gordon SM, Intlekofer AM, et al. Cutting edge: the transcription factor eomesodermin enables CD8+ T cells to compete for the memory cell niche . J Immunol. 2010; ; 185 : :4988.–4992. 7.
Gordon SM, Carty SA, Kim JS, et al. Requirements for eomesodermin and promyelocytic leukemia zinc finger in the development of innate-like CD8+ T cells . J Immunol. 2011; ; 186 : :4573.–4578. 8.
Martinet V, Tonon S, Torres D, et al. Type I interferons regulate eomesodermin expression and the development of unconventional memory CD8+ T cells . Nat Commun. 2015; ; 6 : :7089.. 9.
Soudja SMH, Ruiz AL, Marie JC, Lauvau G. Inflammatory monocytes activate memory CD8+ T and innate NK lymphocytes independent of cognate antigen during microbial pathogen invasion . Immunity. 2012; ; 37 : :549.–562. 10.
Min HS, Lee YJ, Jeon YK, et al. MHC class II-restricted interaction between thymocytes plays an essential role in the production of innate CD8+ T cells . J Immunol. 2011; ; 186 : :5749.–5757. 11.
Jacomet F, Cayssials E, Basbous S, et al. Evidence for eomesodermin-expressing innate-like CD8+ KIR/NKG2A+ T cells in human adults and cord blood samples . Eur J Immunol. 2015; ; 45 : :1926.–1933. |