| |
| Med Sci (Paris). 2016 March; 32(3): 241–244. Published online 2016 March 23. doi: 10.1051/medsci/20163203005.Le facteur nétrine-1 régule la reprogrammation cellulaire vers l’état pluripotent Patrick Mehlen1* and Fabrice Lavial2** 1Laboratoire Apoptose, Cancer et Développement - équipe labellisée La Ligue, LabEx DEVweCAN, centre de recherche en cancérologie de Lyon, Inserm U1052-CNRS UMR5286, université de Lyon, centre Léon Bérard, 28, rue Laennec, 69008Lyon, France 2Laboratoire Reprogrammation cellulaire et oncogenèse - équipe ATIP/Avenir, centre de recherche en cancérologie de Lyon, Inserm U1052-CNRS UMR5286, université de Lyon, centre Léon Bérard, 69008Lyon, France MeSH keywords: Dédifférenciation cellulaire, Reprogrammation cellulaire, Épigenèse génétique, Humains, Cellules souches pluripotentes induites, Facteurs de croissance nerveuse, Transduction du signal, Transcriptome, Protéines suppresseurs de tumeurs, génétique, physiologie |
En 2006, l’équipe de Shynia Yamanaka a présenté un protocole de génération de cellules souches pluripotentes induites (iPS) [1]. Ces chercheurs ont démontré que l’expression exogène de quatre facteurs de transcription, le cocktail OSKM (Oct4, octamer-binding transcription factor 4 ; Sox2, SRY [sex determining region Y]-box 2 ; Klf4, Kruppel-like factor 4 ; c-Myc), dans une cellule somatique différenciée, est suffisante pour induire une reprogrammation épigénomique globale conduisant à l’émergence de cellules, les cellules iPS, OSKM ayant éteint le génome somatique et réactivé le circuit pluripotent [12] (→). Au delà de la prouesse technique, ce procédé ouvre d’incroyables perspectives en terme de médecine régénérative. Dans le cas de pathologies tissulaires dégénératives, des cellules iPS peuvent être générées in vitro de manière autologue à partir de cellules isolées des patients (sang, peau, etc.) et induites à se redifférencier dans le lignage endommagé avant leur transplantation. Il est même possible de combiner cette approche avec la correction d’une anomalie génétique dans les cellules iPS. Cependant, le processus est encore limité par sa très faible efficacité et par la qualité hétérogène des clones de cellules iPS obtenus, notamment en terme de potentiel de différenciation.
(→) Voir la Nouvelle de L. Lapasset et al., m/s n° 11, novembre 2010, page 902
|
Identifier les mécanismes protégeant la cellule somatique contre la dédifférenciation et la reprogrammation La reprogrammation pluripotente est un processus stochastique complexe qui nécessite, entre autres, d’effacer la signature épigénétique de la cellule somatique et d’établir l’épigénome pluripotent, divisant le processus en deux grandes phases (Figure 1) [13] (→). La phase tardive, principalement caractérisée par la réactivation des réseaux moléculaires de pluripotence, est bien caractérisée. Les mécanismes responsables de l’initiation de la dédifférenciation de la cellule somatique restent en revanche mal connus. Pourtant, cette étape de perte d’identité des cellules somatiques peut être considérée comme le socle commun à un certain nombre de stratégies de reprogrammation développées pour générer des cellules souches pluripotentes, mais également des cellules neurales, endothéliales, cardiomyocytaires ou hépatocytaires (Figure 1) [2]. Une meilleure compréhension des mécanismes moléculaires gouvernant la perte d’identité d’une cellule somatique est donc importante pour améliorer les conditions de génération de cellules reprogrammées et accélérer leur utilisation clinique.
(→) Voir la Synthèse de L. David et J. De Vos, m/s n° 4, avril 2013, page 405
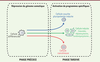 | Figure 1.
Les 2 grandes phases du processus de reprogrammation cellulaire. La reprogrammation implique la perte d’identité et la dédifférenciation de la cellule somatique (phase précoce) puis l’acquisition d’une nouvelle identité et de nouvelles propriétés (phase tardive). Ces étapes sont communes à divers types de reprogrammation et pourraient également se mettre en place au cours du processus oncogénique. |
|
Disséquer les interactions des facteurs OSKM avec le génome de la cellule somatique pour mieux comprendre la génération des cellules reprogrammées Au cours des étapes précoces de la reprogrammation, un paramètre essentiel est l’efficacité des facteurs OSKM à se lier et à remodeler la chromatine de leurs gènes cibles. Par une approche d’immunoprécipitation de chromatine couplée à un séquencage haut débit (ChIP-seq) dans les cellules différenciées (fibroblastes) et pluripotentes (iPS), l’équipe de Kenneth Zaret a démontré l’existence de 264 régions génomiques DBR (pour « régions différentiellement liées ») qui sont inaccessibles à OSKM dans les premiers jours de la reprogrammation dans la cellule différenciée, alors qu’elles sont occupées par les 4 facteurs dans la cellule pluripotente [3]. À partir de cette observation, nous avons émis l’hypothèse suivante : puisque le remodelage épigénétique des régions DBR est rendu difficile par certaines barrières épigénétiques, la régulation des gènes localisés dans ces régions pourrait ne pas se mettre en place correctement, conduisant à des niveaux d’expression incompatibles avec la reprogrammation cellulaire. Nous avons ainsi sélectionné les 705 gènes localisés dans les régions DBR et identifiés comme des freins potentiels à la génération des cellules iPS. La liste de candidats a ensuite été restreinte aux gènes associés à la mort cellulaire programmée (ou apoptose), une barrière connue à la reprogrammation cellulaire. Cette méthode nous a permis d’obtenir une liste de 32 candidats parmi lesquels de nombreux membres de la voie de signalisation nétrine-1 : les gènes codant le ligand nétrine-1 et ses récepteurs DCC (deleted in colorectal carcinoma) [14] (→), Unc5B et Unc5D (Unc-5 netrin receptor B/D). La nétrine-1 est une protéine sécrétée, de la famille des laminines, initialement impliquée dans la navigation des neurones [4] (→) et plus récemment identifiée comme un facteur causal de la progression tumorale, par blocage de l’apoptose induite par ses récepteurs à dépendance1 DCC et Unc5H. L’implication de ce type de molécules dans la reprogrammation cellulaire vers l’état pluripotent n’avait jusque-là pas été décrite.
(→) Voir la Nouvelle de L. Broutier et M. Castets, m/s n° 5, mai 2012, page 465
(→) Voir la Synthèse de P. Mehlen et N. Rama, m/s n° 3, mars 2007, page 311
|
Les niveaux du ligand nétrine-1 contrôlent la reprogrammation vers l’état pluripotent Nous avons montré que le profil d’expression de la nétrine-1 est biphasique lors de la reprogrammation de fibroblastes embryonnaires de souris (MEF, mouse embryonic fibroblasts). Les premiers jours du processus s’accompagnent d’une diminution transitoire de l’expression de la nétrine-1, suivie d’une réexpression dans les cellules reprogrammées. Le mécanisme épigénétique responsable de cette répression momentanée repose sur le recrutement du complexe répressif NuRD (nucleosome remodeling deacetylase) sur le promoteur de la nétrine-1 par les facteurs Oct4 et Klf4. Les travaux de l’équipe de recherche de Jacob Hanna ont en effet montré que le recrutement antagoniste de ce complexe épigénétique répressif sur des gènes à activer dans les cellules iPS est un frein majeur à la reprogrammation [5]. Nous avons ensuite démontré que cette répression de la nétrine-1 induit une apoptose médiée par le récepteur DCC au cours de la reprogrammation (Figure 2). DCC fait en effet partie de la famille des récepteurs à dépendance capables d’être actifs en l’absence de leur ligand, en induisant un signal apoptotique via le clivage de leur domaine intracellulaire. Ainsi, les difficultés rencontrées par les facteurs OSKM pour remodeler et activer l’expression du gène nétrine-1 activent un programme de mort cellulaire en début de reprogrammation. Nous nous sommes dès lors demandé si le déficit endogène en nétrine-1 pouvait être compensé par le traitement des cellules avec une forme recombinante de cette protéine ajoutée au milieu de culture. Cette approche, non invasive, pourrait ainsi limiter l’apoptose et améliorer les conditions de génération des cellules iPS, sans avoir recours à de nouveaux transgènes. Ce traitement simple permet en effet de multiplier d’un facteur 5 à 15 le nombre de colonies reprogrammées obtenues à partir de cellules somatiques murines et humaines (Figure 2). Des analyses moléculaires combinées à des tests fonctionnels ont permis de démontrer que les cellules générées en présence de cette molécule recombinante présentent des propriétés d’autorenouvellement et de différenciation similaires aux cellules contrôle [6]. De futurs travaux devront démontrer en quoi l’addition de nétrine-1, ou d’un mimétique de nétrine-1, pourrait devenir une approche complémentaire ou alternative aux procédés de reprogrammation actuellement testés cliniquement chez l’homme dans plusieurs pays.
 | Figure 2.
La nétrine-1 contrôle le processus de reprogrammation cellulaire. La phase précoce de la génération des cellules iPS est accompagnée d’un déficit en nétrine-1 endogène qui induit l’apoptose et limite la génération des cellules reprogrammées (schéma du haut). L’apport exogène de nétrine-1 recombinante protège les cellules contre l’apoptose et augmente ainsi l’efficacité de génération des cellules iPS (schéma du bas). DCC : deleted in colorectal carcinoma; iPS : cellules souches pluripotentes induites. |
|
Une analogie entre la reprogrammation cellulaire et l’oncogenèse : une histoire de dédifférenciation et d’acquisition de plasticité cellulaire De manière intéressante, la nétrine-1 est un facteur pro-oncogénique dans plusieurs types de tumeurs via son rôle de facteur de survie. Dans ces pathologies, le ligand protège les cellules de la mort cellulaire programmée induite par ses récepteurs [7–9]. Notre étude, en révélant que cette barrière oncogénique limite également la reprogrammation cellulaire, vient s’ajouter à d’autres travaux qui démontrent une analogie entre les processus de reprogrammation pluripotente et la tumorigenèse : (1) les 4 facteurs de reprogrammation sont en effet des oncogènes reconnus [10]. Oct4 gouverne l’initiation des tumeurs germinales. Sox2 agit comme un facteur de survie dans les cancers pancréatiques et Klf4 est impliqué dans le cancer du sein. Enfin, c-Myc contribue au processus de transformation de fibroblastes en coopération avec d’autres oncogènes et est fréquemment amplifié dans les cancers humains ; (2) certains freins à la reprogrammation pluripotente sont des barrières oncogéniques reconnues, comme la mort cellulaire et la sénescence ; (3) des régulateurs chromatiniens jouant un rôle essentiel dans la reprogrammation pluripotente ont des fonctions établies en oncogenèse ; enfin, (4) l’arrêt prématuré de la reprogrammation pluripotente in vivo conduit à la tumorigenèse [11]. Comme décrit dans la
Figure 1
, ces arguments laissent penser que des mécanismes similaires pourraient rendre une cellule permissive à un remodelage épigénétique global et réfractaire à la mort cellulaire au début de la reprogrammation pluripotente et de l’oncogenèse. Ainsi, l’étude des phases précoces de la reprogrammation pluripotente pourrait permettre de mieux appréhender l’initiation du processus tumoral. |
Les auteurs déclarent n’avoir aucun conflit d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors . Cell. 2006; ; 126 : :663.–676. 2.
Lin C, Yu C, Ding S. Toward directed reprogramming through exogenous factors . Curr Opin Genet Dev. 2013; ; 23 : :519.–525. 3.
Soufi A, Donahue G, Zaret KS. Facilitators and impediments of the pluripotency reprogramming factors’ initial engagement with the genome . Cell. 2012; ; 151 : :994.–1004. 4.
Mehlen P, Rama N. Nétrine-1 et guidage axonal : signalisation et traduction asymétrique . Med Sci (Paris). 2007; ; 23 : :311.–316. 5.
Rais Y, Zviran A, Geula S, et al. Deterministic direct reprogramming of somatic cells to pluripotency . Nature. 2013; ; 502 : :65.–70. 6.
Ozmadenci D, Feraud O, Markossian S, et al. Netrin-1 regulates somatic cell reprogramming and pluripotency maintenance . Nat Commun. 2015; ; 6 : :7398.. 7.
Fitamant J, Guenebeaud C, Coissieux MM, et al. Netrin-1 expression confers a selective advantage for tumor cell survival in metastatic breast cancer . Proc Natl Acad Sci USA. 2008; ; 105 : :4850.–4855. 8.
Mazelin L, Bernet A, Bonod-Bidaud C, et al. Netrin-1 controls colorectal tumorigenesis by regulating apoptosis . Nature. 2004; ; 431 : :80.–84. 9.
Castets M, Broutier L, Molin Y, et al. DCC constrains tumour progression via its dependence receptor activity . Nature. 2012; ; 482 : :534.–537. 10.
Suva ML, Riggi N, Bernstein BE. Epigenetic reprogramming in cancer . Science. 2013; ; 339 : :1567.–1570. 11.
Ohnishi K, Semi K, Yamamoto T, et al. Premature termination of reprogramming in vivo leads to cancer development through altered epigenetic regulation . Cell. 2014; ; 156 : :663.–677. 12.
Lapasset L, Milhavet O, Lemaitre JM. La reprogrammation vers la pluripotence peut-elle effacer la mémoire d’une vie antérieure ? Med Sci (Paris). 2010; ; 26 : :902.–903. 13.
David L. John De Vos J. La reprogrammation, un jeu de hasard ? Med Sci (Paris). 2013; ; 29 : :405.–410. 14.
Broutier L, Castets L. DCC : come back d’un gène suppresseur de tumeur controversé . Med Sci (Paris). 2012; ; 28 : :465.–468. |



