| |
| Med Sci (Paris). 2016 March; 32(3): 303–305. Published online 2016 March 23. doi: 10.1051/medsci/20163203016.Chroniques génomiques - Les spermatozoïdes de l’obésité Bertrand Jordan1,2* 1UMR 7268 ADÉS, Aix-Marseille, Université/EFS/CNRS, Espace éthique méditerranéen, hôpital d’adultes la Timone, 264, rue Saint-Pierre, 13385 Marseille Cedex 05, France 2CoReBio PACA, case 901, parc scientifique de Luminy, 13288 Marseille Cedex 09, France MeSH keywords: Épigenèse génétique, Prédisposition génétique à une maladie, Hétérozygote, Humains, Modes de transmission héréditaire, Mâle, Obésité, Spermatozoïdes, génétique, physiologie |
La réalité de phénomènes de transmission transgénérationnelle par voie épigénétique chez l’homme est maintenant admise, même si elle n’a été réellement démontrée que dans quelques cas. Comme indiqué par plusieurs articles présentés dans le numéro thématique consacré à la DOHaD (→) [1], le plus connu d’entre eux est celui des femmes qui avaient souffert de malnutrition sévère lors de la famine survenue à l’hiver 1944/1945 aux Pays-Bas : leurs filles, bien plus tard, ont donné naissance à des enfants présentant un poids à la naissance inférieur à la normale [2]. Une variation de l’environnement subi par la mère a donc été transmise à sa fille et a produit ses effets à son niveau, et il ne s’agit évidemment pas d’une modification de la séquence de l’ADN. Ces phénomènes ont été largement étudiés depuis chez l’animal et chez l’homme, divers mécanismes ont été mis à jour (méthylation de l’ADN, positionnement ou modification des histones, etc.), et de nombreux auteurs se sont notamment intéressés à une possible transmission épigénétique de la tendance à l’obésité. Celle-ci peut bien sûr avoir une base génétique [3], l’environnement et le mode de vie ont également une influence très importante, mais il semble bien qu’indépendamment de ces deux facteurs l’obésité, notamment chez le père, favorise celle des enfants [4]. Une revue récente [5] fait un point très intéressant sur ces « effets transgénérationnels » [1] (→). Je vais résumer dans cette chronique un article paru au début de l’année [6], qui cherche à caractériser des variations épigénétiques au niveau des spermatozoïdes humains en fonction du degré d’obésité des individus correspondants – ce qui pourrait en faire les vecteurs d’une tendance à l’obésité, comme le souligne le titre d’un écho sur ce travail paru dans Nature Reviews Genetics : Sperm as obesity propagator ? [7].
(→) Voir le numéro thématique DOHaD, m/s n° 1, janvier 2016
(→) Voir également le numéro thématique DOHaD, m/s n° 1, janvier 2016
|
Les maigres et les gros : des différences assez subtiles Les auteurs ont analysé les spermatozoïdes de 13 personnes d’embonpoint normal (IMC moyen 22,9)1, et de 10 obèses (IMC moyen 31,8), du point de vue du positionnement des histones (par digestion à la nucléase de Micrococcus
2), du contenu en petits ARN non codants (small non coding RNAs, sncRNAs) et de la méthylation (par séquençage après traitement au bisulfite). Aucune différence entre les deux groupes n’est observée pour le positionnement des histones. Au niveau des sncARN, les espèces les plus représentées sont des fragments d’ARN de transfert ainsi que des ARN interagissant avec les protéines Piwi (piARN), qui sont impliqués dans la régulation de l’expression génique [8]. Des différences d’expression significatives sont observées pour une quarantaine de piARN, dont certains pourraient réguler des gènes impliqués dans l’appétit. Les différences trouvées sont néanmoins modestes, avec un recouvrement partiel ou parfois total des valeurs observées dans les deux groupes (Figure 1).
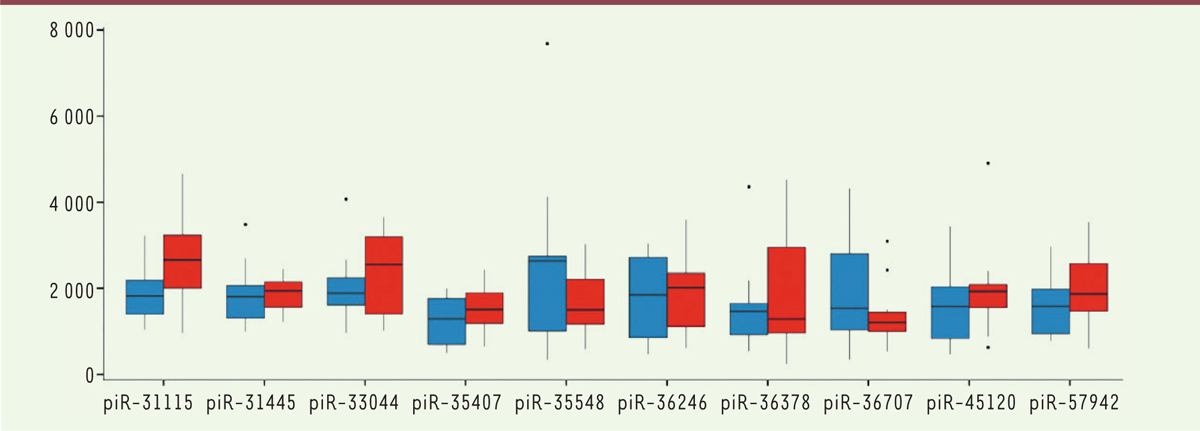
 | Figure 1.
Expression différentielle de piARN chez les « maigres » et les « gros ». En ordonnée, niveau d’expression normalisé par rapport au total des piARN dans l’échantillon ; bleu : sujets maigres, rouge : sujets gros. Il s’agit sans doute des différentiels les plus nets, on voit qu’ils se recouvrent néanmoins largement. Les points noirs correspondent aux valeurs considérées aberrantes par les auteurs (extrait de la Figure 2 de Donkin et al. [ 6]). |
Les données de méthylation, elles, montrent que de nombreux gènes, plus de 9 000, sont différentiellement méthylés, avec des écarts parfois importants entre les spermatozoïdes provenant des deux groupes. Une analyse de la nature de ces gènes (annotation par Gene Ontology) montre un enrichissement modeste pour ceux qui sont impliqués dans le développement et la fonction du système nerveux central (Figure 2). Les auteurs font le rapprochement avec des travaux indiquant un risque accru d’autisme chez les enfants dont le père est obèse [9] – compte tenu de la modestie de l’enrichissement observé (Figure 2), on peut cependant rester assez sceptique. Enfin une analyse de variants ADN connus pour être impliqués dans l’obésité exclut que ceux-ci soient responsables des différences observées (en d’autres termes, qu’il s’agisse d’un phénomène génétique et non épigénétique).
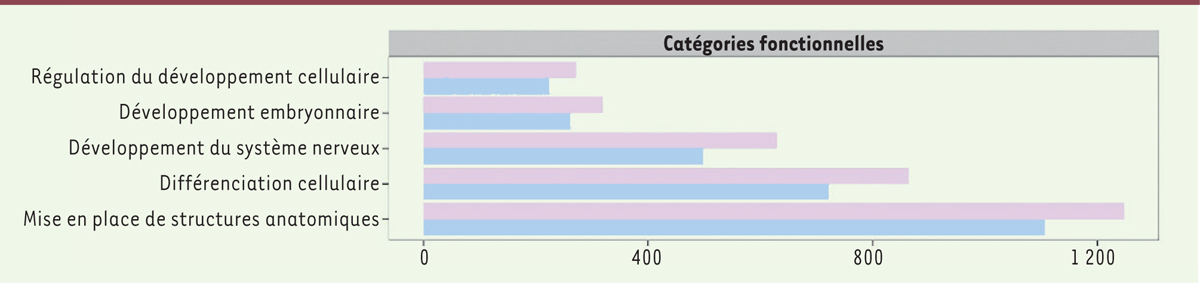
 | Figure 2.
Gènes annotés en termes fonctionnels (Gene Ontology) dans les bases de données. En rose : gènes différentiellement méthylés ; en bleu : ensemble des gènes annotés. On voit que les gènes appartenant aux catégories présentées sont un peu plus fréquents parmi les gènes différentiellement méthylés (extrait de la figure 3 de Donkin et al. [ 6]). |
Au total donc, on trouve bien des différences d’ordre épigénétique entre les spermatozoïdes des « maigres » et ceux des « gros » – mais ces différences sont assez subtiles et difficiles à interpréter vue leur complexité. Les auteurs vont alors utiliser de manière ingénieuse une situation médicale existante pour tenter de confirmer leurs résultats. |
Les obèses opérés : un « système expérimental » Si l’on travaillait sur un modèle animal comme la souris, on pourrait comparer les spermatozoïdes de l’animal à l’état normal et après gavage pour le rendre obèse… Ce n’est évidemment pas possible pour l’homme, mais on peut accéder à la situation inverse : des patients souffrant d’obésité grave (IMC supérieur à 40, soit 130 kg pour 1m80) avant et après réalisation d’un bypass gastrique (ou court-circuit gastrique)3 qui aboutit généralement à un amaigrissement significatif (10 points d’IMC en moins). L’analyse des spermatozoïdes a donc été effectuée sur six obèses graves (IMC moyen 42,6) avant, juste après et un an après l’opération (IMC moyen à cette date 33,9). Seule la méthylation est rapportée, elle montre des changements importants à la suite de l’opération, la plupart apparaissant dès le premier prélèvement (effectué après une semaine) et la majorité étant également trouvée dans la comparaison précédente entre « maigres » et « gros ». Les auteurs insistent sur le fait que nombre des gènes présentant une méthylation différentielle dans les deux comparaisons rapportées ont été préalablement associés au risque d’obésité dans des études de type GWAS (genome-wide association studies). Aucun des allèles liés à l’obésité n’est présent chez les sujets de cette étude, il ne s’agit donc pas d’un effet génétique mais bien de modifications épigénétiques portant sur des gènes repérés par ailleurs (grâce aux études génétiques) comme impliqués dans la tendance à l’obésité. Cela dit, compte tenu du grand nombre de gènes différentiellement méthylés, il n’est pas sûr que cette observation soit réellement significative. Notons aussi qu’une exploration limitée de la méthylation de l’ADN dans d’autres cellules (lymphocytes et adipocytes) montre un patron différent de celui que l’on observe dans les spermatozoïdes : l’empreinte épigénétique trouvée dans les spermatozoïdes semble spécifique de ces cellules. |
Une étude « suggestive » mais encore préliminaire et incomplète Globalement, l’ensemble des résultats rapportés va dans le sens visiblement souhaité par les auteurs : mettre en évidence une empreinte épigénétique sur l’ADN des spermatozoïdes d’individus obèses, laquelle pourrait éventuellement rendre compte d’une transmission à la descendance de la propension à l’obésité – mais les effets observés ne sont pas bien nets, ni vraiment spécifiques, et il peut subsister un certain doute. J’avais déjà noté, à propos de la résilience [10] (→), la relative fragilité des données moléculaires dans ce domaine médiatiquement très « chaud » de la transmission épigénétique. On a certes un faisceau d’indications, dans deux situations différentes, qui forme un ensemble assez cohérent, mais il manque la mise en évidence d’effets vraiment spécifiques, et surtout la question d’un effet sur la descendance reste ouverte. Cet article a néanmoins le mérite de montrer que les spermatozoïdes peuvent porter une empreinte épigénétique, et que celle-ci est influencée par le degré d’obésité du sujet. On peut imaginer que d’autres types d’environnement puissent modifier d’une autre manière l’épigénome du spermatozoïde, et envisager que certains effets phénotypiques soient ainsi transmis à la descendance. De tels phénomènes ont été démontrés chez la souris [5], il n’y a pas de raison d’en exclure la possibilité chez l’homme – mais il reste beaucoup à faire pour en démontrer l’existence de manière concluante.
(→) Voir la Chronique génomique de B. Jordan, m/s n° 3, mars 2013, page 325
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Origine développementale de la santé et des maladies (DOHaD) . Environnement et épigénétique . Med Sci (Paris). 2016; ; 32 : :3.–130. 2.
Lumey LH. Decreased birthweights in infants after maternal in utero exposure to the Dutch famine of 1944–1945 . Paediatr Perinat Epidemiol. 1992; ; 6 : :240.–253. 3.
Chesi A, Grant SF. The genetics of pediatric obesity . Trends Endocrinol Metab. 2015; ; 26 : :711.–721. 4.
Lake JK, Power C, Cole TJ. Child to adult body mass index in the 1958 British birth cohort: associations with parental obesity . Arch Dis Child. 1997; ; 77 : :376.–381. 5.
Pembrey M, Saffery R, Bygren LO. Network in epigenetic epidemiology. Human transgenerational responses to early-life experience: potential impact on development, health and biomedical research . J Med Genet. 2014; ; 51 : :563.–572. 6.
Donkin I, Versteyhe S, Ingerslev LR, et al. Obesity and bariatric surgery drive epigenetic variation of spermatozoa in humans . Cell Metab. 2016; ; 23 : :1.–10. 7.
Koch L. Epigenomics: sperm as obesity propagator? Nat Rev Genet. 2016; ; 17 : :6.. 8.
Esposito T, Magliocca S, Formicola D, Gianfrancesco F. piR_015520 belongs to Piwi-associated RNAs regulates expression of the human melatonin receptor 1A gene . PLoS One. 2011; ; 6 : :e 22727.. 9.
Surén P, Gunnes N, Roth C, et al. Parental obesity and risk of autism spectrum disorder . Pediatrics. 2014; ; 133 : :e1128.–e1138. 10.
Jordan B. Épigénétique et résilience . Med Sci (Paris). 2013; ; 29 : :325.–328. |